酸碱滴定法基本原理
学习本节,需要通篇考虑以下三个问题:
ü滴定能否准确进行?——反应进行程度
ü滴定过程中pH的变化规律?
ü怎样选择合适的指示剂?
一、强酸强碱的滴定
1、反应进行程度
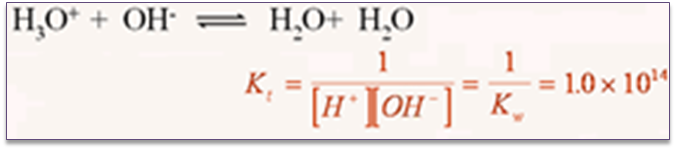
Kt:酸碱滴定反应常数→水溶液中酸碱滴定反应完全程度
强酸强碱——反应完全程度高
2、强碱滴定强酸
示例:NaOH(0.1000mol/L)→HCl(0.1000mol/L, 20.00mL)
(1)滴定过程中的pH值的变化
重点考查四个特征点:
ü 滴定前;pH=1.0
ü 滴定开始到化学计量点(sp点)前0.1%时:pH=4.3
此时,加入NaOH 19.98 mL
ü 化学计量点,即sp点时:pH=7.0
ü 化学计量点(sp点)以后的0.1%时:pH=9.7
此时,加入NaOH 20.02 mL
(2)滴定曲线(pH vs V)
消耗滴定剂NaOH体积(mL)相对pH值作图。
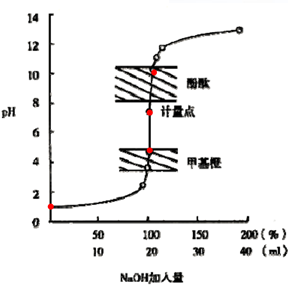
(3)滴定突跃
滴定突跃——滴定中化学计量点前后滴定体积0.1%的变化引起pH值等突变的现象。
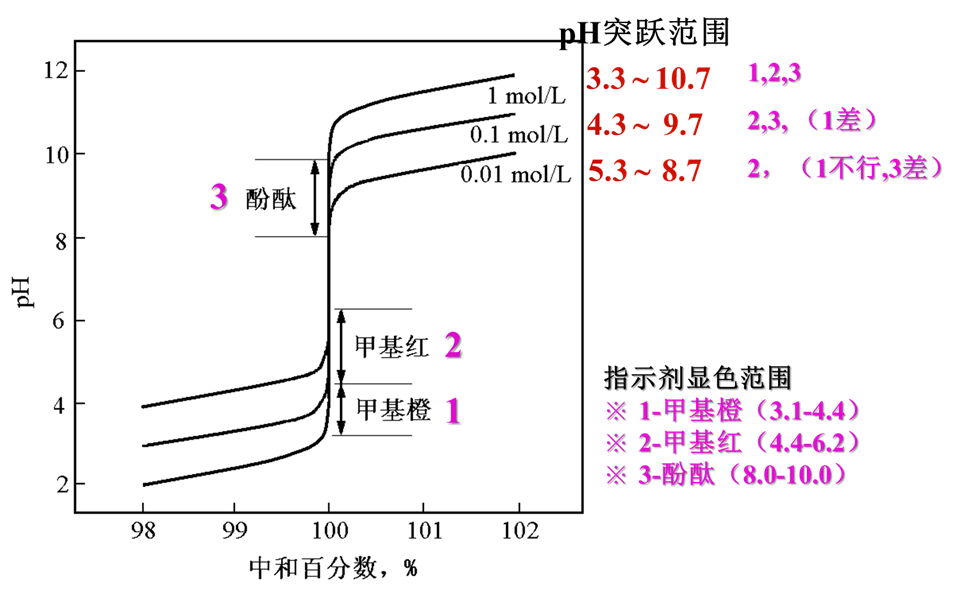
ü 滴定突跃范围——滴定突跃所在的范围。
⊿pH =4.3~9.7
ü 滴定突跃范围用途——利用滴定突跃选择指示剂。
ü 分析意义——指示剂变色点只要在滴定突跃范围内,误差就小于0.1%。
滴定突跃越大越好,越方便选择指示剂
(4)影响滴定突跃的因素
ü 浓度—— 浓度增大10倍,突跃增加2个pH单位。可选指示剂增多。
(5)指示剂的选择
3、强酸滴定强碱
示例:HCl(0.1000mol/L)→NaOH(0.1000mol/L, 20.00mL)
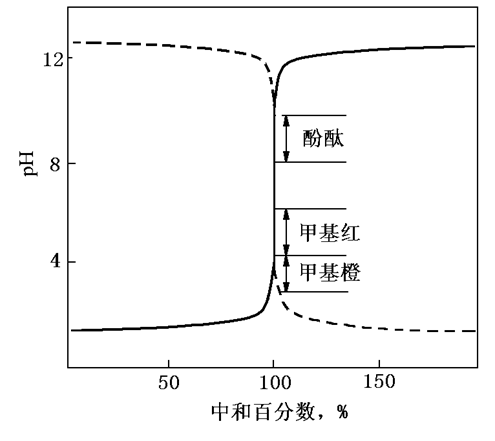
ü 滴定曲线形状类似强碱滴定强酸,pH变化相反
ü 滴定突跃范围决定于酸标液浓度及被测碱液浓度
ü 指示剂选择:甲基红,酚酞
二、一元弱酸(碱)的滴定
1、反应进行程度
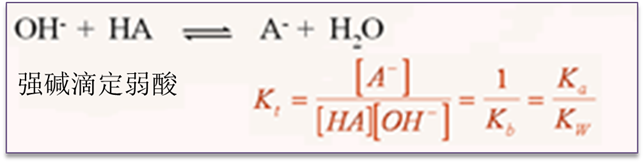
Kt:酸碱滴定反应常数→水溶液中酸碱滴定反应完全程度
弱酸(碱)的滴定——反应完全程度不高,取决于Ka,Kb
2、强碱滴定弱酸
示例:NaOH(0.1000mol/L)→HAc(0.1000mol/L, 20.00mL)
(1)滴定过程中的pH值的变化
重点考查四个特征点:
ü 滴定前;pH=2.88
ü 滴定开始到化学计量点(sp点)前0.1%时:pH=7.76
此时,加入NaOH 19.98 mL
ü 化学计量点,即sp点时:pH=8.73
ü 化学计量点(sp点)以后的0.1%时:pH=9.70
此时,加入NaOH 20.02 mL
(2)滴定曲线(pH vs V)
消耗滴定剂NaOH体积(mL)相对pH值作图。

(3)滴定突跃
ü 滴定突跃范围:⊿pH =7.76~9.70
(4)指示剂的选择
酚酞,百里酚酞
(5)影响滴定突跃的因素
ü 浓度—— 浓度增大10倍,突跃增加1个pH单位。
ü 酸的强度Ka—— Ka越小,突跃范围越小。
(6)弱酸被准确滴定的判别式
人眼对指示剂判断可以最小达到突跃0.4pH单位,有±0.2—±0.3%的不确定性。
以相对误差<0.2%为允许误差范围,即要求突跃不小于0.6pH单位,可以准确滴定的可行性判断如下:
cKa≥10-8
3、强酸滴定弱碱
示例:HCl(0.1000mol/L)→NH3.H2O(0.1000mol/L, 20.00mL)
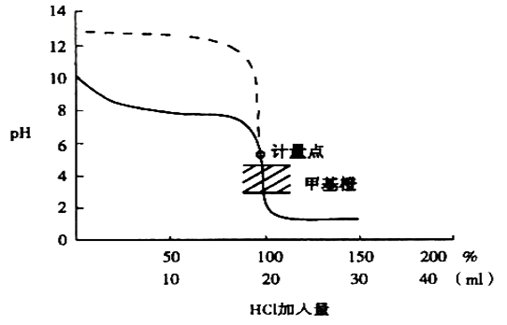
ü 滴定曲线形状类似强碱滴定弱酸,pH变化相反
ü 滴定突跃范围决定于被滴定碱的性质(Kb)、浓度
ü 指示剂选择:⊿pH=6.34-4.30,甲基橙,甲基红
ü 弱碱被准确滴定的判别式:cKb≥10-8
三、多元酸(碱)的滴定
1、强碱滴定弱酸
示例:NaOH(0.1000mol/L)→H3PO4(0.1000mol/L, 20.00mL)
(1)滴定曲线(pH vs V)
消耗滴定剂NaOH体积(mL)相对pH值作图。
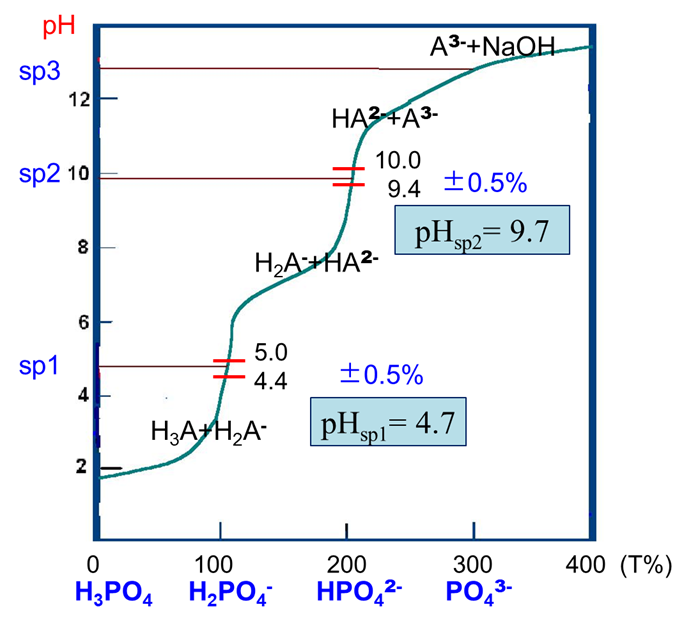
(3)滴定突跃和指示剂的选择
ü 滴定突跃范围1(误差±0.5%):⊿pH =4.4-5.0,甲基橙,由红变黄
ü 滴定突跃范围2(误差±0.3%):⊿pH =9.4~10.0,百里酚酞,无色变浅蓝
(4)每一级酸被准确滴定的判别式
人眼对指示剂判断可以最小达到突跃0.4pH单位,有±0.2—±0.3%的不确定性。
以相对误差<0.2%为允许误差范围,即要求突跃不小于0.6pH单位,可以准确滴定的可行性判断如下:
c0Kan≥10-8 (c0为酸的初始浓度)
(5)每一级酸能分步滴定的判别式
强碱滴定多元酸时,第一化学计量点的突跃范围与Ka1/Ka2有关,其他化学计量点附近的突跃也是如此。如果Ka1/Ka2太小,前一步中和反应尚未结束,后一步中和反应就已经开始,导致pH没有明显突变,前后两步中的质子就无法分开滴定。
因此,若要相邻两步解离相互不影响,需满足:
Ka1/Ka2>105 此时,允许Et=±0.5%
问题:0.1mol·L-1NaOH能全部滴定0.1mol·L-1H3PO4吗?为什么》
2、多元碱的滴定
多元碱分步滴定的条件(判别式):
被滴定的酸足够强,,c0Kbn≥10-8,(c0为酸的初始浓度)
相邻两步解离相互不影响,△lgKb足够大,Kb1/Kb2>105,允许Et=±0.5%
本小节微课
本节自测题
酸碱滴定实验视频


