金属离子指示剂
一、金属离子指示剂及其特点
Ø金属离子指示剂:能与金属离子络合,并由于络合和离解作用而产生明显颜色的改变,以指示被滴定的金属离子在计量点附近浓度变化的一种指示剂,称为金属指示剂。
Ø 多为有机染料、弱酸
【思考:请与酸碱指示剂进行比较】
二、金属指示剂的显色原理
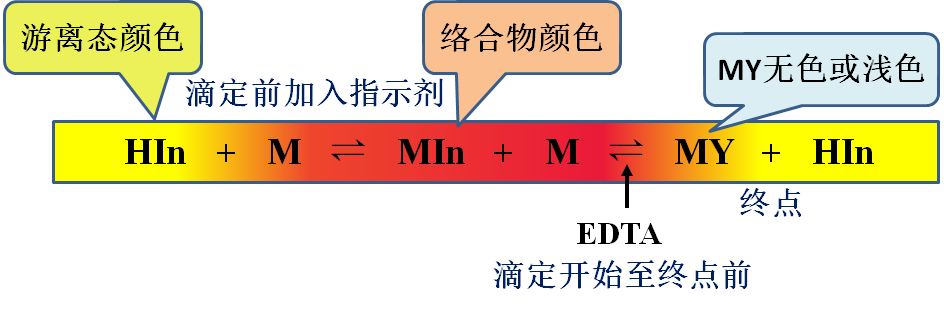
变色实质:EDTA置换少量与指示剂配位的金属离子,释放指示剂,从而引起溶液变色
注:In为有机弱酸,颜色随pH值变化→需控制溶液的pH值,一般都加缓冲溶液。
三、金属指示剂应具备的条件
1、MIn与 In 颜色明显不同;
2、M与 In 显色迅速、灵敏,变色可逆性好;
3、MIn的稳定性适当:KMY /KMIn >102
a. KMIn 太小→置换速度太快→终点提前;
b.KMIn >KMY →置换难以进行→终点拖后或无终点;
4、MIn易溶于水,不应形成胶体或沉淀;
5、In本身性质稳定,便于储藏使用。
四、金属指示剂的封闭、僵化现象及其消除方法
![]()
产生原因1:
Ø待测离子:KMIn>KMY →M与In反应不可逆或过慢
ü消除方法:返滴定法
产生原因2:
Ø干扰离子:KNIn>KNY →指示剂无法改变颜色
ü消除方法:加入掩蔽剂
![]()
产生原因:
ØMIn溶解度小→与EDTA置换速度缓慢→终点拖后
ü消除方法:加入有机溶剂或加热→提高MIn溶解度→加快置换速度
![]()
五、常用金属指示剂
1、铬黑T(Eriochrome Black T,EBT)
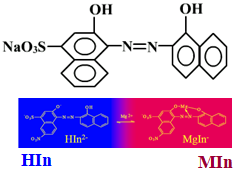
ü终点:酒红→纯蓝
ü适宜pH范围:7.0~11.0(碱性区)(酸性显色不明显)
ü缓冲体系:NH3-NH4Cl
ü封闭离子:Al3+,Fe3+,(Cu2+,Ni2+)
ü适用于滴定:Zn2+、Mg2+、Cd2+、Pb2+、Mn2+ 等。
单独滴定Ca2+时,变色不敏锐,常用于滴定钙、镁合量。
ü掩蔽剂:三乙醇胺,KCN
2、二甲酚橙(Xylenol Orange,XO)

ü终点:紫红→亮黄
ü适宜pH范围:<6.0(酸性区)
ü缓冲体系:HAc-NaAc
ü封闭离子:Al3+,Fe3+,(Cu2+,Ni2+,Co2+)
ü滴定:Pb2+、Zn2+、Cd2+、Hg2+。pH 1~2 时滴定Bi3+
ü掩蔽剂:三乙醇胺,氟化胺
3、其他金属离子指示剂(自学)
•PAN指示剂
•钙指示剂
•…
本小节微课
本节自测题


