配位滴定中的滴定剂
一、无机配位剂(单基配位)
如NH3,CN-,F-
特点:络合物不稳定,形成逐级络合物,产物不单一。
用途:(1)主要用于掩蔽剂,不用于分析;
(2)汞量法测Cl-、 SCN-,氰量法测Ag。
二、有机配位剂
有机配体分子中常含有两个及以上配位原子,可以形成稳定的环状螯合物,因此又常称为螯合剂。
1、“OO型”螯合剂——两个氧原子为配位原子
如:多元醇、酸,酚等;
2、“NN型”螯合剂——通过氮原子为配位原子
如:有机胺,含氮杂环化合物等;
3、“NO型”螯合剂——通过氮原子和氧原子为配位原子
如:氨羧配位剂等;
氨氮—— 羧氧——
羧氧——
4、含硫螯合剂——“SS型”、“SO型”、“SN型”
大多数有机配体不能用于直接滴定。
三、乙二胺四乙酸(EDTA)
Ethylene Diamine Tetraacetic Acid
分析化学中使用最广泛的螯合剂。
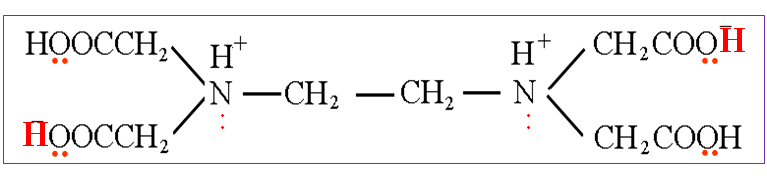
特点:(1)和绝大多数金属离子形成稳定络合物,配比1:1;
(2)是个六元酸;
(3)EDTA在水中溶解度小,难溶于酸和有机溶剂;
(4)易溶于NaOH或氨溶液的是:Na2H2Y.2H2O——也称EDTA
用途:分析化学中使用最广泛的螯合剂。
(1)用于配位滴定;
(2)用作掩蔽剂。
![]()
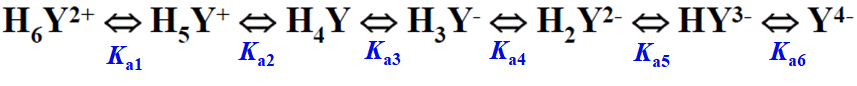
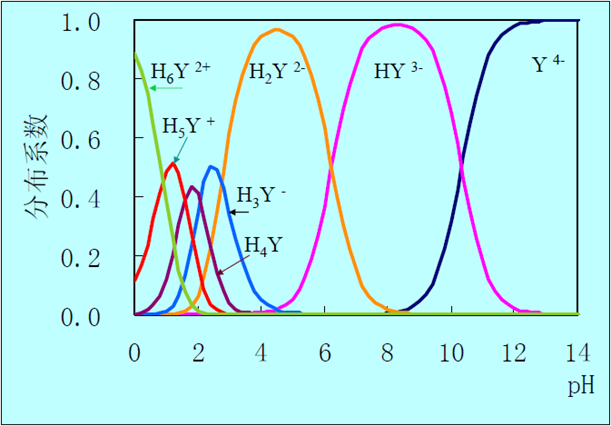
pH<1,强酸溶液→H6Y2+ pH= 2.67~6.16 →H2Y2-
pH>10.26 碱性溶液→Y4-(最佳配位型体——滴定过程中所利用)
![]()
ü广泛,EDTA几乎能与所有的金属离子形成络合物;
ü生成环状结构络合物,稳定;
ü与多数离子的络合反应速度快,水溶性好;
ü络合比简单,大部分为1:1;
üEDTA与无色的金属离子形成无色的络合物,与有色的金属离子形成颜色更深的络合物。
络合滴定法是在EDTA出现之后快速发展。
本小节微课
本节自测题


