酸碱平衡理论
滴定分析中的计算依据——化学计量关系
一、酸碱的定义(质子理论)
酸——凡能给出质子的物质
碱——凡能接受质子的物质
两性物质——既能接受质子,又能给出质子的物质
二、酸碱反应

Ø 酸碱半反应:酸给出质子的反应,碱接受质子的反应
Ø 酸碱反应:两个半反应构成一个完整的酸碱反应

Ø 酸碱反应的实质——质子传递, 酸碱反应中质子平衡——质子有得必有失
三、溶剂的质子自递反应及其常数
溶剂的质子自递反应——发生在溶剂间的质子转移,溶剂既为酸,也为碱。
![]() ——水的质子自递反应
——水的质子自递反应
水的质子自递反应常数(平衡常数)KW
25℃时,![]() ,即:pH + pOH=14
,即:pH + pOH=14
四、酸碱强度
(1)一元酸碱的强度
Ø 一元酸的强度
酸的强度——给出质子的能力强弱
![]()
反应平衡常数,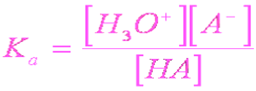
Ka又称为酸度常数,反映出酸释放出质子的能力,是衡量酸强度的参数。
Ø 一元碱的强度
碱的强度——接受质子的能力强弱
![]()
反应平衡常数,![]()
Kb又称为碱度常数,反映出碱接受质子的能力,是衡量碱强度的参数。
共轭酸碱对满足:![]()
(2)多元酸碱的强度
以磷酸为例:
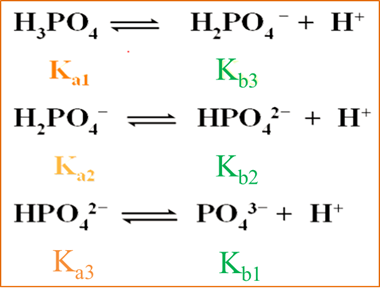

![]()
以此类推,多元酸酸度逐级减弱,其共轭碱的碱度则逐级增强。共轭酸碱对满足: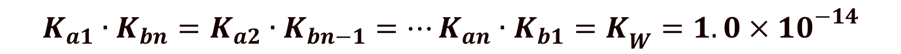
本小节微课
本节自测题


