沉淀滴定法
沉淀滴定法(PrecipitationTitrations)
——以沉淀反应为基础的滴定分析法。
一、沉淀滴定法的条件
1、沉淀的溶解度必须很小
2、反应迅速、定量
3、有适当的指示终点的方法
4、沉淀的吸附现象不能影响终点的确定
沉淀反应很多,但能用于沉淀滴定的不多,应用较多的是生成难溶Ag盐的反应。
二、银量法
![]()
X- = Cl-, Br-, I-, CN-, SCN-
银量法可以定量分析:Cl-, Br-, I-, CN-, SCN-, Ag+
1、滴定曲线
沉淀滴定曲线——以被测金属离子浓度的pX- 对应滴定剂Ag+加入体积作图,得滴定曲线。
绘制方法1:取特征点(同酸碱滴定)
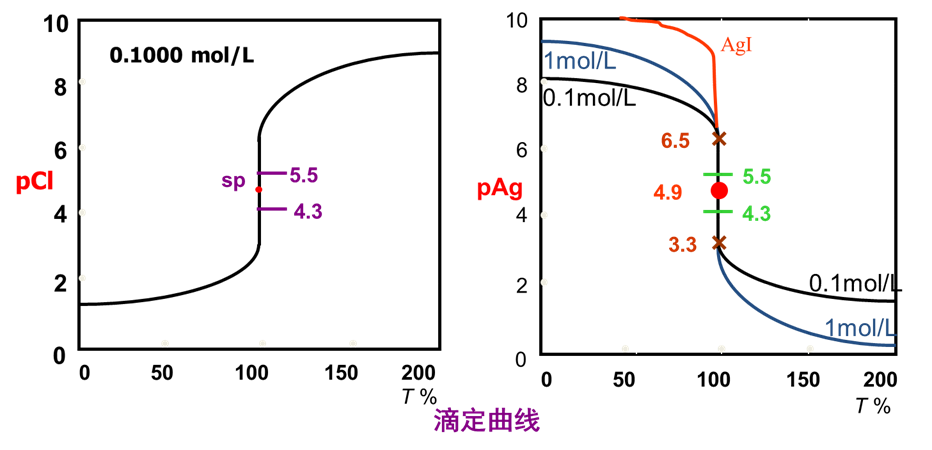
示例:0.1000 mol/L AgNO3⤵20.00 ml 同浓度NaCl溶液
(Ksp= [Ag+][Cl-]=1.8×10-10, pKsp= pAg+pCl=9.81)
(1)滴定过程中的pCl-值的变化
重点考查四个特征点:
ü 滴定前; [Cl-] = 0.1000 mol/L,pCl= 1.00
ü 化学计量点前,(Et= 0.1%):用未反应的Cl-计算,
[Cl-](剩) = 5.0 ´ 10-5mol/L, pCl = 4.30
ü 化学计量点,即sp点时:
[Ag+]=[Cl-],pCl= pAg= 1/2 pKsp = 4.89
ü 化学计量点后,(Et= 0.1%):根据过量的Ag+计算
[Ag+](过)= 5.0 ´ 10-5mol/L, pAg= 4.30
pCl= pKsp - pAg = 9.81 - 4.30 = 5.51
2、指示终点的方法
指示剂K2CrO4 —— Mohr 法
指示剂 [NH4Fe(SO4)2] —— Volhard法
吸附指示剂法——Fajans法
实验视频


