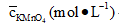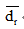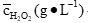实验7 KMnO4法测定H2O2的含量
一、实验目的
1、了解自动催化反应和自身指示剂的特点。
2、掌握KMnO4溶液的配制与标定。
3、理解KMnO4法测定H2O2含量的原理及方法。
二、实验原理
H2O2广泛应用于工业、生物和医药等领域,如纺织行业常用H2O2对纺织品进行漂白;医药领域常用H2O2进行消毒和杀菌;工业领域常利用H2O2的还原性除去Cl2,其反应式为:
H2O2+Cl2→2Cl-+2H++O2↑
另外,纯H2O2也可用作火箭燃料的氧化剂。
H2O2分子中有个过氧键—O—O—,在酸性溶液中它是一个强氧化剂。但它的氧化能力不如KMnO4,遇KMnO4时表现为还原剂。因此,室温条件下,在稀H2SO4溶液中,H2O2可被KMnO4定量氧化成O2和H2O,其反应式为:
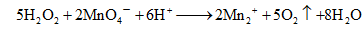
开始时反应速率缓慢,待Mn2+生成后,由于Mn2+的催化作用,反应速率加快,故称为自催化反应。稍过量的滴定剂(2×10-6mol·L-1)所呈现的微红色即表示终点到达。
三、主要试剂
实验用主要试剂见表7-1。
表7-1 主要试剂表
| 试 剂 | 规 格 | 试 剂 | 规 格 |
| Na2C2O4 | 基准物质 | H2SO4 | 3 mol·L-1 |
| KMnO4 | 0.02 mol·L-1 | MnSO4 | 1 mol·L-1 |
| H2O2 | A.R,浓度约为30% |
四、实验步骤
1、KMnO4溶液的配制
称取KMnO4固体约1.6g溶于500mL水中,盖上表面皿,加热至沸并保持微沸状态1小时,冷却后,用微孔玻璃漏斗(3号或4号过滤)。滤液贮存于清洁带塞的棕色试剂瓶中(最好将溶液在室温下静置2~3天后过滤备用)。
2、KMnO4溶液的标定
准确称取3份已于105~110℃烘干的Na2C2O4基准物质0.15~0.20g,分别置于250 mL锥形瓶中,加入60mL去离子水使之溶解,加入15 mL3 mol·L-1H2SO4溶液,水浴加热至75~85℃(即开始冒蒸气时的温度),趁热用KMnO4溶液滴定。开始滴定反应速率较慢,因此,每滴1d均要振荡一会,待溶液变为无色后,再继续滴加,当溶液中Mn2+产生后,反应速率加快,滴定速率相应也可加快(但仍需逐滴滴入),直到溶液呈微红色并持续0.5min内不褪色即为终点(滴定结束时的温度不应低于60℃)。平行测定3次。
3、H2O2含量的测定
用移量管移取1.00mL H2O2试样,置于250mL容量瓶中,加水稀释至刻度,充分摇匀后备用。
用移液管移取25.00mL配制好的H2O2溶液,置于250mL锥形瓶中,加10 mL去离子水,15mL 3 mol·L-1H2SO4溶液,2~3滴1mol·L-1MnSO4溶液,用KMnO4标准溶液滴定至溶液呈现微红色并持续半分钟内不褪色即为终点。平行测定3次。
五、实验数据记录与结果处理
1、KMnO4溶液的标定
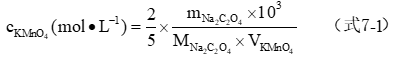
表7-2 KMnO4溶液浓度的标定
| 1 | 2 | 3 | |
| m Na2C2O4(g) | |||
| 滴定管初读数(mL) | 0.00 | 0.00 | 0.00 |
| 滴定管终读数(mL) | |||
| VKMnO4(mL) | |||
| c KMnO4(mol·L-1) | |||
|
| |||
|
| |||
2、H2O2含量的测定
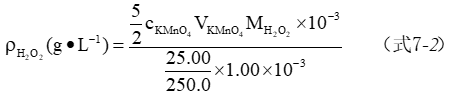
表7-3 H2O2含量的测定
| 1 | 2 | 3 | |
| 滴定管初读数(mL) | 0.00 | 0.00 | 0.00 |
| 滴定管终读数(mL) | |||
| VKMnO4(mL) | |||
| cH2O2(g·L-1) | |||
|
| |||
|
| |||
六、思考题
1、用Na2C2O4标定KMnO4溶液浓度时,酸度过高或过低有无影响,溶液的温度过高或过低有无影响?
2、标定KMnO4溶液浓度时,为什么第1dKMnO4加入后红色褪去很慢,以后褪色较快?
3、用KMnO4法测定H2O2时,为什么不能用HNO3或HCl来控制溶液的酸度?
七、注意事项
1、蒸馏水中常含有少量的还原性物质,可使KMnO4还原为MnO2·nH2O。细粉状的MnO2·nH2O能加速KMnO4的分解,故通常将KMnO4溶液煮沸一段时间,冷却后,再放置2~3天,使之充分反应,然后将沉淀物过滤除去。
2、在室温条件下,KMnO4与C2O42-之间的反应速度缓慢,故加热能提高反应速度。但加热温度又不能过高,如温度超过85℃,则有部分H2C2O4分解,反应式为:
H2C2O4=CO2↑+CO↑+H2O