实验6 H3PO4的电位滴定
一、实验目的
1、掌握酸度计测量溶液pH的操作要点。
2、了解电位滴定法的基本原理。
3、学会“三切线法”作图,并进行相应的数据处理。
二、实验原理
电位滴定法是根据滴定过程中,指示电极的电位或pH值产生“突跃”,从而确定滴定终点的一种分析方法。电位滴定法的仪器装置和操作都较容量滴定繁琐,但对某些一般容量滴定不能测量的测定,如被测溶液混浊、有颜色或无适当指示剂等,可用电位滴定法测定。另外,电位滴定法也可用来测定某些弱酸的电离平衡常数。
H3PO4的电位滴定,是以NaOH溶液为滴定剂,饱和甘汞电极为参比电极,pH玻璃电极为指示电极,将此两电极浸入试液中,使之组成电池。由于H3PO4的pKa1、pKa2及pKa3分别为2.12、7.20及12.36,在共存离子浓度很小的情况下,当ΔlgK>5时,即可进行分步滴定。显然,NaOH溶液可分步滴定H3PO4溶液,当滴定到H2PO4-时,出现第1次突跃(pH4.0~5.0),当滴定到HPO42-时,出现第2次突跃(pH9.0~10.0),由于cKa3<10-8,所以,HPO42-不能被继续准确滴定。
滴定反应如下:
H3PO4+OH- = H2PO4-
H2PO4- +OH- = HPO42-
以VNaOH为横坐标,相应溶液的pH值为纵坐标,绘制pH―V滴定曲线,曲线上呈现两个滴定突跃,在突跃部分用“三切线法”作图,可以较准确地确定两个滴定终点。在滴定曲线两端平坦转折处作AB和CD两条切线,在曲线“突跃部分”作EF切线与AB和CD两线相交于Q、P两点,通过Q、P两点分别作平行于横坐标的两条直线QH和PG,然后,在QH和PG两线间作垂直线,在垂直线一半的“O”点处,作平行于横坐标的O′O线,“O′”被称之为拐点,即为滴定终点,由O′点可分别得到滴定终点时的pH和VNaOH(mL)。
为了更好的确定化学计量点,也可以△pH/△V对V作图,得到一级微分曲线;或者以△2pH/△V2对V作图,得到二级微分曲线。
由pH―V滴定曲线,不仅可以确定滴定终点,而且可以求算cH3PO4以及H3PO4的pKa1和pKa2。
三、实验用品
1、仪器与器材
pHS-2型酸度计;复合电极;电磁搅拌器;磁子;碱式滴定管(50mL);烧杯(250 mL),移液管(20mL);洗耳球。
2、实验试剂
0.1 mol•L-1NaOH标准溶液;0.1 mol•L-1 H3PO4溶液;标准缓冲溶液(0.025mol•L-1 KH2PO4和0.025mol•L-1 Na2HPO4的混合溶液,pH=6.864);甲基橙指示剂(0.2%);酚酞指示剂(0.2%)。
四、实验步骤
1、0.1mol·L-1NaOH溶液的标定
参见实验2“NaOH和HCl标准溶液的配制与标定”。
2、酸度计的校正
(1)电极安装:将复合电极插入酸度计电极插口内,使用时把复合电极下面的保护套拔去。
(2)接通电源,打开开关,预热0.5h左右。
(3)将选择档转到pH处。
(4)定位和斜率调节:调节温度补偿旋钮使其和被测溶液温度相同。采用两种标准缓冲溶液调节斜率。
3、0.1 mol•L-1 H3PO4溶液的电位滴定
移取20.00mL 0.1 mol•L-1 H3PO4溶液于100mL烧杯中,加20mL去离子水,放入搅拌磁子,插入电极,开动电磁搅拌器,加入1d甲基橙和1d酚酞。
调节碱式滴定管中NaOH标准溶液的初读数为0.00mL。开始时每滴入2 mL NaOH标准溶液,测定1次pH值,记录NaOH标准溶液的体积和相应的pH值。滴定至pH约2.5时,每隔0.2mL测量(可借助甲基橙指示剂的变色来判断);pH约为6时,每隔2mL测量;pH约为7.5时,每隔0.2mL测量(可借助酚酞指示剂变色来判断);pH约为11时,每隔2mL测量。直至50 mL NaOH标准溶液滴完为止。
关上酸度计开关,用去离子水冲洗复合电极并用滤纸吸干后,套上浸盛有饱和KCl溶液的保护套。
五、实验数据记录与结果处理
1、pH―V滴定曲线绘制
以VNaOH为横坐标,相应溶液的pH值为纵坐标,绘制pH―V滴定曲线。
表6-1 0.1 mol•L-1H3PO4溶液的电位滴定
| VNaOH(mL) | pH | VNaOH(mL) | pH | VNaOH(mL) | pH | VNaOH(mL) | pH |
2、求算试样溶液中H3PO4的浓度
根据第一化学计量点所消耗NaOH标准溶液的体积V1(mL),计算试样溶液中H3PO4的浓度。
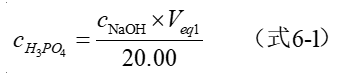
表6-2 试样溶液中H3PO4的浓度
| Veq1(mL) | 试样溶液中H3PO4的浓度(mol·L-1) |
3、求算H3PO4的pKa1和pKa2
根据第一、第二滴定终点所消耗NaOH标准溶液的体积(mL),由pH―V滴定曲线找出与第一、第二半中和点对应的pH值,求算H3PO4的pKa1和pKa2。
磷酸为多元酸,其pKa1和pKa2 可用电位滴定法求得。当滴定反应进行50%时,,此时溶液的pH值即为pKa1,同理,0.5(Veq1+Veq2) 所对应的pH值即为pKa2。
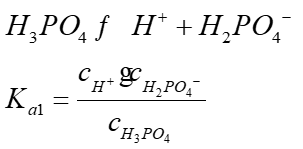
表6-3 H3PO4的pKa1和pKa2
| 第一半中和点 | 0.5(Veq1) (mL) | pH值 | pKa1 | |||
| 第二半中和点 | 0.5(Veq1+Veq2) (mL) | pH值 | pKa2 |
六、思考题
1、多元酸(二元酸或三元酸)分步滴定的条件是什么?
2、H3PO4是三元酸,为何在pH―V滴定曲线上仅仅出现两个“突跃”?
3、电位滴定法确定滴定终点有哪些方法?这些方法的依据是什么?
七、注意事项
1、pH酸度计的复合电极前端要浸入在液面以下,注意搅拌磁子不能碰到复合电极。
2、实验中指示剂的加入可辅助判断溶液pH的变化,不可以变色点来确定滴定终点。


