实验十二自来水硬度的测定
一、实验目的
1、了解水的硬度的测定意义和常用硬度的表示方法;
2、掌握EDTA标准溶液的配制与标定方法;
3、掌握配位滴定法测定自来水总硬度的原理和方法。
4、了解掩蔽干扰离子的条件和方法。
二、实验原理
通常将含较多量Ca2+、Mg2+的水叫硬水,水的总硬度是指水中Ca2+、Mg2+的总量,它包括暂时硬度和永久硬度,水中Ca2+、Mg2+以酸式碳酸盐形式存在的称为暂时硬度,遇热即成碳酸盐沉淀。反应如下:
Δ
Ca(HCO3)2→ CaCO3(完全沉淀)+H2O+CO2↑
Δ
Mg(HCO3)2→MgCO3(不完全沉淀)+H2O+CO2↑
+H2O
Mg(OH)2↓+CO2↑
若以硫酸盐、硝酸盐和氯化物形式存在的称为永久硬度,再加热亦不产生沉淀(但在锅炉运行温度下,溶解度低的可析出成锅垢)。
水的硬度是表示水质的一个重要指标,对工业用水关系极大。水的硬度是锅垢形成和影响产品质量的重要因素。因此,水的总硬度即水中Ca2+、Mg2+总量的测定,为确定用水质量和进行水的处理提供了依据。
由Mg2+形成的硬度称为“镁硬”,由Ca2+形成的硬度称为“钙硬”。
水的总硬度测定:一般采用配位滴定法,在pH≈10的氨性缓冲溶液中,以铬黑T(EBT)为指示剂,用EDTA标准溶液直接测定Ca2+、Mg2+的总量。由于KCaY>KMgY> KMg·EBT> KCa·EBT,铬黑T先与部分Mg配位为Mg·EBT(红色)。当EDTA滴入时,EDTA与Ca2+、Mg2+配位,终点时EDTA夺取Mg·EBT的Mg2+,将EBT置换出来,溶液由红色突变为蓝色即为终点。由EDTA溶液的浓度和用量,可计算出水的总硬度。
有关化学反应式如下:
滴定前:Mg2+ + HIn2-(蓝色)= MgIn-(红色)+H+
滴定开始至化学计量点前:Mg2+ +HY3-= MgY2-+H+
Ca2++ HY3-= CaY2-+ H+
化学计量点:MgIn-(红色)+ H2Y2- = MgY2-+ HIn2-(蓝色)
钙硬的测定:另取等量水样加NaOH调节溶液pH为12~13,使Mg2+生成Mg(OH)2沉淀,加入钙指示剂用EDTA滴定,测定水中Ca2+的含量。
镁硬的测定:总硬度减去钙硬即为镁硬。
滴定时,Fe3+、Al3+的干扰可用三乙醇胺掩蔽,Cu2+、Pb2+和Zn2+等重金属离子可用KCN、Na2S予以掩蔽。
三、主要试剂
实验用主要试剂见表12-1。
表12-1 主要试剂表
| 试 剂 | 规 格 | 试 剂 | 规 格 |
| 乙二胺四乙酸二钠 | A·R | HCl溶液 | 1:1 |
| NH3-NH4Cl缓冲溶液 | pH≈10 | NaOH 溶液 | 40g·L-1 |
| 钙指示剂 | 自制 | 铬黑T指示剂 | 自制 |
四、实验步骤
1、EDTA标准溶液的配制与标定
(1)0.010 mol/LEDTA溶液的配制
称取2.0g乙二胺四乙酸二钠(Na2H2Y·2H2O)于500 mL烧杯中,加200 mL水,温热使其完全溶解,转入至聚乙烯瓶中,用水稀释至500mL,摇匀备用。
(2)以CaCO3为基准物标定EDTA
①0.010 mol/L钙标准溶液的配制
准确称取120℃干燥过的CaCO30.25~0.30g,置于250 mL烧杯中,用少量水湿润,盖上表面皿,慢慢滴加1:1HCl 5 mL使其溶解,加少量水稀释,定量转移至250 mL容量瓶中,用水稀释至刻度,摇匀,计算其准确浓度。
② 0.010 mol/L EDTA溶液浓度的标定
移取20.00 mL钙标准溶液置于250mL锥形瓶中,加5mL1mol·L-1NaOH溶液及少量钙指示剂(约0.01 g,米粒大小),摇匀后,用EDTA溶液滴定至溶液由红色恰变为蓝色,即为终点。平行滴定3份,计算EDTA溶液的浓度,要求相对平均偏差不大于0.2%。
2、自来水总硬度的测定
用移液管移取澄清的自来水样100 mL于250mL锥形瓶中,加5mL NH3-NH4Cl缓冲溶液,2~3滴铬黑T指示剂,摇匀。用0.01mol·L-1 EDTA标准溶液滴定至溶液刚好由红色变为蓝色,即为终点。平行测定3份,计算水样的总硬度,以mg(CaCO3)·L-1表示测定结果。
3、自来水钙硬的测定
用移液管移取澄清的自来水样100 mL于250mL锥形瓶中,加入5 mL40g·L-1NaOH 溶液,摇匀,再加入少许(约0.01 g,米粒大小)钙指示剂,摇匀。用0.01 mol·L-1EDTA标准溶液滴定至溶液呈蓝色,即为终点。平行测定3份,计算水的钙硬。
五、实验数据记录与结果处理
1、0.010 mol/LEDTA溶液的标定
表12-2 0.010 mol/LEDTA溶液的标定
| 实验编号 | 1 | 2 | 3 |
| 滴定管初读数(mL) | 0.00 | 0.00 | 0.00 |
| 滴定管终读数(mL) | |||
| VY(mL) | |||
| cY(mol·L-1) | |||
2、自来水总硬度的测定
水的总硬度由下式计算:
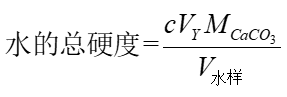
表12-3 自来水总硬度的测定
| 实验编号 | 1 | 2 | 3 |
| V水样(mL) | 100.00 | 100.00 | 100.00 |
| 滴定管初读数(mL) | |||
| 滴定管终读数(mL) | |||
| VY(mL) | |||
| 水的总硬度(mg·L-1) | |||
| 水的平均总硬度(mg·L-1) | |||
3、自来水钙硬的测定
表12-4 自来水钙硬的测定
| 实验编号 | 1 | 2 | 3 |
| V水样(mL) | 100.00 | 100.00 | 100.00 |
| 滴定管初读数(mL) | |||
| 滴定管终读数(mL) | |||
| VY(mL) | |||
| cCa2+(mmol·L-1) | |||


