第二节 急性炎症

一、定义
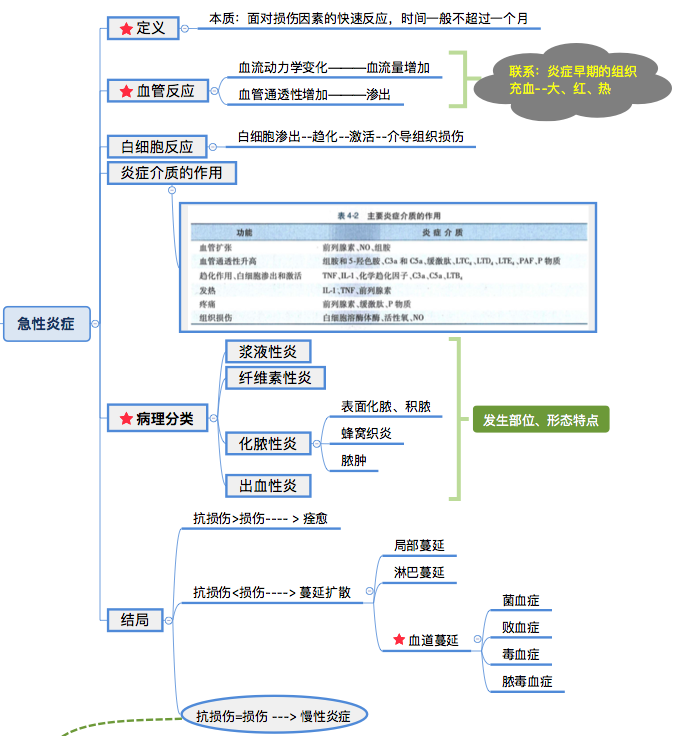
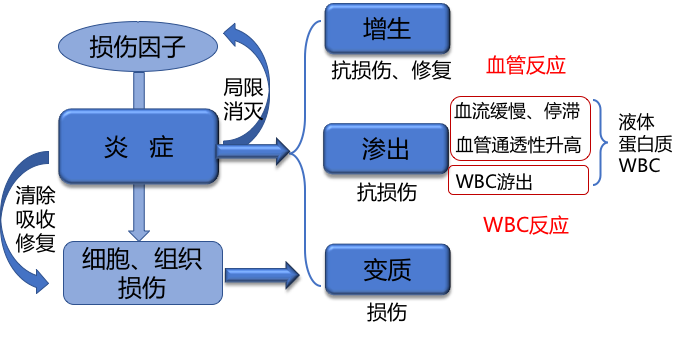
急性炎症是机体对致炎因子的刺激所发生的立即和早期反应。急性炎症的主要特点是以血管反应为中心的渗出性变化,导致血管内的白细胞和抗体等透过血管壁进入炎症反应部位,消灭病原体,稀释并中和毒素,为炎症修复创造良好的条件。
二、急性炎症的渗出主要包括以下基本过程:
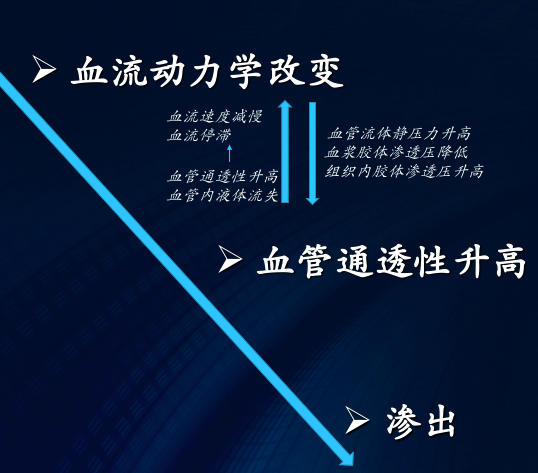
血管反应首先表现为炎性充血(inflammatory hyperemia),是指微循环中血管舒缩和血流速度及血流量的变化。血液动力学的变化一般按下列顺序发生。炎症的血流动力学改变、炎症血管反应
1.细动脉短暂痉挛 :损伤因子作用于机体后,机体通过神经反射或产生各种炎症介质,作用于局部血管首先产生细动脉短暂痉挛。
2.血管扩张和血流加速: 动脉端毛细血管括约肌舒张,毛细血管床开放,血流加快,血量增加,导致局部动脉性充血。此时炎症区组织代谢增强,温度升高,呈鲜红色。
3.血流速度减慢: 10~15 min后,静脉端毛细血管和小静脉也随之发生扩张,血流逐渐减慢,导致静脉性充血。随着充血的发展,小静脉和毛细血管的通透性增高,致血浆渗出、血液浓缩、血管内红细胞聚集,血液粘稠度增加、血流阻力增高,血液回流受阻甚至发生淤滞(stasis)。由于细动脉端入血量增多而静脉端回流减少,使局部组织的毛细血管和小静脉内流体静压上升,同时因血流缓慢,血细胞轴流变宽,其边缘的白细胞得以向管壁靠近,为白细胞的粘附创造了有利条件。
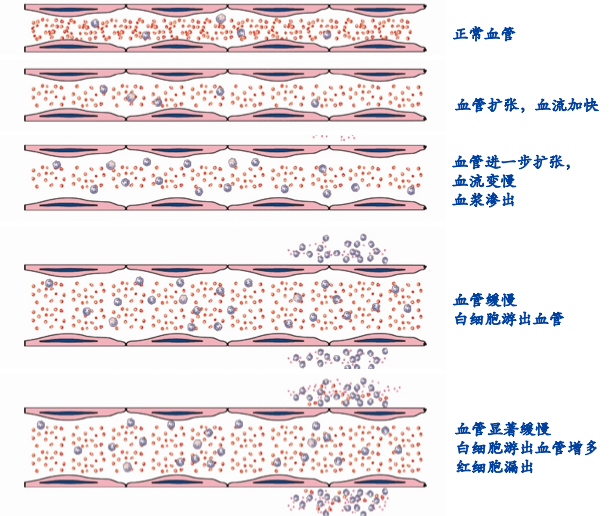 急性炎症时血流动力学变化模式图
急性炎症时血流动力学变化模式图
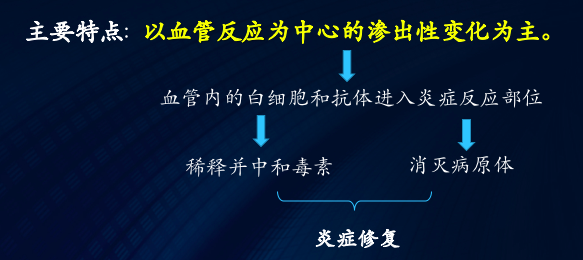
血管通透性升高是导致炎症局部液体和蛋白质渗出的最重要原因。正常的液体交换和血管通透性的维持主要依赖于结构完整、功能正常的血管内皮细胞,炎症时血管通透性升高主要与血管内皮细胞的如下改变有关:
1. 小静脉内皮细胞收缩 这是血管通透性升高最常见的发生机制。组胺、缓激肽、P物质和许多化学介质均可诱发此反应。当这些介质与内皮细胞受体结合后,内皮细胞立即收缩,导致内皮细胞间隙形成。这一过程持续时间很短(仅15~30 分钟)而且是可逆的,故可称为速发短暂反应(immediate transient response)。 |
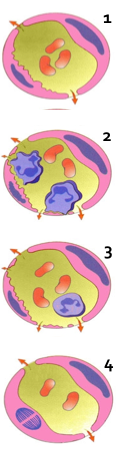
|
2.穿胞作用(transcytosis)增强 穿胞作用是通过内皮细胞胞浆内存在的囊泡性细胞器相互连接形成的穿胞通道(transtocytoplasmic channel)而实现的。某些因子,如血管内皮细胞生长因子,可以增加这种细胞器的数量和大小,从而引起血管通透性增加。另外,组胺和大多数化学介质也可通过此途径增加血管通透性。 |
3.内皮细胞的直接损伤 诸如严重的烧伤、化脓菌感染等严重刺激可直接造成内皮细胞损伤,引起内皮细胞坏死和脱落,导致血管通透性迅速增加,并在高水平上持续几个小时,直至受损血管内形成血栓或受损血管被修复。此过程被称为速发持续反应(immediate-sustained response)。小动脉、毛细血管和小静脉等各级微循环血管均可受累。内皮细胞的脱落可引起血小板粘附和血栓形成。 |
4.白细胞介导的内皮细胞损伤 在炎症早期,白细胞附壁,粘附于内皮细胞上,引起白细胞的激活,从而 释放毒性氧代谢产物和蛋白酶,引起内皮细胞的损伤和脱落,使血管通透性增加。这种损伤主要发生在小静脉和肺、肾等脏器的毛细血管。 |
5.新生毛细血管的渗漏
在组织修复时,内皮细胞增生形成新生毛细血管芽,这种新生的小血管芽通透性较高,可引起血管渗漏。直至内皮细胞分化成熟和细胞间连接形成,渗漏才能停止。
|
(三)渗出
在第一节“炎症的概述”和本节中关于“急性炎症的定义”中,都提到,炎症的主要特点就是渗出,尤其是急性炎症。炎症早期,上述炎性充血使微循环内的流体静压上升,液体及小分子物质随压力升高而经毛细血管渗出。随着炎症发展,血管内皮细胞的活化、收缩,管壁通透性明显升高,血管内富含蛋白的液体乃至细胞成分得以逸出进入周围组织内,此过程即为渗出(exudation),它包括液体渗出和细胞渗出。
1.液体渗出
炎性渗出液在组织间隙积聚称炎性水肿。在另外一些情况下,由于血液循环障碍、血管壁内外流体静压平衡失调可造成漏出(transudation)。无论渗出还是漏出都可造成组织水肿和体腔积液,通过对穿刺抽出的体腔积液的检测有助于确定其性质。
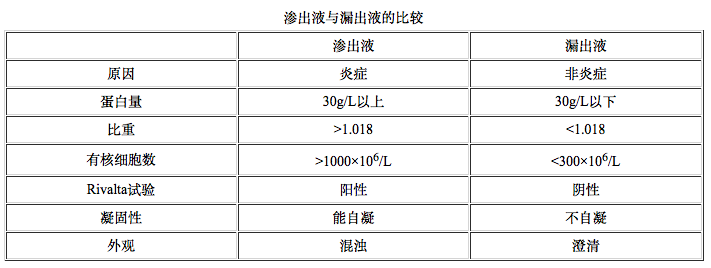
★炎性渗出是急性炎症的重要特征,对机体具有积极意义。
2.白细胞渗出
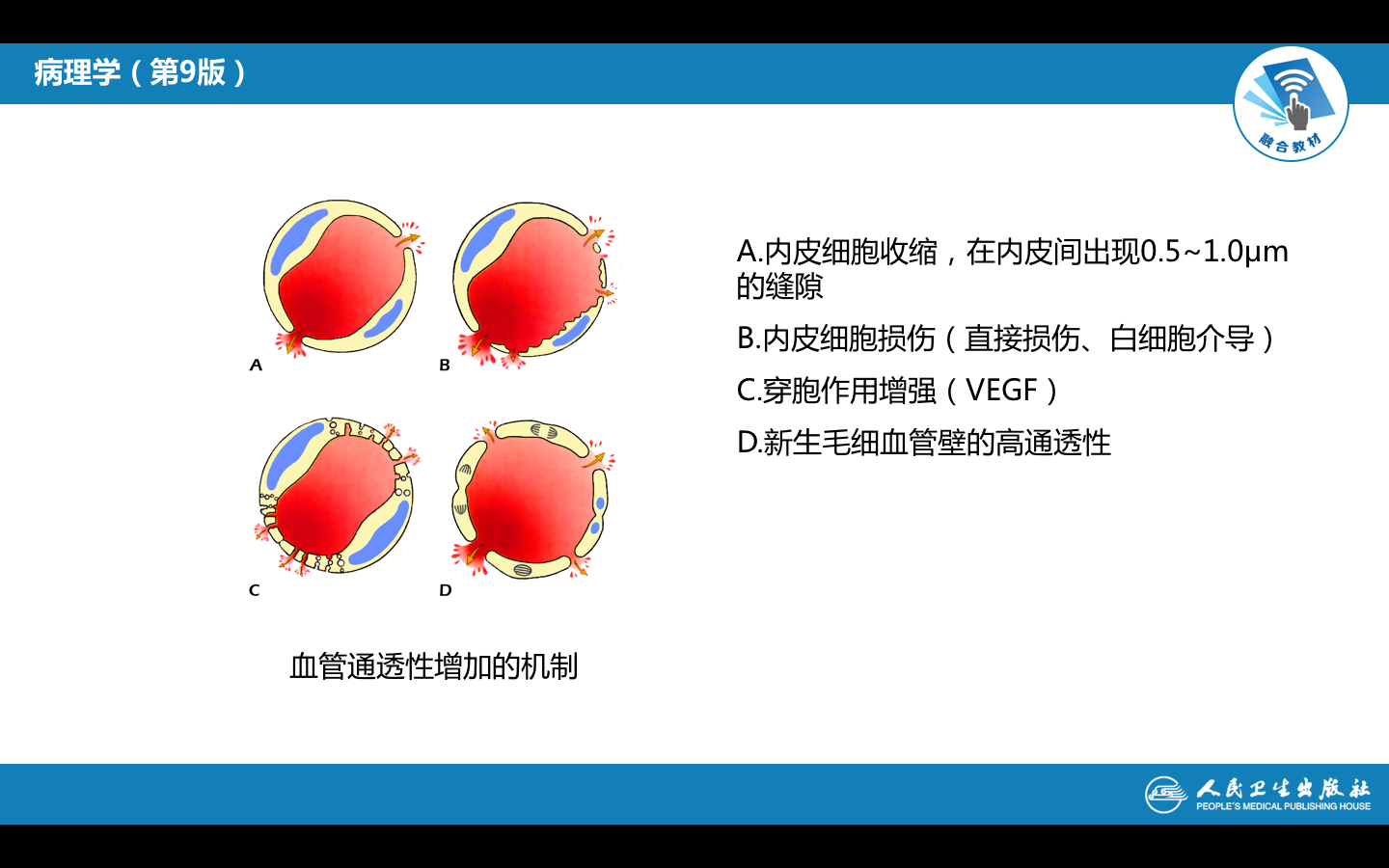
白细胞通过血管壁游出到血管外的过程称为白细胞渗出(leucocyte extravasation)。渗出的白细胞也称为炎性细胞,炎症反应的最重要功能是将白细胞输送到炎症局部。白细胞吞噬、消灭病原体,降解坏死组织和异己抗原;同时,也会通过释放化学介质、自由基和酶,介导组织损伤。因此,白细胞的渗出构成炎症反应的主要防御环节,是炎症反应最重要的特征。(白细胞的渗出机制)
白细胞的渗出及其在局部的防御作用是极为复杂的连续过程:(巨噬细胞的运动、白细胞渗出)
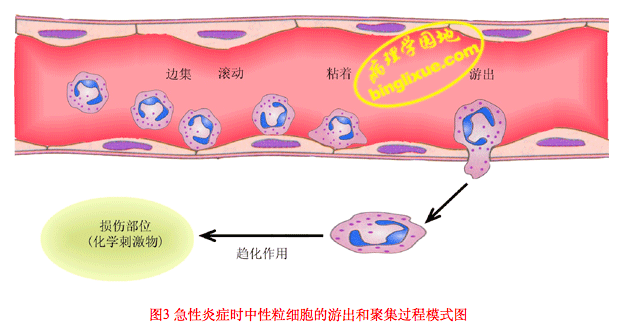
(1)白细胞边集和附壁:随着血管扩张、血管通透性增加和血流缓慢,白细胞进入边流,靠近血管壁,并沿内皮滚动。最后白细胞粘附于血管内皮细胞上。(下图A)
(2)白细胞粘附和游出: 目前已明确白细胞粘附和游出主要是由于其表面的粘附分子和内皮细胞受体结合引起的,化学介质和某些细胞因子可以调节这类粘附分子的表达和功能状况。这类粘附受体包括四种家族:选择素、免疫球蛋白、整合素和粘液样糖蛋白。(下图B-F)
(3)游出和趋化作用 :白细胞通过血管壁进入周围组织的过程称为游出(emigration)。粘附于内皮细胞表面的白细胞沿内皮表面缓慢移动,在内皮细胞连接处伸出伪足,整个白细胞逐渐以阿米巴样运动方式从内皮细胞缝隙游出,到达内皮细胞和基底膜之间,最终穿过基底膜到血管外(下图B-F)。中性粒细胞、单核细胞、淋巴细胞、嗜酸粒细胞和嗜碱粒细胞都是以此种阿米巴样运动方式主动游出的。
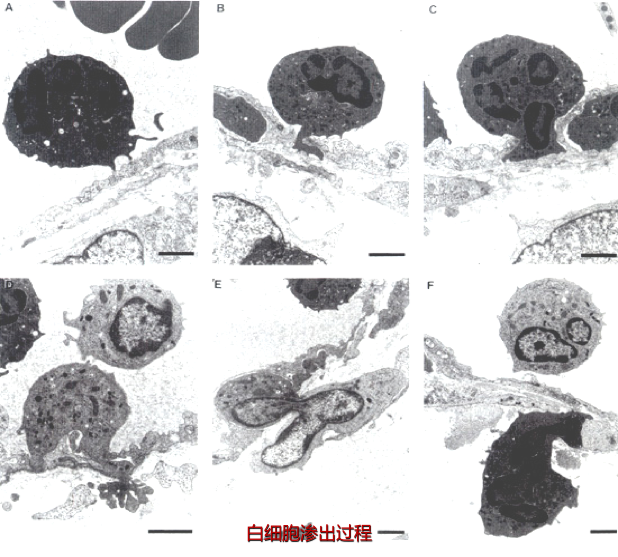
趋化作用(chemotaxis)是指白细胞向着炎症区域的化学刺激物所在部位作定向移动,而这些化学刺激物称为趋化因子(chemotactic agents)。趋化因子的作用是有特异性的,即不同的趋化因子只对某一种或几种炎细胞有趋化作用。 此外,不同细胞对趋化因子的反应能力也不同,粒细胞和单核细胞对趋化因子的反应较强,而淋巴细胞对趋化因子的反应则较弱。
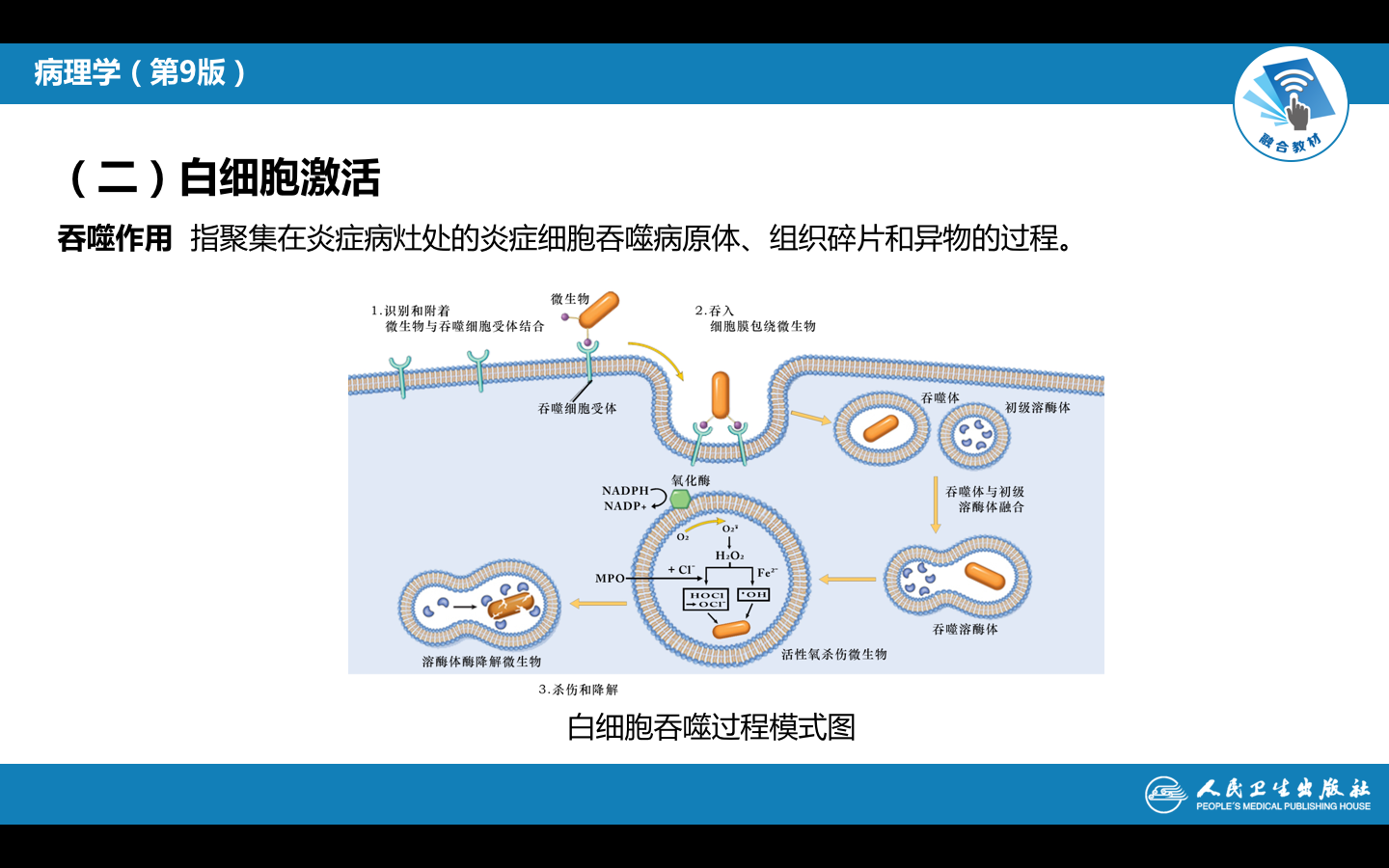
(4) 白细胞的吞噬作用 其吞噬过程,包括识别和粘附、吞入及降解三个阶段(吞噬过程)
1) 识别和粘附 在无血清存在的条件下,吞噬细胞很难识别并吞噬细菌。因为在血清中存在着调理素(opsonin),即一类能增强吞噬细胞吞噬活性的血清蛋白质,主要是IgG和C3b。吞噬细胞藉其表面的Fc受体和C3b受体(C3bi或Mac-1),它们能识别被抗体或补体包被的细菌,经抗体或补体与相应受体结合,细菌就被粘附在吞噬细胞的表面。 |
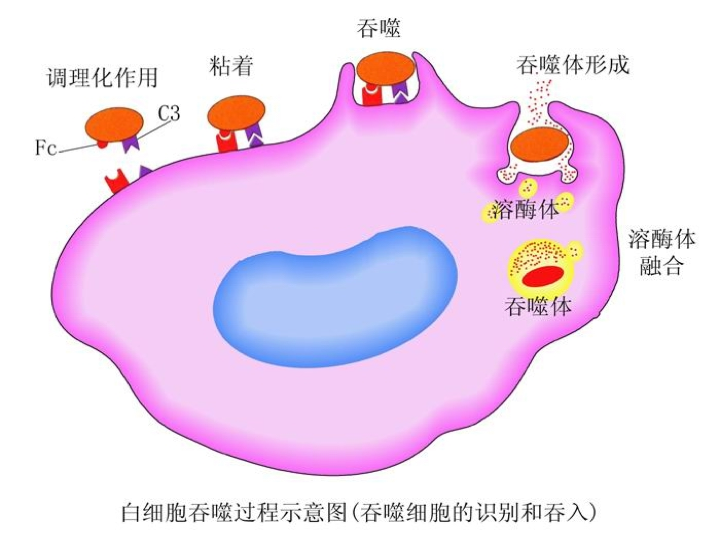
|
2) 吞入 细菌粘附于吞噬细胞表面之后,Fc受体和C3b受体即被激活,启动吞噬过程,吞噬细胞乃伸出伪足,随伪足延伸和互相吻合,形成由吞噬细胞膜包围吞噬物的泡状小体,谓之吞噬体(phagosome)。吞噬体逐渐脱离细胞膜进入细胞内部,并与初级溶酶体融合,形成吞噬溶酶体(phagolysosome),溶酶体酶倾注其中,细菌在吞噬溶酶体内被杀伤、降解。 |
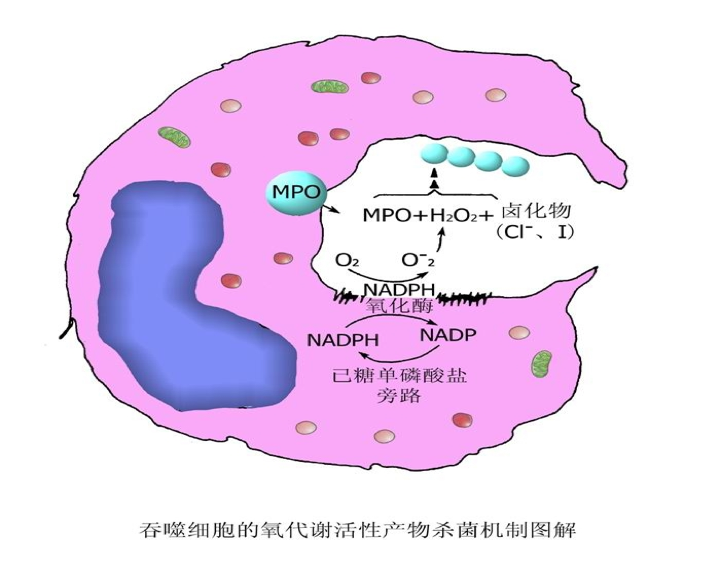
3)杀伤和降解 进入吞噬溶酶体的细菌主要是被具有活性的氧化代谢产物杀伤的。通过吞噬细胞的杀伤作用,大多数病原微生物被杀伤。但有些细菌(如结核杆菌),在白细胞内处于静止状态,仍具有生命力和繁殖力,一旦机体抵抗力下降,这些病原体又能繁殖,并可随吞噬细胞的游走而在体内播散。 |
在吞噬完成以后,中性粒细胞很快经历细胞凋亡过程,尔后被巨噬细胞摄入或者通过淋巴管引流清除。 |
巨噬细胞吞噬模型、中性粒细胞的吞噬作用
急性炎症小结:
(1)定义:
(2)过程:
三、炎症介质
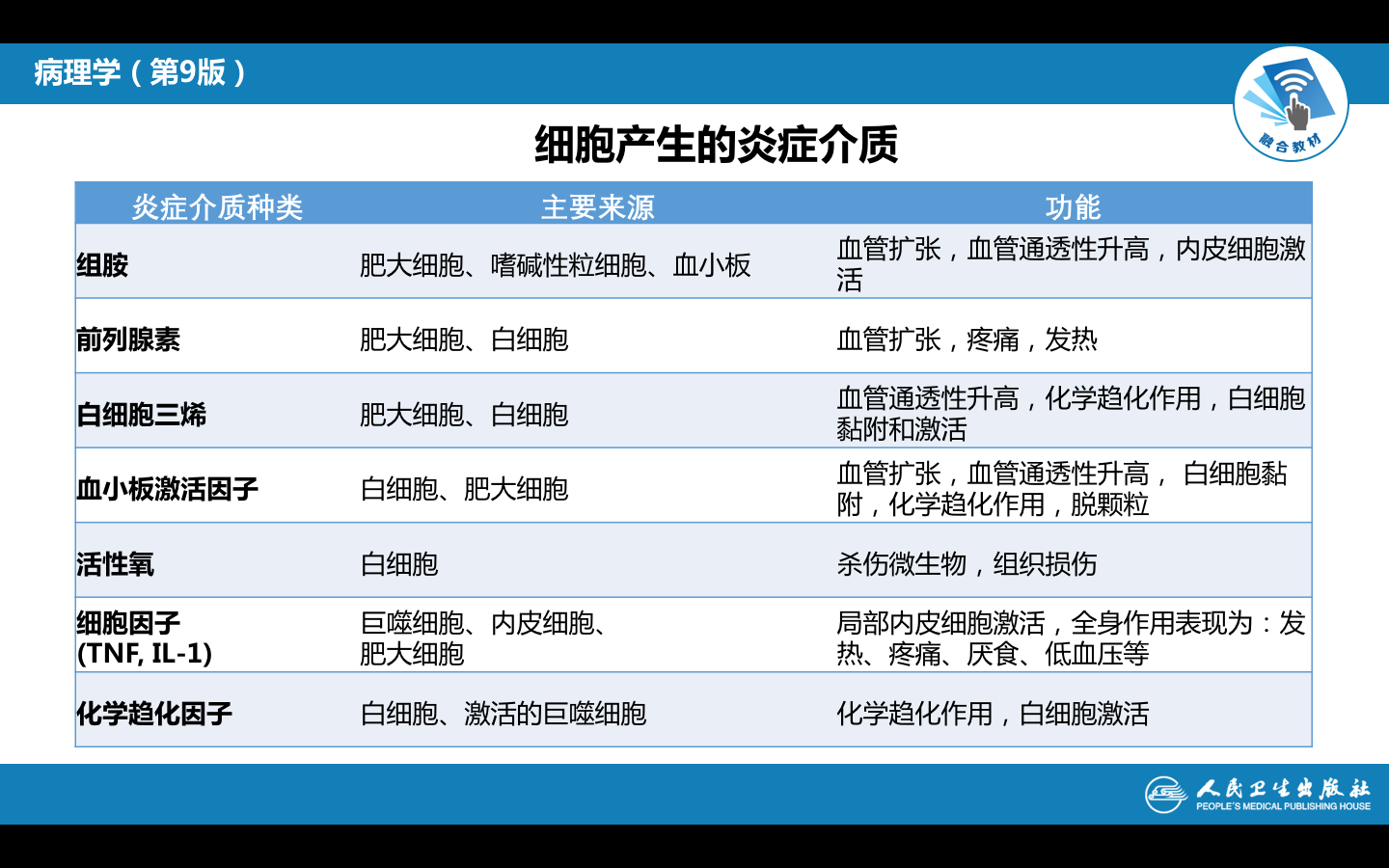
炎症过程中参与、介导炎症反应的化学因子即炎症介质(inflammatory mediator)。有外源性(如细菌及其产物)和内源性(来源于体液和细胞)两大类。大多数的炎症介质是通过与其靶细胞上的特异性受体结合而发挥生物学效应的。
主要炎症介质的种类及其生物学作用归纳如表:
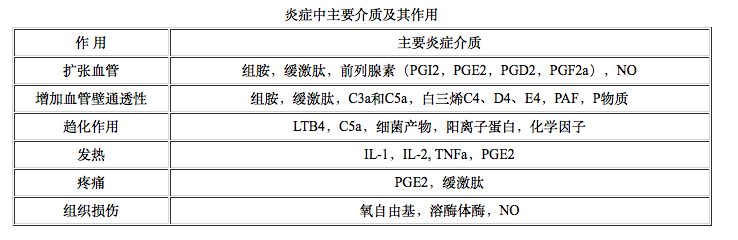
附图1 血小板颗粒:
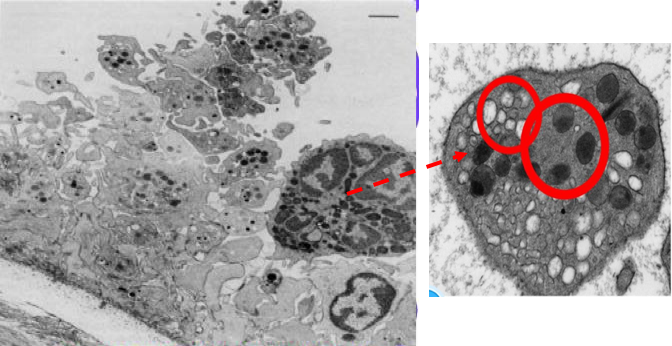
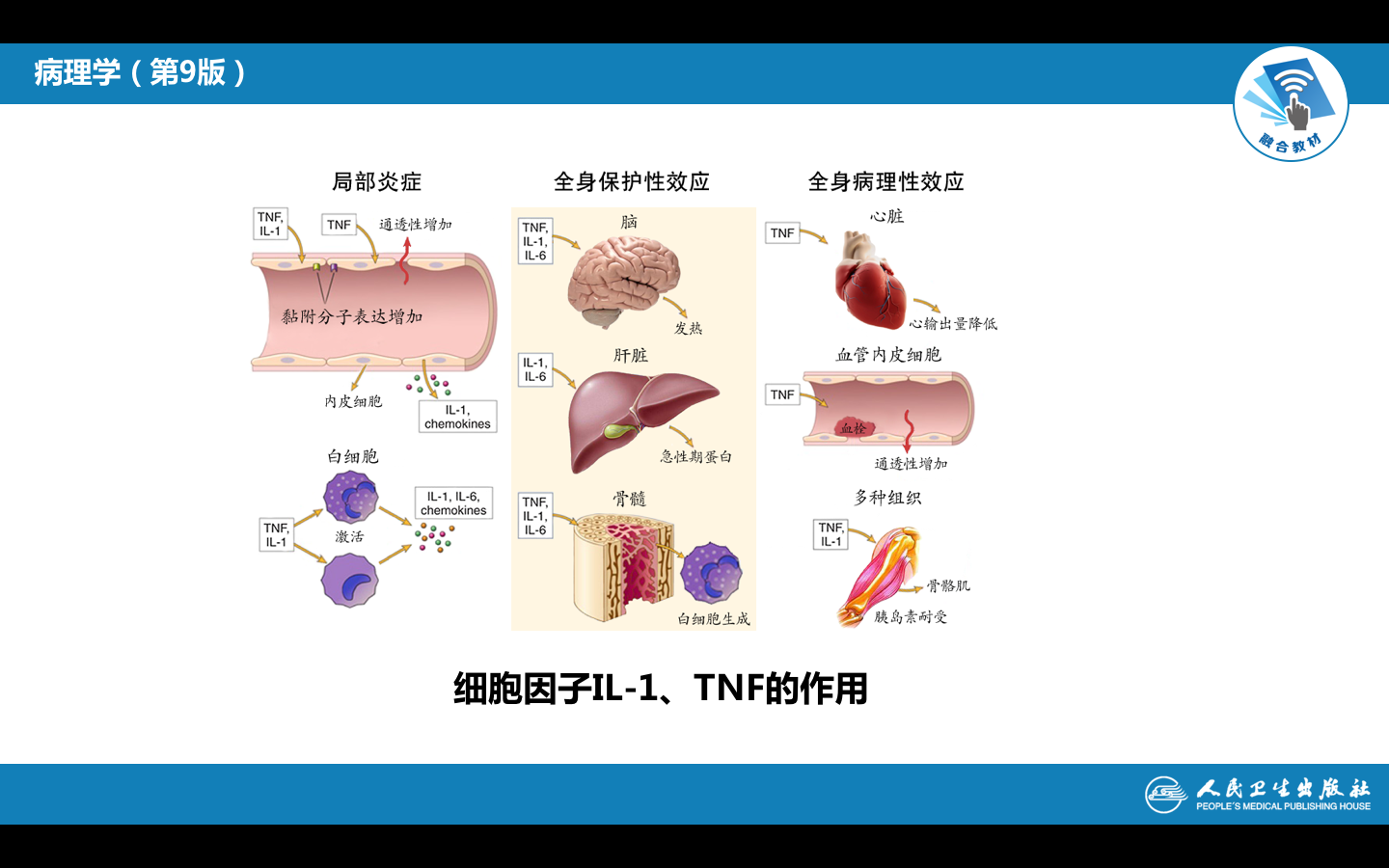
附图2 细胞因子IL-1、 TNF的作用:
二、急性炎症的病理学类型 ★
渗出性炎(exudative inflammation)是指以渗出为主要病变的炎症,以炎症灶内有大量渗出物形成为主要特征。根据渗出物的主要成分和病变特点,一般将渗出性炎分为浆液性炎、纤维素性炎、化脓性炎、出血性炎等类型。
(一)浆液性炎 (serous inflammation)
特点:浆液性炎是以浆液渗出为主的炎症。渗出物中主要为含多量白蛋白的血清,其中混有少量细胞和纤维素。
好发部位:浆液性炎好发于浆膜(如胸膜、腹膜和心包膜等)、皮肤、粘膜、滑膜和疏松结缔组织等处。浆液性炎一般较轻,病因消除后易于消退。但有时因浆液渗出过多可导致较严重的后果。如喉炎时严重的炎性水肿,可致呼吸困难;心包腔大量炎性积液时,可压迫心、肺而影响其功能。
举例:粘膜的浆液性炎如感冒初期,鼻粘膜排出大量浆液性分泌物;浆膜的浆液性炎如渗出性结核性胸膜炎,可引起胸膜腔积液;发生在滑膜的浆液性炎如风湿性关节炎可引起关节腔积液。
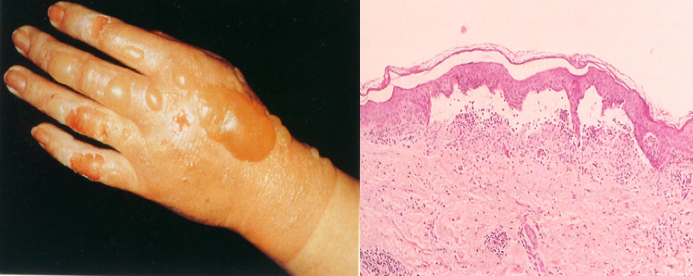
皮肤的浆液性炎如皮肤Ⅱ度烫伤时,渗出的浆液积聚于皮肤的表皮内形成水疱; |
(二)纤维素性炎(fibrinous inflammation)
是以渗出物中含有大量纤维素为特征的渗出性炎症。纤维素的大量渗出,提示毛细血管和小静脉损伤较重,通透性明显升高,大量纤维蛋白原渗出到血管外,在坏死组织释出的组织因子作用下,转化为纤维素,故有纤维素性炎之称。如下图:
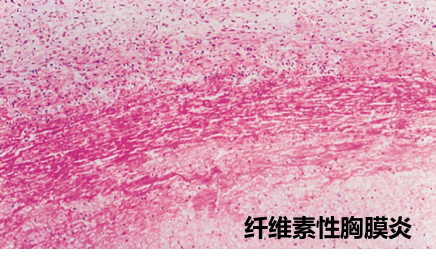
纤维素性炎多是由某些细菌毒素(如白喉杆菌、痢疾杆菌和肺炎双球菌的毒素)或多种内源性、外源性毒素(如尿毒症时的尿素和升汞中毒)所引起。常发生于粘膜(咽、喉、气管、肠)、浆膜(胸膜、腹膜和心包膜)和肺。
发生于粘膜者(如白喉、细菌性痢疾),渗出的纤维素、白细胞和坏死的粘膜组织及病原菌等在粘膜表面可形成一层灰白色膜状物,称为“假膜”,故又称“假膜性炎”(pseudomembranous inflammation)。由于局部组织结构特点不同,有的粘膜与其下组织结合疏松,所形成的假膜与深部组织结合较松而易于脱落,如气管白喉(下图)的假膜脱落后可阻塞支气管而引起窒息,造成严重后果。

| 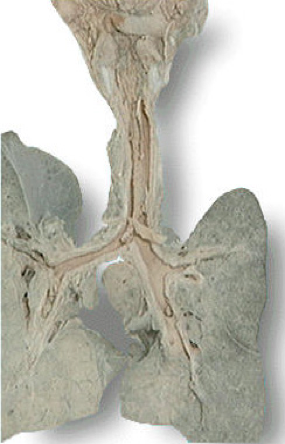
(气管白喉) |
当纤维素性炎发生于浆膜和肺时,少量纤维素渗出,可溶解吸收;多量纤维素渗出则容易发生机化,甚至浆膜腔闭塞,引起器官功能障碍。
如纤维素性心包炎,由于心脏的博动,心包的脏壁两层相互摩擦,使渗出在心包腔内的纤维素在心包膜表面呈绒毛状,称为“绒毛心”。 | 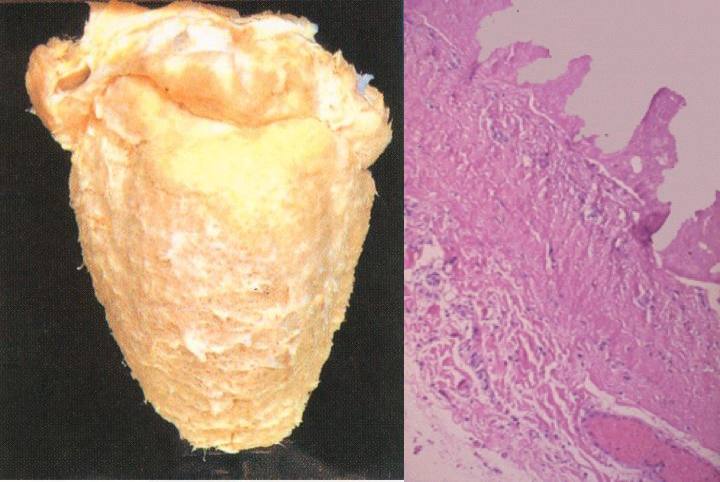
|
结局:若中性粒细胞渗出较少,释出的蛋白水解酶相对不足,不能将纤维素完全溶解吸收时,可通过肉芽组织的长入而发生机化,最后导致纤维化。发生于胸膜者造成胸膜增厚与粘连,甚至使胸膜腔闭塞。发生于肺者,如大叶性肺炎的灰色肝样变期,肺泡腔内有大量纤维素渗出,使肺实变。
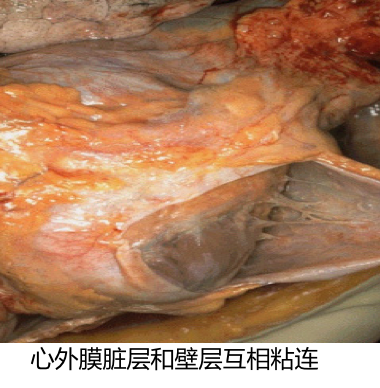
| 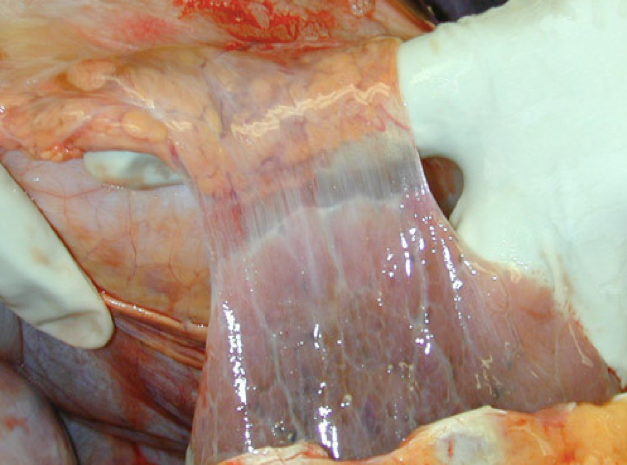
右肺和胸壁之间的粘连 |
(三)化脓性炎(purulent inflammation)
特点:化脓性炎是以中性粒细胞大量渗出并伴有不同程度的组织坏死和脓液形成为特征的一种炎症。
原因:多由葡萄球菌、链球菌、脑膜炎双球菌、大肠杆菌等化脓菌引起。亦可因某些化学物质和机体坏死组织所致。
化脓:炎症区内大量中性粒细胞破坏崩解后释放的溶酶体酶将坏死组织溶解液化的过程称为化脓,所形成的液状物称为脓液,其内主要含大量渗出的中性粒细胞和脓细胞(变性坏死的中性粒细胞),还含有细菌、被溶解的坏死组织碎片和少量浆液。因渗出物中的纤维素已被中性粒细胞释出的蛋白水解酶所溶解,故脓液一般不凝固。
分类:根据化脓性炎症发生的原因和部位的不同,可表现为不同的病变类型:
1. 脓肿(abscess) 器官或组织内的局限性化脓性炎症称脓肿,其主要特征为组织发生坏死、溶解,形成充满脓液的腔,即脓腔。脓肿主要由金黄色葡萄球菌感染所致。该菌产生的血浆凝固酶可使渗出的纤维蛋白原转变为纤维素,因而病变较局限。近来研究发现,金黄色葡萄球菌具有层粘连蛋白受体,因而可通过血管壁并引起转移性脓肿。脓肿早期,在病原菌侵袭的局部组织发生坏死和大量的中性粒细胞浸润,随后发生化脓,并形成脓腔。经历一段时间后,脓肿周围可出现肉芽组织增生,包围脓肿形成脓肿膜(图10),脓肿膜具有吸收脓液、限制炎症扩散的作用。小的脓肿,如病原菌被消灭,脓液可逐渐吸收、消散,由肉芽组织修复愈合,大的脓肿由于脓液很多,吸收困难,需要切开排脓或穿刺抽脓,而后由肉芽组织代替。
疖(furuncle)是毛囊、皮脂腺及其附近组织所发生的脓肿。疖中心部分液化、变软后,脓肿就可自行穿破。 痈(carbuncle)是多个疖的融合,在皮下脂肪筋膜组织中形成多个相互沟通的脓肿,一般只有及时切开引流排脓后,局部方能修复愈合。
|
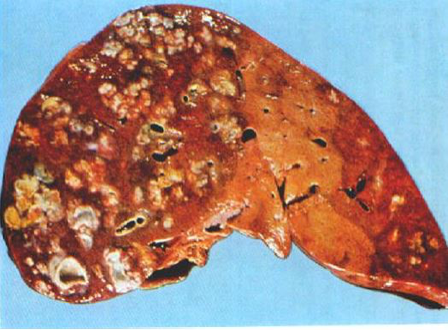
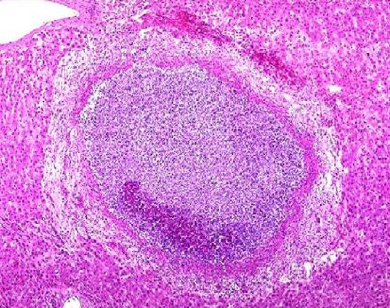
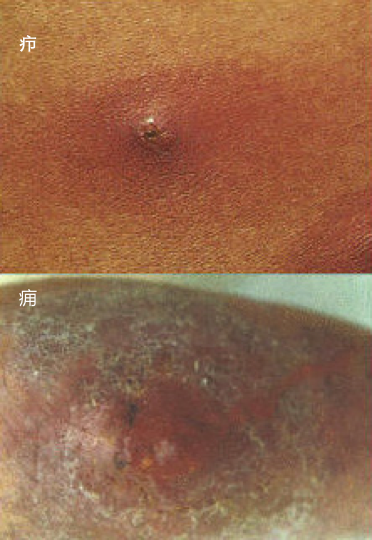
|
(2)蜂窝织炎 (phlegmonous inflammation) 疏松结缔组织中弥漫性化脓性炎称蜂窝织炎。常见于皮下组织、肌肉和阑尾。溶血性链球菌为其主要致病菌,因该菌能产生透明质酸酶,分解结缔组织中的透明质酸,使之崩解;链球菌又能产生链激酶,溶解纤维素,使细菌容易在组织内蔓延扩散(图11)。炎区组织高度水肿和中性粒细胞弥漫性浸润,与周围组织无明显分界。但局部组织一般不发生明显的坏死和溶解,故单纯蜂窝织炎症痊愈后多不留痕迹。 | 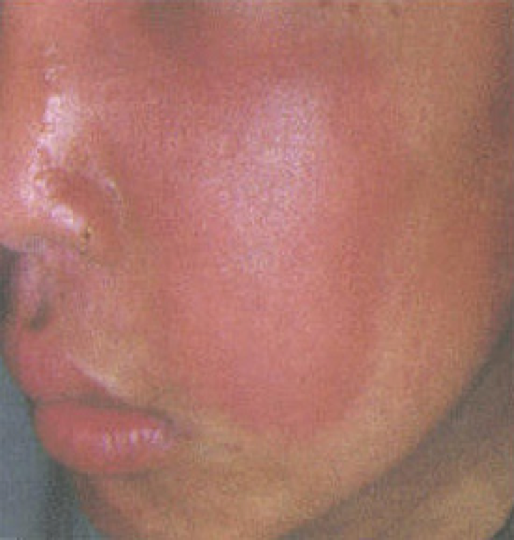
|
(3)表面化脓和积脓 表面化脓是指发生于粘膜或浆膜表面的化脓性炎。其特点是脓液主要向粘膜或浆膜表面渗出。 | 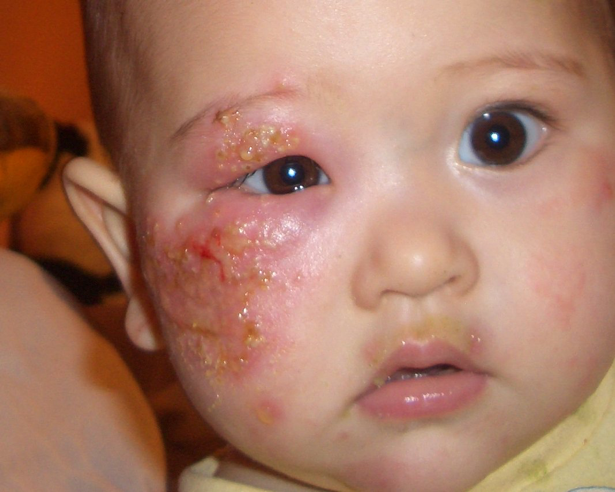
|
(4)出血性炎 出血性炎症灶的血管损伤严重,渗出物中含有大量红细胞。常见于流行性出血热,钩端螺旋体病和鼠疫等急性传染病。 |