-
1 内涵
-
2 CRISPR-Cas9基因编...
-
3 贺建奎基因编辑婴...
-
4 贺建奎基因编辑婴...
-
5 贺建奎基因编辑婴...
道歉?自豪?贺建奎在港公开发言1个多小时,学术界面临质疑与包容的终极抉择
原创 DeepTech DeepTech深科技 2018-11-28
今天是第二届人类基因组编辑峰会的第二天。往常,李兆基会议中心作为香港大学的一个学术会议和报告场地,出入的都是轻声细语、缓缓而行的学者与学生。而今晨8点起,大量挂着中外媒体名牌,手持照相机、摄像机、录音笔的记者在会议中心内外快节奏地涌动,表面仍然平静的会场也令人感觉凝重起来。
毫无疑问,基因编辑婴儿事件的主角贺建奎的出席已经将这个小规模学术聚会卷入了一场横扫全球的风暴。连贺建奎本人在中午 12 时 40 分提着一个浅棕色公文包上场开始英文演讲时,也略显结巴。不过,随着他说到露露和娜娜,说到自己团队完成的世界首例基因编辑婴儿实验的几个关键数据,似乎恢复了一点自信。
经历了临时议程更改、原定记者会取消、只提供书面提问等一系列“序曲”之后,整个生命科学领域乃至全人类都格外关注的大量重要信息终于公布。

图|上午大会前主办方工作人员被媒体簇拥(来源:DT 君)
12 点 40 分左右,主持人Robin Lovell-Badge 在贺建奎教授发言之前特地表示,“大会之前我们并不知道基因编辑婴儿这件事,但我们还是决定给他一个发声的机会”。
贺建奎开启一个多小时的演讲及问答环节的第一句话是,“对于这个研究结果非预期的泄露出来,我感到抱歉”。另外,“这项研究也提交给了一些学术期刊,虽然我所在的南方科技大对我的研究并不知情,但我还是要感谢学校”。

图丨贺建奎演讲中(来源:DT 君)
演讲中,贺建奎首先介绍了对 CCR5 和 HIV 的了解、在小鼠模型中验证 CCR5 基因敲除对发育的影响、设计根据人类基因优化的 sgRNA、在非组蛋白水平发展更好的注射方法、把同样的方法应用于人类胚胎细胞+建立评价胚胎细胞健康水平的人类胚胎干细胞系等几个方向的技术内容。
在研究脱靶效应上,贺建奎的 PPT 提出了两个问题:单细胞测序真的能够对 CRISPR-Cas9 的脱靶效应进行无偏移的评价吗?这个 sgRNA 在人类胚胎中能够造成怎样的脱靶效应?方法是建立生殖细胞专属的单细胞测序方法学,用全基因组测序和靶向基因深度测序来考察人类胚胎细胞。
根据介绍,团队目前已经在脐带血水平、脐带组织水平和胎盘水平进行了检测,未来将在组织水平(足跟血、唾液和毛囊)和细胞水平(外周血细胞)进行脱靶效应和嵌合效应的检测。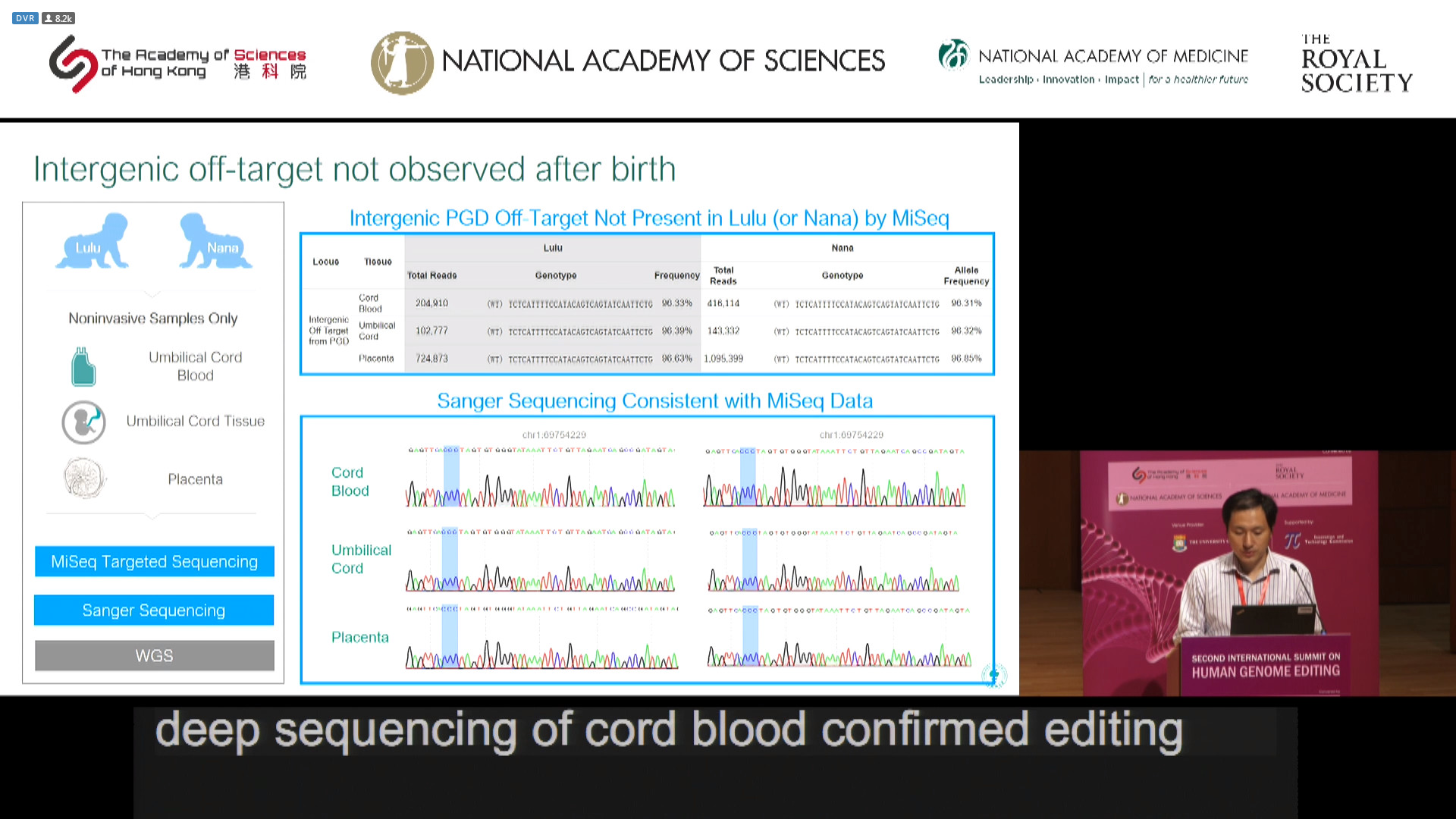
那么,两个婴儿出生的具体过程又是什么?招募志愿者的标准是父亲单阳性,总共招募了 8 组,其中一组退出,最后只剩 7 组。PPT 显示,整体的流程是先获取父母亲的外周血基因,例如 HIV 携带的父亲和 HIV 阴性的母亲,进行 Sanger 测序,这一步可以从父母的基因组检测到全新的插入缺失标记(indels),并且单模标本能提高灵敏度,目的在于建立个体化的脱靶高危位点库。接下来通过卵胞浆内单精子显微注射技术把 Cas9 和 sgRNA 注射到受精卵中,并在体外培养成囊胚,从中获取 3-5 个细胞进行胚胎种植前基因诊断。
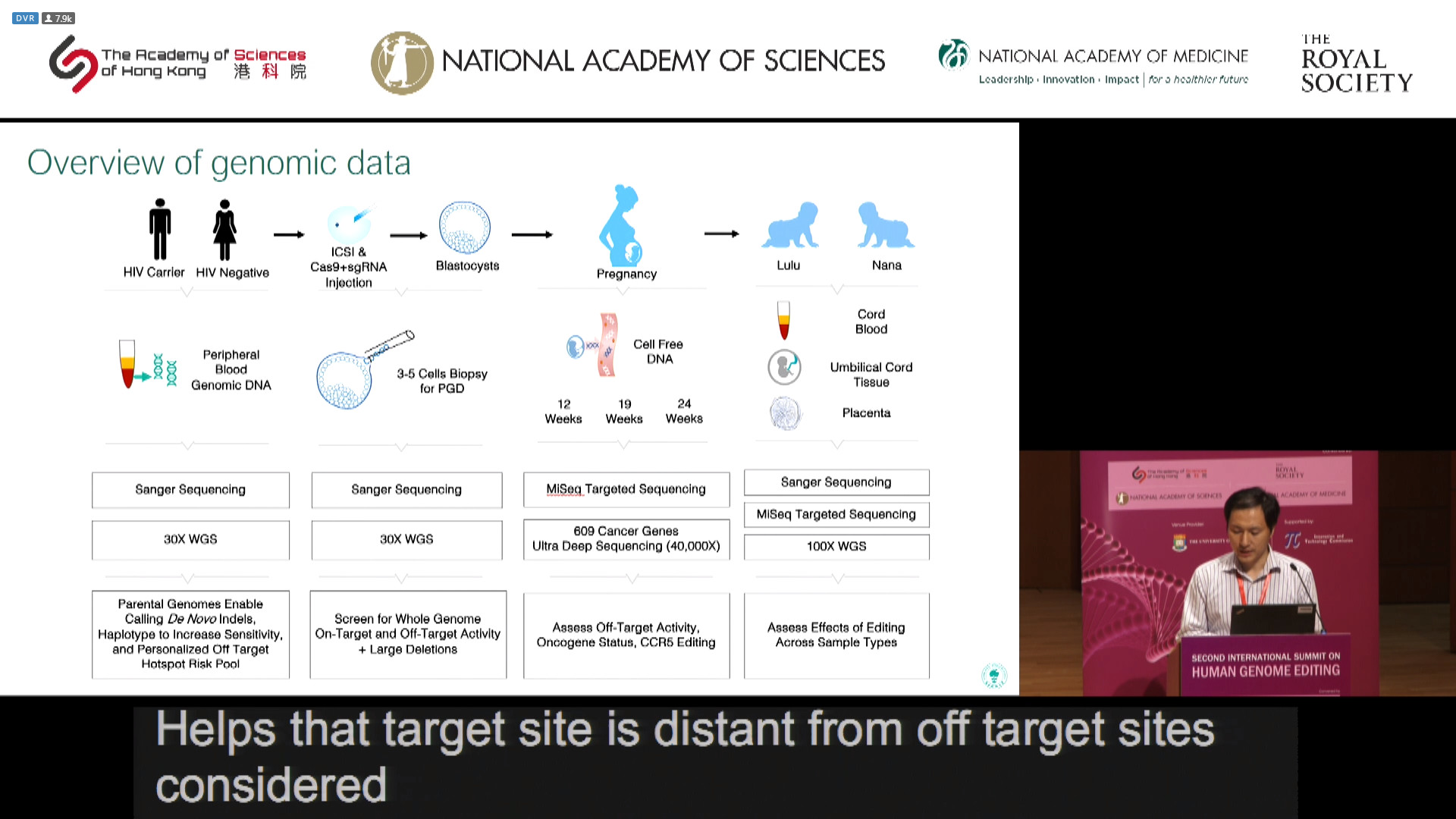
诊断方式依然为 Sanger 测序,以检测全基因组的靶效应和脱靶效应以及大的缺失位点。接着把受精卵种植到母亲子宫中,分别在 12 周,19 周和 24 周从母亲身上获取游离 DNA,对 609 个已知癌症基因进行 MiSeq 靶向测序,深度为 40000x,目的在于评价脱靶效应,原癌基因状态,CCR5编辑状态。最后,胎儿出生后,收集脐带血、脐带组织以及胎盘,再次进行 Sanger 测序,目的在于评价不同样本的编辑效果。
出生后,Sanger 测序和深度测序均未检测到 PGD 期间观察到的基因间脱靶。对于脐带血的全基因组测序,没有观察到脱靶,也没有观察到大的基因缺失。
演讲结束后,大会主席、诺贝尔医学奖得主 David Baltimore 现身舞台,首先代表大会提出了一定的“指控”。他表示,上次大会结束的时候大家都同意了不要做人类胚胎研究,但是贺并没有遵守,科学社区自我管理的过程已被证明失效了,整个大会的组办机构明天会发一个声明。

图丨贺建奎回答问题中(来源:DT 君)
而在提问环节,哈佛大学化学与化学生物系教授的 David Liu 表示,父亲阳性,经过“洗精” (sperm washing),完全没有医疗需求和必要进行这样的研究,这些女孩在医疗上的价值到底是什么?
贺建奎的回答是,对全球众多受 HIV 影响的人群来说,这是很有必要的。“我曾经去过一个村子,那里有 30% 的人都感染了 HIV。对这个项目来说,我对我们所做的感到骄傲。孩子的父亲曾一度对生活失去了信心,但现在,他告诉我今后会好好工作,努力挣钱,好好照顾他的妻子和两个女儿”,他说。在另一个问题的回答上,他表示,我会对她们视若己出。

图丨贺建奎回答问题中(来源:DT 君)
对于贺建奎提到在知道有一个孩子可能脱靶后,志愿者夫妻仍然坚持受孕,对此 David Liu 表示十分质疑。但面对 David Liu 的第二个提问——如果患者可以决定,一个医生或者科学家向公众解释或者引导公众的责任究竟在哪,贺建奎并没有回答这个问题。
在提问环节,贺建奎也回应了关于此次实验相关的 HIV 志愿者夫妻的问题。他透露,志愿者有良好的教育背景,知道 HIV 目前的治疗手段,也清楚这个治疗手段的优势和风险,也向志愿者讲清楚了风险。他曾与这对夫妻有过深入交流,谈话持续了 1 小时 10 分钟,准备了详细的文件并打印出来。在同一会议室内还有两位观察员,夫妻受过良好的教育,能理解文本的内容,他本人从 1-20 页每段跟他们解释,他们完全知晓关于研究的一切。而且,参与实验的志愿者父母在被告知受精卵测序存在一个脱靶后,仍坚持受孕。
他表示,不能对外公布任何 HIV 感染者的信息,对于这对夫妻,会持续监控他们的健康状况。

图丨著名学者张锋正在台下等待提问机会,但是并没有等到(来源:DT 君)
在实验的资金来源上,贺建奎说,只有最开始的时候,试剂经费是来自南科大的后期临床费用是贺建奎自己负责的,测序费用是来自于自己的科研启动资金,和名下的公司完全无关。
在讨论环节的最后,主持人问了这样一个问题:“如果是你的孩子,你会怎么做?”
贺建奎表示:“这是个好问题,如果是我的孩子,有同样的处境,我会首先尝试。”( That's a good question. If it was my baby, with the same situation, yes I would try first.)
最后,来自斯隆凯特琳癌症中心的 Maria Jasin 问到,这对双胞胎孩子在 18 岁之前,有独立性之前,因为一个被编辑,一个没被编辑,无论从基因型、家庭、社会到成长的方方面面,孩子都可能被区别对待,从而影响到他们的成长过程,他们还如何选择自由的人生?
贺建奎回复:“我现在还无法回答你这个问题。”
真正“暴风”才刚开始
实际上,整个学术界的大讨论其实才刚刚开始。DT 君了解到的情况是,许多基因编辑学术界的学者都在等待核心数据的公开,其中就包括 CRISPR 技术先驱者、MIT 教授张锋,以及他当时的博士生、现任斯坦福大学医学院的助理教授丛乐。
张锋教授在贺建奎演讲结束后接受采访时表示,目前已经有非常安全的方法来防止病毒在父母和婴儿之间传播,所以根本没有必要做这种试验。关于脱靶问题,张锋教授认为,今天的演讲速度较快,有些细节并不清楚,贺建奎提到可能有一个脱靶的点位,但可能没太大影响,这还需要了解其操作方法和更多的数据才能得出进一步结论。
“我认为他不应该做这个试验,我未来不会做胚胎,以及用它来影响新生婴儿的基因”,张锋教授说到。

图丨斯坦福大学医学院助理教授丛乐(来源:DT 君)
作为 2017 年《麻省理工科技评论》中国区 35 岁以下科技创新者,丛乐教授是将 CRISPR 技术带到人类基因世界的青年科学家之一。2013 年,Science发表了麻省理工学院张锋教授作为通讯作者、丛乐博士作为第一作者的论文,首次将 CRISPR-Cas9 基因编辑系统作用于人类和鼠类细胞,并揭示了相关技术在基因治疗,特别是心脑血管疾病和癌症治疗中的应用潜力。
他在今天大会开始之前通过邮件对 DT 君表示:“我觉得国内开展了世界上最早的基因编辑婴儿工作,在我的意料之中,但是我个人对于这次的工作没有通过学术渠道,用更为严谨的方式来公布信息感到不是非常理解,尤其是在相关人员的身份似乎是学校的科研人员而不是企业中的商业雇员的情况下。这个案例目前公开信息较少,所以我觉得需要等香港会议及之后我们大家才可以更为全面的做出评价。”
丛乐表示,他个人支持并且也在参与基因编辑工具的研究和临床应用,不过相关的伦理社会问题应该在一个更为科学、严谨、公开的环境中让大家理解和讨论。“希望这次是一个很好的机会来让我们推进这个事情”,他说。

(来源:第二届人类基因组编辑峰会)
昨天的大会上,张锋、Jennifer Doudna 两位 CRISPR 权威人物罕见同台,而在今天的大会议程,我们更是看到全球已有的几例胚胎编辑实验中的两位中国领军科学家现身,他们分别是来自中山大学的黄军就教授、上海科技大学的黄行许教授。
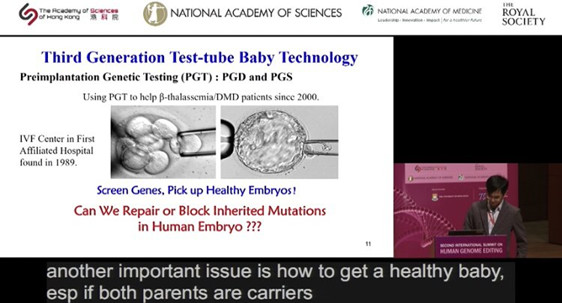
图丨黄军就的演讲(来源:第二届人类基因组编辑峰会)
2015 年,来自中山大学的黄军就教授带领团队首次发表编辑人类胚胎的相关论文,宣布他们在实验室中使用 CRISPR-Cas9 系统,将胚胎中地中海贫血症相关基因敲除,完成世界上“首例胚胎编辑”实验。但事实上由于镶嵌现象和脱靶效应,整个胚胎井没有被完全编辑,同时以此种方式出生的孩子可能面临未知或是无法承受的风险,因而,严格意义上来讲,这次胚胎编辑并不能算是成功。
在上午的演讲中,黄军就表示,虽然在小鼠胚胎模型中能够实现对β地中海贫血基因编辑,并诞生健康的小鼠,但这项研究很难获得人类健康的胚胎,并且具有很大的风险。在演讲的最后,他特别强调,自己所有的实验都基于中国的胚胎基因编辑指导原则。

图丨黄军就的演讲(来源:第二届人类基因组编辑峰会)
黄行许教授则是在 2018 年 9 月带领团队率先将单碱基编辑技术应用于可发育的人类胚胎的遗传疾病修复中。此次接受 CRISPR 治疗的胚胎所患上的疾病——马凡氏综合征——正是一种罕见病。
在此前接受 DT 君采访时,黄行许就表示,胚胎的基因编辑影响深远,因此科学家必须要严格遵循伦理和按照国际规则开展好研究工作。“我们的合作伙伴申请获批了医院伦理委员会的许可,开展了本研究。研究的初步结果是成功的。尽管如此,把胚胎基因治疗应用到临床,需要大量的实验验证可靠性。需要逐步的临床前实验和临床实验验证,仍然有很长的路要走”,他说。
同一事件,不尽相同的各方反应
目前,包括深圳市卫生计生委医学伦理委员会、南科大在内的中国多家机构均表示,将因此次实验调查贺建奎及涉及的单位。广东省卫生健康委也被国家卫健委要求进行调查。
而以“贺建奎”为关键词查阅中国临床试验注册中心能发现,以其为临床试验研究负责人的两个注册题目之一的《HIV 免疫基因 CCR5 胚胎基因编辑安全性和有效性评估》,正是 11 月 26 日曝出的 2 名基因编辑婴儿诞生的临床试验项目。该项目“干预措施”项显示,对 CCR5 基因进行编辑的样本量为 20,即除了上述 2 名婴儿,还对其他 18 个胚胎进行了基因编辑。该项目注册号状态为补注册,注册日期为 2018 年 11 月 8 日,更新日期为 2018 年 11 月 26 日。
整个事件的一大关键问题,谁有权对基因编辑婴儿说是或否?
根据贺建奎在他撰写的伦理审查申请书中,声称他是尝试成功利用基因编辑工具 CRISPR 来编辑胚胎并诞生婴儿的第一人,尽管那时他们还只是实验室里的受精卵。在他的伦理声明中,他向审稿人保证所有事情都没问题。目前,深圳和美医院表示对这份伦理审查书表示不知情。

图|贺建奎在 2017 年 3 月撰写的伦理声明中曾引用了一份美国报告作为其开始研究基因编辑婴儿的依据(来源:麻省理工科技评论)
而在国外,这份伦理申请书的一个细节引发了另一个维度的讨论。伦理申请书特地提到,仅在一个月前,也就是在 2017 年 2 月,美国国家科学院、工程院和医学院“首次”批准用于重大疾病治疗的胚胎编辑实验研究的伦理申请。
也正是这样的结论,就在第二届国际人类基因组编辑峰会召开的前夕,不但贺建奎的惊人之举受到了激烈批评,受到批评的还包括很多撰写那份美国国家学院报告的人。
这份报告在 2017 年推出时就已掀起过一轮大讨论。尽管其中有很多注意事项,但这份报告所传达的信息是明确的。报告没有像一些人所希望的那样,批准暂停 CRISPR 婴儿,相反,报告中写道:“如果目的是治疗或预防严重疾病,基因编辑婴儿最终是被允许的。”

(来源:麻省理工科技评论)
对于亚利桑那州立大学的伦理学家 Benjamin Hurlbut 来说,科学家们在新发现上的竞赛是不可避免的问题,“即使还不确定是否应该使用这项技术。”
“研究人员可以继续声称他们的‘基础’科研与临床应用无关,但这基本都只是权宜之计,”他说,“几十年来,这项研究一直向着科学竞赛的方向发展,先去做,然后再去质疑。这种情况是我们自己造成的,但想逆转是很难的事情。”
“多米诺骨牌正朝着一系列人们觉得不负责和令人反感的方向倾倒,”Hurlbut 说,“正如人类辅助生殖技术的历史所表明的那样,即使是在仍存在严重未知的情况下,从实验室开发技术到将它用来生育孩子也只是很短暂的过程。”
某种程度上,胚胎基因编辑领域、生命科学领域、整个科学界、HIV 患者群体乃至全球公众,各个群体之间对于贺建奎基因编辑婴儿的态度和关注点都不尽相同,群体内部也存在着一些微妙的分歧。预料此事的最终结局将会是多方群体共同博弈平衡的一个结果。
贺建奎其人:加入南科大同年开始创办公司,被视为学校创新典范
相信关注此次事件的各位读者都已经知道,此次事件的主人公贺建奎现为南方科技大学副教授,也是一家名为“瀚海基因”的创业公司的创始人。
根据南方科技大学官网显示,贺建奎 2006 年获得中国科学技术大学近代物理学学士学位,2010 年获得美国莱斯大学生物物理学博士学位,在美国斯坦福大学任博士后。其在斯坦福期间,师从微流控基因芯片鼻祖斯蒂文·奎克。
贺建奎本人拥有多学科交叉的背景,在基因测序仪研究、CRISPR 基因编辑,生物信息学等领域都有硏究成果。在美国斯坦福大学斯蒂文·奎克实验室从事博士后研究期间,他曾研发出免疫组库基因检测技术,并发表在国际顶尖学术杂志 Science 杂志的 Science Translational Medicin 上。
2012 年,贺建奎经深圳市“孔雀计划”海外高层次人才计划引进回国,在南方科学技术大学建立个人实验室进行基因测序方向的研究。据天眼查资料显示,也正是在这一年的 7 月,贺建奎创办了瀚海基因。
资料显示,到了 2015 年 10 月,中国第一台自主知识产权第三代基因测序仪在瀚海基因诞生,2016 年 2 月,Nature 杂志报道瀚海基因三代测序技术。到了 2017 年,瀚海基因宣布成功研发出亚洲第一台具有世界领先水平的第三代基因测序仪样机 GenoCare。

图丨贺建奎和 GenoCare 测序仪(来源:南方科技大学)
Genocare 的上市,贺建奎和他的团队开始以行业黑马的形象走到众人面前。2018 年 4 月,瀚海基因完成 2.18 亿元人民币的 A 轮融资,下一个阶段是迈向大批量投产。根据南科大官方公众号发布过的媒体报道《1 所大学和它的 25 家高科技公司:给教授放假的南方科技大学》,南科大为此专门允许贺建奎停薪留职、全力发展自己的事业。
而在南方科技大学的官方微信发布以及转发的报道中,不难看出这位 80 后海归教授的受重视程度:例如,在《北京日报》一篇名为《回国,到深圳去》的报道中,涉及的南科大创业创新政策以及高质量人才队伍中,就有贺建奎教授的身影。学校刊发的一篇文章中如此写道:“2017 年 7 月,生物系副教授贺建奎经过五年的研发,推出自主研发的第三代基因测序仪,成为深圳乃至全国创新创业的典范”。
除了瀚海基因,他名下还拥有多家企业股权。天眼查数据显示,贺建奎是 7 家公司的股东、6 家公司的法定代表人,并且是其中 5 家公司的实际控制人。这 7 家公司的总注册资本为 1.51 亿元。
特别需要注意的是,根据中国临床试验注册中心的信息显示,相关基因编辑婴儿实验的 Primary sponsor(研究实施负责组长单位)为南方科技大学,而非贺建奎创立的瀚海基因及其入股的任何一家公司,而 Secondary sponsor(试验主办单位,项目批准或申办者) 则为深圳和美妇儿科医院(Shenzhen HarMoniCare Women & Children's Hospital)。

目前,两家单位都已对此次事件作出回复。南方科技大学声明如下:
今日,有媒体报道贺建奎副教授(已于 2018 年 2 月 1 日停薪留职,离职期为 2018 年 2 月—2021 年 1 月)对人体胚胎进行了基因编辑研究,我校深表震惊。在关注到相关报道后,学校第一时间联系贺建奎副教授了解情况,贺建奎副教授所在生物系随即召开学术委员会,对此研究行为进行讨论。根据目前了解到的情况,我校形成如下意见:
一、此项研究工作为贺建奎副教授在校外开展,未向学校和所在生物系报告,学校和生物系对此不知情。
二、对于贺建奎副教授将基因编辑技术用于人体胚胎研究,生物系学术委员会认为其严重违背了学术伦理和学术规范。
三、南方科技大学严格要求科学研究遵照国家法律法规,尊重和遵守国际学术伦理、学术规范。我校将立即聘请权威专家成立独立委员会,进行深入调查,待调查之后公布相关信息。
而深圳和美妇儿科医院下午也回应,否认该院和此事有关“这件事不属实,我们没有接受过相关信息,不知道这件事为什么会上热搜,正在调查。”而至于贺建奎是否有挂靠深圳和美进行相关研究,深圳和美方面表示“不了解情况”。

(来源:南方科技大学)
深圳卫计委也发布关于《世界首例免疫艾滋病的基因编辑婴儿在中国诞生》声明称,根据“医疗卫生机构应当在伦理委员会设立之日起 3 个月内向本机构的执业登记机关备案”,经查,深圳和美妇儿科医院医学伦理委员会这一机构未按要求进行备案。深圳市医学伦理专家委员会已于 11 月 26 日启动对该事件涉及伦理问题的调查,对媒体报道的该研究项目的伦理审查书真实性进行核实,有关调查结果将及时向公众进行公布。
截止发稿前,此事仍在发酵,所涉及多方均否认知情。DeepTech 深科技将继续跟进报道。
-End-
参考:
https://www.technologyreview.com/s/612472/rogue-chinese-crispr-scientist-cited-us-report-as-his-green-light/
第二届国际人类基因组编辑峰会组委会声明
科研圈 2018-11-29
今天,第二届国际人类基因组编辑峰会组委会发布声明,指出“在临床进行任何生殖系细胞的编辑仍然是不负责任的”,并呼吁对相关试验制定严格、负责任的转化途径。以下为组委会声明全文翻译,原文参见文末。
来源 第二届国际人类基因组编辑峰会组委会
翻译 科研圈
时间 2018 年 11 月 29 日
2015 年 12 月,美国国家科学院、美国国家医学院,英国皇家学会和中国科学院在华盛顿特区举办了一次国际峰会,讨论与人类基因组编辑相关的科学、伦理和监管问题。作为峰会议程的结果,组委会发布了一份声明,确定了在当前监管和政府规章的范围内,可进行的研究和临床应用领域。组委会还表示,彼时,在临床进行任何可遗传的生殖系细胞编辑,都是不负责任的。此外,声明呼吁继续就这一快速发展的技术的潜在利益、风险和监督进行国际讨论。
为促进人类基因组编辑的深入、国际性讨论,香港科学院、英国皇家学会、美国国家科学院和美国国家医学院在香港组织了第二届国际人类基因组编辑峰会,以评估这一议题在科学上的不断发展、可能的临床应用,以及社会由此对人类基因组编辑产生的反应。虽然第二次峰会的组委会对体细胞基因编辑在临床试验中的迅速发展表示赞赏,但我们仍然认为,在临床进行任何生殖系细胞的编辑,仍然是不负责任的。
人类基因组编辑研究
基础和临床前研究,正在迅速推动体细胞和生殖系细胞基因组编辑的科学进步。对基因组编辑技术——包括碱基编辑(base editing)进行更好的理解与设计,已经显着提高了技术的效率和精确度,同时大大减少了脱靶。正如所预期的那样,我们目前正在对患者进行体细胞基因组编辑的测试。
改变胚胎或配子的 DNA,可以让携带致病突变的父母拥有健康的后代。然而,我们仍然难以评估胚胎或配子的可遗传基因组编辑带来的风险。人们担心,基因编辑只能改变早期胚胎中某些细胞的基因,而其他未经编辑的细胞仍会导致长期的疾病。生殖系细胞的编辑不仅会对个体产生意想不到的有害影响,也会对个体的后代产生意想不到的有害影响;其对一种特定特征的改变,可能对其他特征带来无法预估的作用,这种不确定性可能因人而异,且会受环境因素的影响。
遗传改变所产生的影响的可变性,使得我们难以对利益和风险进行全面评估。然而,如果这些风险得以解决,并且符合多种其他标准,生殖系基因组编辑在未来可能会被接受。这些标准包括:严格的独立监督、存在迫切的医疗需求、无合理的替代方案、有长期随访计划,以及关注对社会的影响。即便如此,公众对此的接受程度可能因司法管辖区而异,带来不同的响应政策。
组委会总结,由于临床实践所需的科学理解和技术要求仍然过于不确定,风险太大,目前仍不允许进行生殖系基因组编辑的临床试验。 然而,过去三年的进展以及本次峰会的讨论表明,当前应该为这些试验确定严格、负责任的转化途径。
可能的转化路径
生殖系细胞编辑的转化途径需要遵守被广泛接受的临床研究标准,包括过去三年发表的基因组编辑指导文件中阐明的标准[1]。 这样的途径将需要建立一系列相关标准,包括临床前证据和基因修饰准确性的标准、临床试验从业者的能力评估、可执行的专业行为标准,也需要与患者及患者倡导团体建立强有力的伙伴关系。
生殖系细胞编辑临床应用报告
在这次峰会上,我们听到一个出人意料且令人深感不安的消息:已有人类胚胎经过编辑和植入,导致怀孕和双胞胎的诞生。我们建议进行独立评估验证,并确定所声称的 DNA 修饰是否已发生。即使基因修饰有效,该程序也是不负责任的,且不符合国际规范。该程序的缺陷包括医学指征不足、研究方案设计不合理,未能达到保护研究对象福利的伦理标准,以及临床程序的制定、审查和实施方面的缺乏透明度。
持续的国际论坛
组委会呼吁建立一个持续的国际论坛,以促进广泛的公众对话,制定相关的公平性战略以满足服务不足人口的需求,加快监管科学的发展,提供有关治理方案信息的交流中心,促进建立共同的监管标准,并通过对全球计划和正在进行的实验的进行登记,加强研究和临床应用的协调。
除了建立国际论坛外,组委会还呼吁世界各国的科学院和科学、医疗学术团体继续举办国际峰会,以便审核基因组编辑的临床应用,收集不同观点,对政策制定者的决策提供信息,制定建议和指导方针,以及促进国家和司法管辖区之间的协调。
[1] See, for example, National Academies of Sciences, Engineering, and Medicine, Human Genome Editing: Science, Ethics, and Governance (Washington, DC: The National Academies Press, 2017) and Nuffield Council on Bioethics, Genome Editing and Human Reproduction (London: Nuffield Council on Bioethics, 2018).
On Human Genome Editing II
Statement by the Organizing Committee of the
Second International Summit on Human Genome Editing
November 29, 2018
In December 2015, the U.S. National Academy of Sciences and U.S. National Academy of Medicine, the Royal Society of the United Kingdom, and the Chinese Academy of Sciences hosted an international summit in Washington, D.C., to discuss scientific, ethical, and governance issues associated with human genome editing. At its conclusion, the summit organizing committee released a statement identifying areas of research and clinical use that could proceed within current regulatory and governance protocols. The committee also stated that it would be irresponsible to proceed with any clinical use of heritable "germline" editing at that time. Further, it called for continued international discussion of potential benefits, risks, and oversight of this rapidly advancing technology.
As part of their commitment to fostering in-depth and international discussion about human genome editing, the Academy of Sciences of Hong Kong, the Royal Society of the United Kingdom, and the U.S. National Academy of Sciences and U.S. National Academy of Medicine organized the Second International Summit on Human Genome Editing in Hong Kong to assess the evolving scientific landscape, possible clinical applications, and attendant societal reactions to human genome editing. While we, the organizing committee of the second summit, applaud the rapid advance of somatic gene editing into clinical trials, we continue to believe that proceeding with any clinical use of germline editing remains irresponsible at this time.
Human Genome Editing Research
Basic and preclinical research is rapidly advancing the science of somatic and germline genome editing. Better understanding and design of genome editing techniques, including base editing, have produced significant increases in efficiency and precision while greatly reducing off-target events. As was anticipated, somatic genome editing is now being tested in patients.
Making changes in the DNA of embryos or gametes could allow parents who carry disease-causing mutations to have healthy, genetically related children. However, heritable genome editing of either embryos or gametes poses risks that remain difficult to evaluate. Concerns persist that changes may be made in only some cells of early-stage embryos, leaving unedited cells to perpetuate a disease. Germline editing could produce unintended harmful effects for not just an individual but also for that individual’s descendants. Changes to a particular trait may have unanticipated effects on other traits that could vary from person to person and in response to environmental influences.
The variability of effects produced by genetic changes makes it difficult to conduct a thorough evaluation of benefits and risks. Nevertheless, germline genome editing could become acceptable in the future if these risks are addressed and if a number of additional criteria are met. These criteria include strict independent oversight, a compelling medical need, an absence of reasonable alternatives, a plan for long-term follow-up, and attention to societal effects. Even so, public acceptability will likely vary among jurisdictions, leading to differing policy responses.
The organizing committee concludes that the scientific understanding and technical requirements for clinical practice remain too uncertain and the risks too great to permit clinical trials of germline editing at this time. Progress over the last three years and the discussions at the current summit, however, suggest that it is time to define a rigorous, responsible translational pathway toward such trials.
A Proposed Translational Pathway
A translational pathway to germline editing will require adhering to widely accepted standards for clinical research, including criteria articulated in genome editing guidance documents published in the last three years.[1] Such a pathway will require establishing standards for preclinical evidence and accuracy of gene modification, assessment of competency for practitioners of clinical trials, enforceable standards of professional behavior, and strong partnerships with patients and patient advocacy groups.
Report of Clinical Use of Germline Editing
At this summit we heard an unexpected and deeply disturbing claim that human embryos had been edited and implanted, resulting in a pregnancy and the birth of twins. We recommend an independent assessment to verify this claim and to ascertain whether the claimed DNA modifications have occurred. Even if the modifications are verified, the procedure was irresponsible and failed to conform with international norms. Its flaws include an inadequate medical indication, a poorly designed study protocol, a failure to meet ethical standards for protecting the welfare of research subjects, and a lack of transparency in the development, review, and conduct of the clinical procedures.
An Ongoing International Forum
The organizing committee calls for an ongoing international forum to foster broad public dialogue, develop strategies for increasing equitable access to meet the needs of underserved populations, speed the development of regulatory science, provide a clearinghouse for information about governance options, contribute to the development of common regulatory standards, and enhance coordination of research and clinical applications through an international registry of planned and ongoing experiments.
In addition to the establishment of an international forum, the organizing committee calls upon national academies and learned societies of science and medicine around the world to continue the practice of holding international summits to review clinical uses of genome editing, to gather diverse perspectives, to inform decisions by policymakers, to formulate recommendations and guidelines, and to promote coordination among nations and jurisdictions.
[1] See, for example, National Academies of Sciences, Engineering, and Medicine, Human Genome Editing: Science, Ethics, and Governance (Washington, DC: The National Academies Press, 2017) and Nuffield Council on Bioethics, Genome Editing and Human Reproduction (London: Nuffield Council on Bioethics, 2018).
Organizing Committee
David Baltimore1,2 (committee chair)
President Emeritus and Robert Andrews Millikan Professor of Biology
California Institute of Technology
United States
Alta Charo2
Warren P. Knowles Professor of Law and Bioethics
University of Wisconsin, Madison
United States
George Q. Daley2
Dean of the Faculty of Medicine and Caroline Shields Walker Professor of Medicine
Harvard Medical School
United States
Jennifer A. Doudna1,2
Investigator, Howard Hughes Medical Institute; and
Professor, Department of Molecular and Cell Biology and Department of Chemistry
University of California, Berkeley
United States
Kazuto Kato
Professor of Biomedical Ethics and Public Policy
Graduate School of Medicine
Osaka University
Japan
Jin-Soo Kim
Director of Center for Genome Engineering
Institute for Basic Science
Seoul National University
South Korea
Robin Lovell-Badge3
Senior Group Leader
The Francis Crick Institute; and
Special Visiting Professor
University of Hong Kong
United Kingdom
Jennifer Merchant
Professor of Legal and Political Institutions
Université de Paris II (Panthéon-Assas)
France
Indira Nath
Visiting Professor, Bio-Support Unit
Department of Biotechnology
All India Institute of Medical Sciences (AIIMS); and
Former Raja Ramanna Fellow and Emeritus Professor
National Institute of Pathology
India
Duanqing Pei
Professor and Director General
Guangzhou Institutes of Biomedicine and Health
Chinese Academy of Sciences
China
Matthew Porteus
Associate Professor of Pediatrics
Division of Stem Cell Transplantation and Regenerative Medicine
Stanford University
United States
John Skehel3
Emeritus Scientist
The Francis Crick Institute
United Kingdom
Patrick Tam3
Deputy Director and Head, Embryology Research Unit
Children's Medical Research Institute;
Senior Principal Research Fellow
National Health and Medical Research Council (NHMRC) of Australia;
Professor, School of Medical Sciences, Faculty of Medicine and Health
The University of Sydney; and
Mok Hing-Yiu Distinguished Visiting Professor
School of Biomedical Sciences
University of Hong Kong
Australia
Xiaomei Zhai
Professor and Executive Director, Centre for Bioethics
Chinese Academy of Medical Sciences and Peking Union Medical College
China
______________________________________
1Member, U.S. National Academy of Sciences
2Member, U.S. National Academy of Medicine
3Fellow, The Royal Society
中国学者首次对贺建奎事件发表正式学术评论:存在严重科学问题,感到极其愤怒
原创 科研圈 科研圈 2019-05-01
今日凌晨,两位中国学者在 PLOS Biology 发表观点文章,对贺建奎基因编辑婴儿事件进行学术性评论。这是 2018 年 11 月底贺建奎公布基因编辑婴儿诞生后,中国学者首次从科学原理、实验设计和数据的角度,在学术期刊上发表正式同行评议文章,针对这一震惊全球的科学事件发声和表态。
文章的两位作者均为活跃在基因编辑领域的学者:中科院动物研究所研究员王皓毅和中科院神经科学研究所研究员杨辉。两人都是胚胎基因编辑方面的专家,多次在 Cell、Nature Biotechnology、Cell Research 等重要期刊发表论文。
王皓毅对“科研圈”表示:“去年这件事情发生之后,我们基因编辑领域的同行都非常愤怒。目前已经有很多针对伦理问题的文章和讨论了,但是作为基因编辑领域的研究者,我们希望能够从科学和技术的角度讲清楚为什么我们认为这个所谓的研究工作是非常错误的。正好也受到 PLOS Biology 邀请,所以我就和杨辉一起写了这篇文章。”杨辉也认为,“从专业角度来说,我们更适合评价这一事件科学层面上的东西。”
据了解,这篇文章在提交后接受了由期刊编辑选定的外部专家的审稿,两位作者也表示审稿意见非常中肯和有建设性。当“科研圈”提出,这篇文章能否代表国内基因编辑学者对贺建奎基因编辑婴儿事件的看法时,两位作者表示:因为没有正式发表的论文,他们只能根据贺的报告内容进行评估;对于具体的科学和技术细节,可能还有有待其他同行可以补充的地方;但是对于此事的整体判断,可以说是“国内外基因编辑领域学者共同的声音”。
这篇文章也在某种意味上体现了科学共同体对贺建奎基因编辑婴儿事件的态度和决心。“科研圈”对这篇文章进行了全文翻译,希望能为所有关心这一事件的读者提供更加准确的信息与参考。
*文章原标题为Gene-edited babies: What went wrong and what could go wrong(点击标题进入原文页面),享有 CC BY 4.0 开放版权协议。 译文未经原作者审校,文中小标题和配图均为译者添加,如有不尽之处,敬请指正。
基因编辑婴儿:已经出现的问题以及可能存在的风险
王皓毅1,2,3 杨辉4,5,6
1 中国科学院动物研究所干细胞与生殖生物学国家重点实验室,2 中国科学院干细胞与再生医学创新研究院,3 中国科学院大学,4 中国科学院上海生命科学研究院神经科学研究所神经科学国家重点实验室,5 中国科学院脑科学与智能技术卓越创新中心,6 上海脑科学与类脑研究中心
2018 年 11 月 25 日,时任南方科技大学副教授的贺建奎宣布,两名携带经过编辑的 CCR5 基因的婴儿已经在中国诞生(译者注:南科大在 3 个月后宣布与贺建奎解除劳动关系)。他宣称,这个基因修正将让婴儿对 HIV 病毒感染免疫。11 月 28 日,贺在第二届国际人类基因组编辑峰会上展示了项目实验数据。尽管目前实验的基本证据仍未披露,相关声明的真实性仍不明确,贺在峰会上展示的实验设计和数据已经暴露出严重的科学问题和伦理问题。作为来自中国基因编辑领域的研究人员,我们对这一事件感到十分震惊。贺的工作看起来是秘密进行的。根据我们目前所了解的信息,贺从未在基因编辑领域发表过有影响力的科研论文,在中国的基因编辑学界也并不活跃。我们对这起极端不负责任的行为感到极其愤怒,这明显违反了中国乃至全世界各个国家的法律法规和医学伦理。在此,我们假设贺展示的数据是真实的,并从科学的角度对该实验做出评价。因为我们相信,如果要对这次事件进行负责任的审查和讨论,必须充分了解其中的科学事实。
2018 年 11 月 28 日,贺在第二届国际人类基因组编辑峰会上展示项目实验数据。图片来源:bbc.com
实验本身的合理性存疑
首先,我们要批评实验的整体理念。贺宣称,对 CCR5 基因进行编辑是为了避免婴儿感染 HIV 病毒,因为孩子的父亲是 HIV 携带者(母亲不携带病毒)。但是,要想避免 HIV 传染给胎儿,在胚胎中进行基因编辑是完全不必要的。HIV 阳性的父亲可以通过完善的辅助生殖技术(Assisted Reproductive Technology,ART)孕育健康的后代,这一技术有极高的成功率 [1]。至于未来对 HIV 感染的防范,只要避免可能的 HIV 暴露风险,对大多数人来说就足够了。因此,编辑早期胚胎不能给婴儿带来好处,却在多方面带来了潜在的严重风险,接下来我们将讨论这部分内容。
CCR5 基因编码白细胞上的一个受体蛋白,HIV-1 利用它和另一种受体感染人体细胞。某些特定欧洲人群携带一个自然发生的等位基因 CCR5Δ32,尽管携带该基因的杂合与纯合个体的 HIV 感染都发展得更缓慢,或者对 HIV 感染免疫 [2,3],但是就算是纯合个体,也能被某些 HIV 毒株感染[4]。携带 CCR5Δ32 的个体总体上是健康的,但这个等位基因在非欧洲人群中出现的概率极低,并且中国人群中目前仍未发现纯合个体 [5,6]。因此,很难预测将 CCR5Δ32 或其他 CCR5 等位基因突变引入中国遗传背景的风险。尽管贺宣称他准备了长期的健康追踪计划,没有细节信息表明谁会对此提供资金支持,也不清楚当医疗事故发生时如何进行责任评估。
CCR5Δ32基因分布比例。图片来源:Frequencies of gene variant CCR5-Δ32 in 87 countries based on next-generation sequencing of 1.3 million individuals sampled from 3 national DKMS donor centers
实验整体科学水平堪忧
接下来,我们将讨论贺的数据。贺一开始展示了 CCR5 基因敲除小鼠的数据,以评估“在胚胎期通过 CRISPR/Cas9 基因编辑技术敲除 CCR5 是否会造成预期外的遗传学、生理学或行为学影响”(引号中内容直接引用自贺的展示幻灯片)。这太荒唐了。仅仅通过对比四个不同组织的组织学染色结果,而不进行量化评估,再加上两个简单的小鼠行为学实验,不可能回答以上问题。
这项研究的科学水平很低,并且流于表面。例如,新奇物体探索行为测试(novel object investigation behavior test)的数据显示,尽管 P 值大于 0.05(译者注:这代表两组数据在统计学上没有显著差异),但野生型小鼠和 CCR5 敲除小鼠的表现仍存在明显差异。为了证明 CCR5 敲除不会产生任何行为表型,需要在更大的样本中进行进一步评估。简单进行文献搜索就能发现,CCR5 编码的蛋白是一个趋化因子受体,具备正常的免疫功能,而 CCR5 敲除小鼠的自然杀伤细胞相关表型会导致多种病毒感染风险增加[7-9]。
混乱的编辑结果和被低估的风险
接下来,贺设计了多个单链向导 RNA(single-guide RNAs, sgRNAs),并在人类细胞系和猴子胚胎中测试了它们的有效性——这在基因编辑实验中是很常见的操作。CRISPR-Cas9 编辑系统被送进细胞后,其基因组靶点上的 DNA 双链继而发生断裂。随后DNA修复系统开始工作,这时参与修复的可能是非同源末端连接(nonhomologous end joining, NHEJ)修复,或者同源介导/重组修复(homology-directed repair, HDR)。NHEJ 常会导致一小部分碱基的插入或缺失(indel),但 HDR 能在编辑靶点完成对断裂 DNA 的完美修复或精确修改。
DNA双键断裂后的两种修复模式。图片来源:emendobio.com
贺的展示中只对 NHEJ 修复导致的碱基插入或缺失做了描述,但是我们没有看到任何数据反映出能产生 CCR5Δ32 的 HDR 修复。这说明贺原本的实验目的并不是创造 CCR5Δ32。据我们所知,除了 CCR5Δ32 之外,人体中其他天然突变的 CCR5 indel 等位基因并不常见。以往的研究发现,两个 CCR5 等位基因均突变的个体表达的、可稳定存在的截短型 CCR5Δ32 蛋白可能参与 HIV 感染免疫表型的出现[10]。因此在考虑基因编辑带来的益处与风险时,我们不能把其他种类的 CCR5 突变和 CCR5Δ32 混为一谈。此外,没有改变三联体密码子读码框的基因编辑也很可能产生功能获得性突变,其风险更加难以预测。
贺建奎还试图利用猴子受精卵进行了显微注射方法的优化,并且通过测序评估了基因编辑的效力和细胞嵌合水平(译者注:基因编辑可能会导致一个胚胎中的不同细胞各自具有不同的基因型,这种现象被称为嵌合体)。由于他的数据未被任何期刊或出版平台正式发表,PPT 展示出的内容不足以让我们下定论。我们只能说,根据他在会议上的展示,猴子胚胎实验中的嵌合体问题并没有得到解决。
接下来,贺建奎开始给人类胚胎实施显微注射。根据他的数据和之前的研究, 用 Cas9 蛋白代替 Cas9 mRNA,在减数第二次分裂中期(metaphase II, MII)注射进胚胎能够减少嵌合体的比例,但并不能完全避免嵌合现象发生[11,12]。而且这种策略只在 NHEJ 介导的基因敲除中有用,对于 HDR 介导的精确基因修复则不然。虽然目前已经出现了很多在细胞水平增强 HDR 修复的方法[13],但是这些方法能否用于人类胚胎还是个未知数。
Mitalipov 课题组的研究显示母源等位基因是修复过程的模板,能够修正病理性突变[12]。但其他课题组并不同意这一观点:Cas9 可能会导致大范围的碱基删除或重排,而且导致以 PCR 为基础的基因分型检测得到假阳性结果(译者注:这里的假阳性意味着实际上没有被成功编辑的基因,但在检测过程中被认为成功达到了编辑目的)[14]。上述争论传达了这样的事实:目前学界对于 DNA 修复机制、人类早期胚胎基因编辑的后果的理解仍然不全面,也反映出贺很可能低估了嵌合体的发生率,也低估了基因改造带来的风险。
未被解决的脱靶和中靶突变
为了评估编辑脱靶所造成的突变,贺建奎用经过编辑的人类胚胎建立了一个人类胚胎干细胞(human embryonic stem cell, hESC)系。这项实验的科学质量又一次没有达标。他从一个经过编辑的胚胎中只得到了一个 hESC 系,随后它被用来进行全基因组测序(whole-genome sequencing, WGS),以检测潜在的脱靶突变。在 hESC 的分离和扩增过程中,可能会发生许多遗传变异 [15]。因此,为了识别出真正由基因编辑脱靶导致的突变,需要从经过编辑和未经过编辑的胚胎中取出细胞建立多个 hESC 系,进行深度测序和大量的生物信息学分析。
贺进一步宣称,他对 19 个经过编辑的人类囊胚的植入前遗传诊断(preimplantation genetic diagnosis , PGD)样本进行了单细胞全基因组测序,以评估基因编辑的中靶(on-target)和脱靶情况,然后才决定哪些胚胎可以植入母体。19 个胚胎中有 12 个含有 CCR5 野生型等位基因,表明 CCR5 在这些胚胎中未得到完全编辑。重要的是,目前还没有成熟可靠的单细胞全基因组测序技术能够评估脱靶突变 [16]。这项技术需要借助全基因组扩增,将基因组中的单个拷贝扩增到足够的量,这一过程会引入许多人为突变 [16]。此外,嵌合体问题也是一个重要的顾虑,这无法通过 PGD 来评估,因为我们无法对一个胚胎中的所有细胞进行测序 [17]。这意味着即使被测序的细胞得到了正确的编辑,不可忽视的风险仍然存在——胚胎中的其他细胞可能没有经过编辑,或携带预期外的突变,从而导致无法预测的后果。因此,贺的说法是不可靠的。
脱靶效应会产生有害后果。图片来源:Gene Editing QC
除了脱靶效应之外,还有研究报告 CRISPR-Cas9 引发的双链断裂可能导致中靶诱变效应(on-target mutagenesis effects)[18,19]。除了不同类型的插入、删除、转位、重排之外,中靶诱变还包括大范围染色体删除、染色体截短、同源基因间修复导致的基因组纯合。目前没有一种单一手段能够检测所有类型的中靶突变,尤其是当它们的发生频率很低的时候。
在两名女婴诞生后,贺的团队从脐带血、脐带和胎盘中采集了 DNA,进行全基因组测序,并宣布 CCR5 编辑成功。全基因组测序结果显示,这些样本中各只存在两种不同的 CCR5 等位基因。分别占测序结果的大约一半。对于露露,一个等位基因保留了野生型,而另一个等位基因出现了非移码删除(in-frame deletion,少了 15 个碱基。译者注:即刚好有 5 个三联密码子被删除,因此其他未被删除的基因所表达的蛋白不会发生改变)。对于娜娜,在全部测序结果中,CCR5 的靶位区域都出现了两个 CCR5 等位基因突变,这表明娜娜的所有样本都没有受到母亲身体组织(其中含有 CCR5 野生型等位基因)的污染,这点实在令人惊异。但是,因为样本采集和数据分析的细节缺失,我们无法得出明确的结论。我们强烈建议相关机构对所有的原始数据进行彻底检查,并对学界和公众披露事实。
总而言之,基于目前所了解的信息,我们确信在科学角度上,没有可靠的理由来对人类生殖细胞进行这种类型的基因编辑,贺建奎及其团队不仅严重违反了中国的法律法规,也违反了国际科研群体所达成的共识。我们在科学和伦理角度对他们极度不负责任的行为提出强烈谴责。我们强烈要求国际科研群体和监管机构尽快发起一场彻底的讨论,为以生殖为目的的人类生殖细胞基因组编辑建立守则和标准。在达成明确共识后,需要在国际水平上通过、建立和执行明确而严格的规定。不过我们同时相信,进一步发展和改进相关技术,在体外实验环境下对人类生殖细胞(包括早期胚胎、精子和卵母细胞)进行精确的基因修饰,是十分必要的。只有对特定疾病的治疗达成共识,并针对性建立指导方针后,这项改进过的技术才有可能被用于应对遗传疾病。
后记
巧合的是,中国科学院科研道德委员会在这篇文章正式发表的前一天下午,就生物医学研究中有悖于伦理规范的常见问题发出“伦理提醒”,倡导在科研实践中恪守各类伦理要求,努力营造风清气正的科研生态(链接)。
正如王皓毅和杨辉在文中所说,只有充分了解其中的科学事实,我们才可能对这一事件进行负责任的审查和讨论,进而建立明确而严格的守则和标准,避免再次出现科学和伦理上的“暴行”。
相关阅读:
贺建奎近况:处于“隔离生活”状态,已被南方科大解除劳动合同关系
广东初步查明“基因编辑婴儿事件”:贺建奎私自开展人类胚胎基因编辑活动


