实验二碱裂解法小量提取质粒DNA
一实验目的
了解少量质粒制备方法与原理,掌握碱法小量提取质粒DNA的操作步骤。
二实验原理
本实验利用NaOH破坏菌体细胞使核酸物质从细胞中释放出来,因此称为碱裂解法抽提。十二烷基磺酸钠(SDS)能裂解细菌细胞膜,但更重要的作用在于其与钾离子反应后所引起的溶液中绝大部分蛋白质以及基因组DNA共沉淀。由于还有很多蛋白质不能被共沉淀掉,因此要进一步用酚、氯仿对溶液进行抽提。最后加入2倍体积的无水乙醇或0.7倍体积的异丙醇沉淀就能得到质量稳定的质粒DNA。从细菌中分离质粒DNA的方法主要包括3个基本步骤:培养细菌使质粒扩增;收集和裂解细胞;分离和纯化质粒DNA。
三实验材料
转化质粒PET28a后经卡那抗性筛选获得的E. coli DH5α系列菌株
四实验设备
微量取液器(100μl,1000μl),台式高速离心机
五试剂
溶液Ⅰ:50mmol/L 葡萄糖,25 mmol/L Tris.Cl(pH8.0), 10mmol/L EDTA (pH8.0)。溶液Ⅰ可成批配制,每瓶100ml,高压灭菌15分钟,储存于4℃冰箱。
溶液Ⅱ:0.2mol/L NaOH 、1% SDS (临用前用0.4mol/L NaOH和2% SDS母液稀释)。
溶液Ⅲ:5mol/L KAc 60ml,冰醋酸 11.5ml, H2O 28.5ml,定容至100ml, 并高压灭菌。溶液终浓度为: K+ 3mol/L, Acˉ 5mol/L
饱和酚、氯仿、TE缓冲液
六实验步骤
1. 用移液枪取1.5ml培养液放入1.5ml eppendorf管中,5000 rpm 5 min收集菌体;
2. 弃上清,将管倒置于吸水纸上尽量使液体流尽;
3. 菌体沉淀重悬浮于200μl溶液Ⅰ中;
4. 按试剂配方配制溶液Ⅱ,加入新配制的溶液Ⅱ200μl,盖紧管口,快速温和上下颠倒eppendorf管数次以混匀溶液(千万不要振荡,动作轻柔);
5. 立即加入200μl预冷的溶液Ⅲ,盖紧管口并温和颠倒离心管数次,混匀溶液,置冰浴中10分钟;
6. 12000 rpm离心10分钟;
7. 加入等体积的酚/氯仿(1:1),颠倒混匀, 12000 rpm 10分钟;
8. 小心吸取上清夜移入干净eppendorf管中,加入2倍体积的无水乙醇,振荡混匀后置于-20℃冰箱中20分钟;
9. 12000 rpm离心10分钟;
10. 弃上清, 将管倒置于吸水纸上使所有液体流出,加入200μl预冷的70%乙醇洗涤沉淀。
11. 同步骤10,重复洗涤沉淀一次;
12. 弃去乙醇溶液,将管倒置于吸水纸上使液体流尽,室温或37℃下干燥;
13、将沉淀溶于30μl TE缓冲液(pH8.0,含20μg /ml RNaseA)中,储于-20℃冰箱中。
[注意]
1. 提取过程应尽量保持低温。
2. 提取质粒DNA过程中除去蛋白很重要,采用酚/氯仿去除蛋白效果较单独用酚或氯仿好。最好在用酚/氯仿抽提一次后再用氯仿抽提一次,以去除残留的酚对质粒的后继实验,如酶切反应等的不良影响。
3. 沉淀DNA通常使用冰冷的无水乙醇,在低温条件下放置时间稍长可使DNA沉淀完全。沉淀DNA也可用异丙醇,但由于常把盐沉淀下来,所以多数还是用乙醇。
4. 质粒DNA分子小,所以没有变性,染色体变性后不能复性。
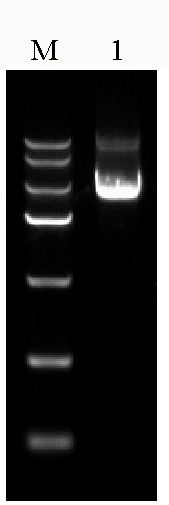
图-质粒电泳结果。M为marker,泳道1为质粒


