-
1 内容
-
2 测验4.6
一、教学目标
1.了解蛋白质对生物体的重要意义;
2.蛋白质的分类,掌握蛋白质元素组成的特点;
3.掌握氨基酸的结构特点及理化性质;
4.蛋白质一、二、三、四级结构的概念及稳定因素;
5.理解蛋白质结构与功能的关系;
6.掌握蛋白质的理化性质以及这些性质的生理意义及实践意义;
7.了解蛋白质分离提纯常用方法及基本原理。
二、教学重点
1.氨基酸的结构特点及理化性质
2.蛋白质一级结构的概念
3.蛋白质二级结构的概念
4.掌握蛋白质的理化性质以及这些性质的生理意义及实践意义
三、教学难点
1.氨基酸的结构和理化性质
2.蛋白质的结构和功能的关系
蛋白质的理化性质与分离纯化
一、理化性质
(二)蛋白质的两性电离
蛋白质的两性电离和等电点( isoelectric point, pI) 情况基本同前述的氨基酸。
(二)蛋白质的胶体性质
(1)蛋白质为生物大分子,分子直径在胶粒范围。
(2)蛋白质胶体的稳定因素:颗粒表面电荷;水化膜。
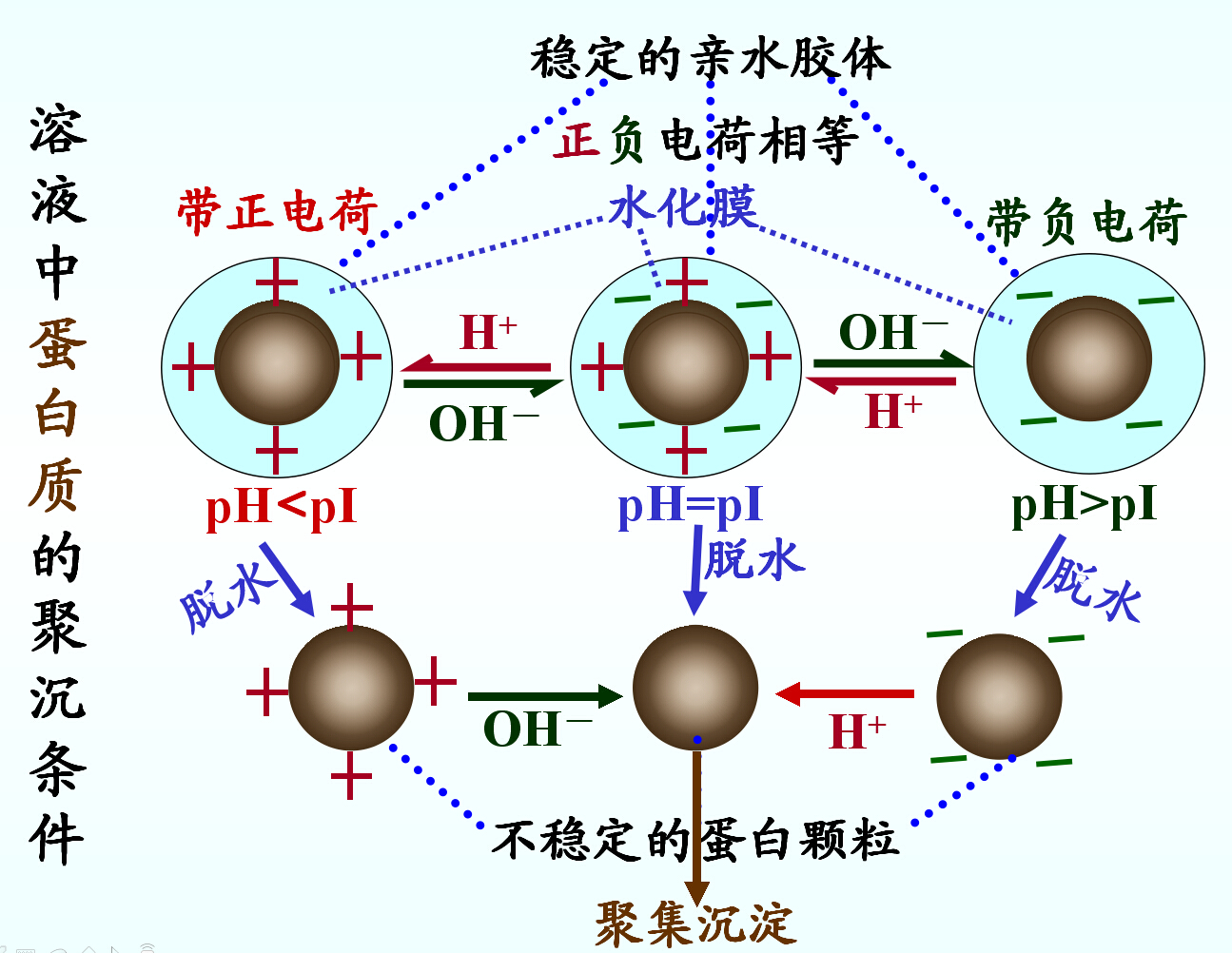
(三)蛋白质的变性、沉淀和凝固
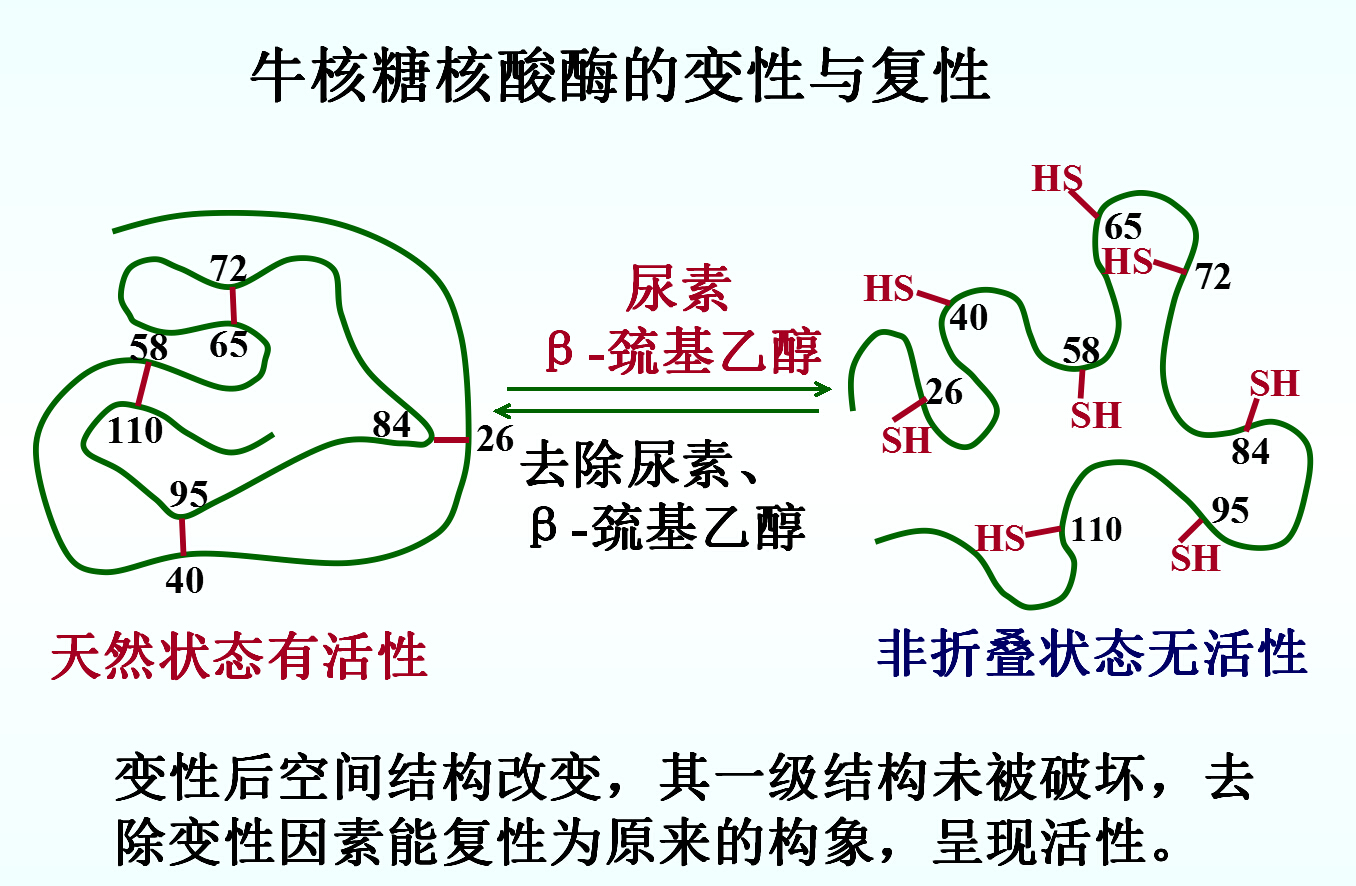
1.蛋白质的变性(denaturation)与复性
(1)定义:理化因素作用下→空间构象→理化性质改变活性的丧失。
(2)变性的本质:破坏非共价键和二硫键,肽键未被破坏,一级结构未改变。
(3)应用:变性和防止变性可用来消毒灭菌和保存蛋白质制剂等。
(4)复性(renaturation):若去除变性因素后,蛋白质仍可恢复原有的构象和功能。
2.蛋白质沉淀
(1)定义:一定条件下,疏水侧链暴露在外,肽链相互缠绕聚集,蛋白质从溶液中析出。
(2)变性的蛋白质易于沉淀,沉淀并不一定变性。
3.蛋白质的凝固作用(protein coagulation)
蛋白质变性后的絮状物加热可变成比较坚固的凝块,此凝块不易再溶于强酸和强碱中。
(四)蛋白质的紫外吸收
蛋白质分子中的酪氨酸和色氨酸,在280nm波长处有特征性吸收峰。可作蛋白质定量测定。
(五)蛋白质的呈色反应
(1)茚三酮反应(ninhydrin reaction)
(2)双缩脲反应(biuret reaction)


