原子的组成、元素和原子轨道能级
上一节
下一节

原子非常小,以碳(C)原子为例, 其直径约为140pm(皮米),但是通常以半径记录,在以毫米(mm)为单位的情况下,直径为1.4×10-7mm,是由位于原子中心的原子核和一些微小的电子组成的,这些电子绕着原子核的中心运动,就像太阳系的行星绕着太阳运行一样。并且原子与宇宙任何黑色粒子相同。原子核的最新研究表明,原子核中的质子或中子可能由内外两种平衡力构成的球型振动能量层。利用此原理可以利用不同大小的能量堆层构造出各种各样比较稳定的原子核。
 ①质量数(A)=质子数(Z)+中子数(N)
①质量数(A)=质子数(Z)+中子数(N)
②原子序数(z)=核内质子数=核电荷数=核外电子数

原子轨道又称轨态,是以数学函数描述原子中电子似波行为。此波函数可用来计算在原子核外的特定空间中,找到原子中电子的机率,并指出电子在三维空间中的可能位置。“轨道”便是指在波函数界定下,电子在原子核外空间出现机率较大的区域。具体而言,原子轨道是在环绕着一个原子的许多电子(电子云)中,个别电子可能的量子态,并以轨道波函数描述。
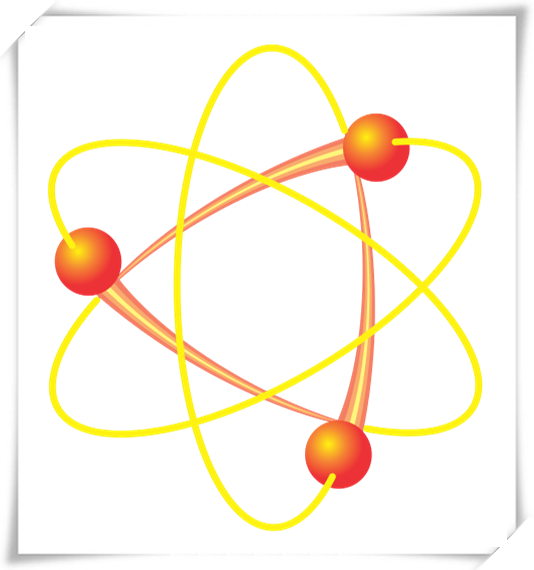
现今普遍公认的原子结构是波耳氢原子模型:电子像行星,绕着原子核(太阳)运行。然而,电子不能被视为形状固定的固体粒子,原子轨道也不像行星的椭圆形轨道。更精确的比喻应是,大范围且形状特殊的“大气”(电子),分布于极小的星球(原子核)四周。只有原子中存在唯一电子时,原子轨道才能精准符合“大气”的形状。当原子中有越来越多电子时,电子越倾向均匀分布在原子核四周的空间体积中,因此“电子云”越倾向分布在特定球形区域内(区域内电子出现机率较高)。


