3-15 范德华力:在分子和分子之间,还普遍存在着另外一种相对弱得多的作用力,称为分子间作用力。分子间作用力也被称为范德华力。分子间作用力分为三类,色散力、诱导力、取向力。
由固有偶极矩造成的分子间作用力称为〝取向力〞,〝取向力〞只能发生在存在固有偶极矩的极性分子和极性分子之间。由瞬间偶极造成的分子间作用力称为〝色散力〞,可以发生在一切分子之间。由诱导偶极造成的分子间作用力称为〝诱导力〞。可发生在极性分子和其它分子之间。一般而言,分子间作用力以色散力最为重要,因为它存在于任何分子之间。
取向力
诱导力
色散力
3-16分子的极性:分子的极性大小也用偶极矩μ表征。偶极矩越大,分子极性越强,反之亦然。分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子。分子中正负电荷中心重合,空间对称的,这样的分子为非极性分子。
3-17 氢键:氢键是一种非常特殊的作用力,一般存在于分子之间,有时候也存在于分子之内。氢键的强度与范德华力处在同一个数量级(101 kJ·mol-1),但又具有一些化学键的性质,如饱和性和方向性。氢键的形成,常出现在NH3、H2O和HF这几种物质中。氢键使得物质的熔、沸点改变。形成分子内氢键,熔、沸点降低。形成分子间氢键,熔沸、点升高。
HF中的氢键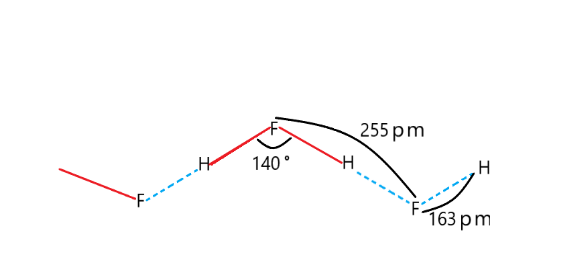
水分子周围的氢键




