3-10 σ键和π键:若价层轨道沿着轨道轴向发生重叠,这种重叠被形象地称为〝头碰头〞的重叠。沿着轨道轴向发生有效重叠而形成的共价键,称为〝σ〞键。对于大多数原子,原子轨道重叠时,优先选择的是〝头碰头〞的重叠,形成σ键。因为沿着轴向重叠电子云叠密度最大,势能最低,重叠部分的强度最大,使得形成的共价键更加稳定。
s-sσ键
s-p σ键
p-p σ键
而〝肩并肩〞的π键,重叠部分小,电子云重叠密度稍小,势能稍高,重叠部分的强度相对稍弱,使得形成的共价π键的强度不如σ键,即π键没有σ键牢固。当有多个未成对电子存在的p轨道,平行排列,形成一群〝肩并肩〞的重叠,这样形成的π键叫做大π键。
氮气分子的形成(σ键+π键)
苯环中的大π键
3-11 轨道杂化:在形成共价键时,中心原子的原有价层电子轨道会重新组合成新的电子轨道。新组合成的电子轨道称作〝杂化轨道〞。轨道重新组合的过程叫做〝杂化〞。这是杂化轨道理论对价键理论最重要的补充和发展。能量比较接近的电子轨道之间才有可能杂化。
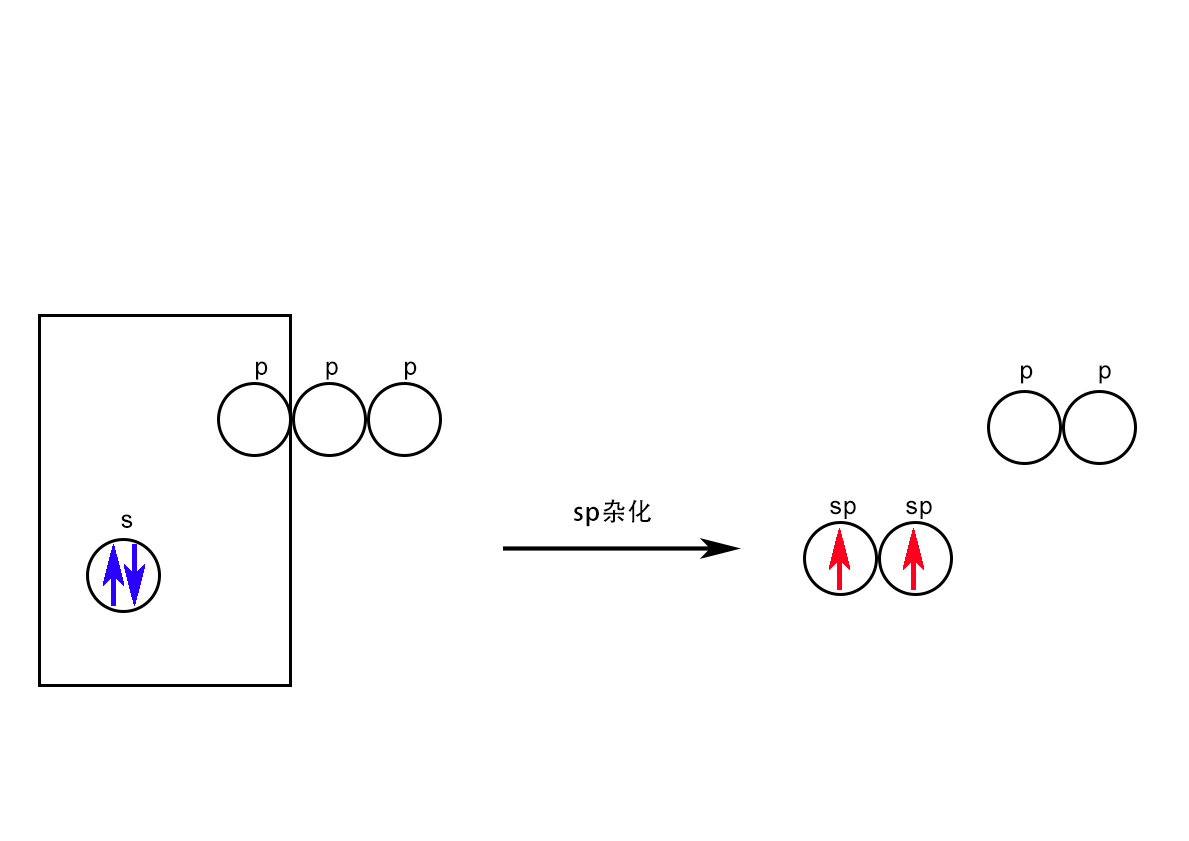
sp杂化:1个s轨道和1个同主层即主量子n相等的p轨道参与的杂化。代表性的物质是ⅡA元素的共价化合物。如BeCl2。
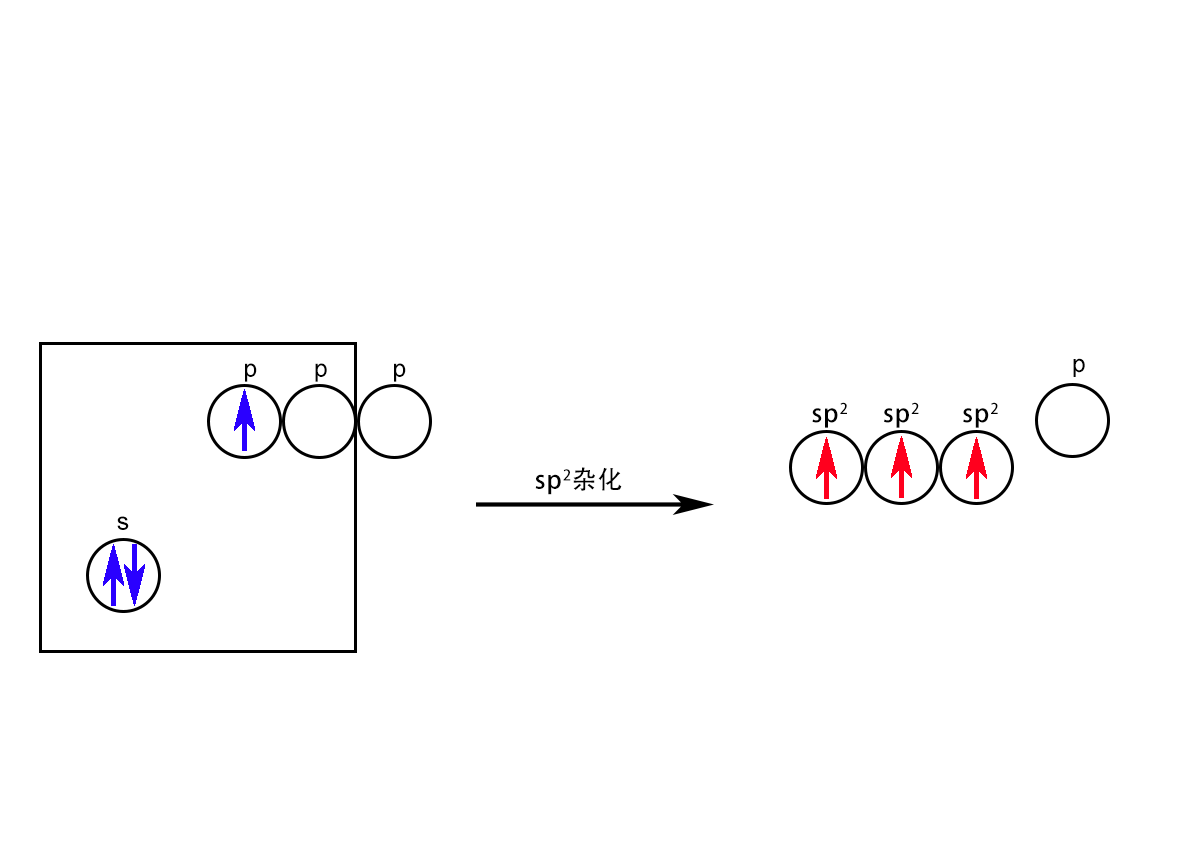
sp2杂化:中心原子价层的一条s轨道和两条p轨道参与的杂化。代表性的物质是ⅢA元素B的共价化合物,如BF3。
C2H4(乙烯)中的sp2杂化
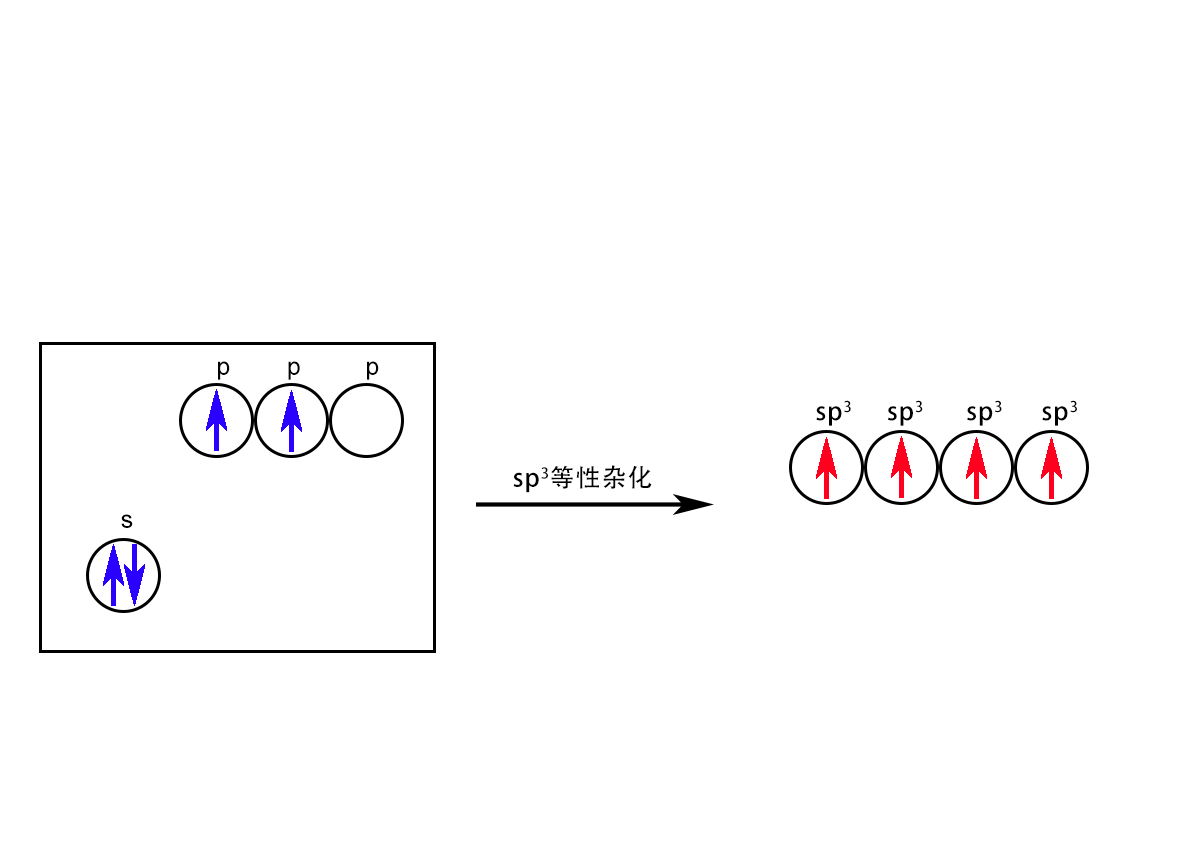
sp3杂化:中心原子价层电子的一条s轨道和三条p轨道参与的杂化。sp3杂化可分为等性sp3杂化和不等性sp3杂化两类。
等性sp3杂化:杂化后的4条sp3杂化轨道是完全平等的。所谓〝完全平等〞是指它们在空间的分布上是完全一样的。这就要求每个轨道必须而且只能有一个不成对的电子。代表性的物质是ⅣA元素C、Si的共价化合物,如CH4、烷烃、SiF4、金刚石、SiC等。
不等性sp3杂化:杂化后的4条sp3杂化轨道是不完全平等的。所谓〝不平等〞是指它们在空间的分布上是不完全一样的。原因是四条杂化轨道上分布的电子数是不相等的。
NH3中的sp3不等性杂化
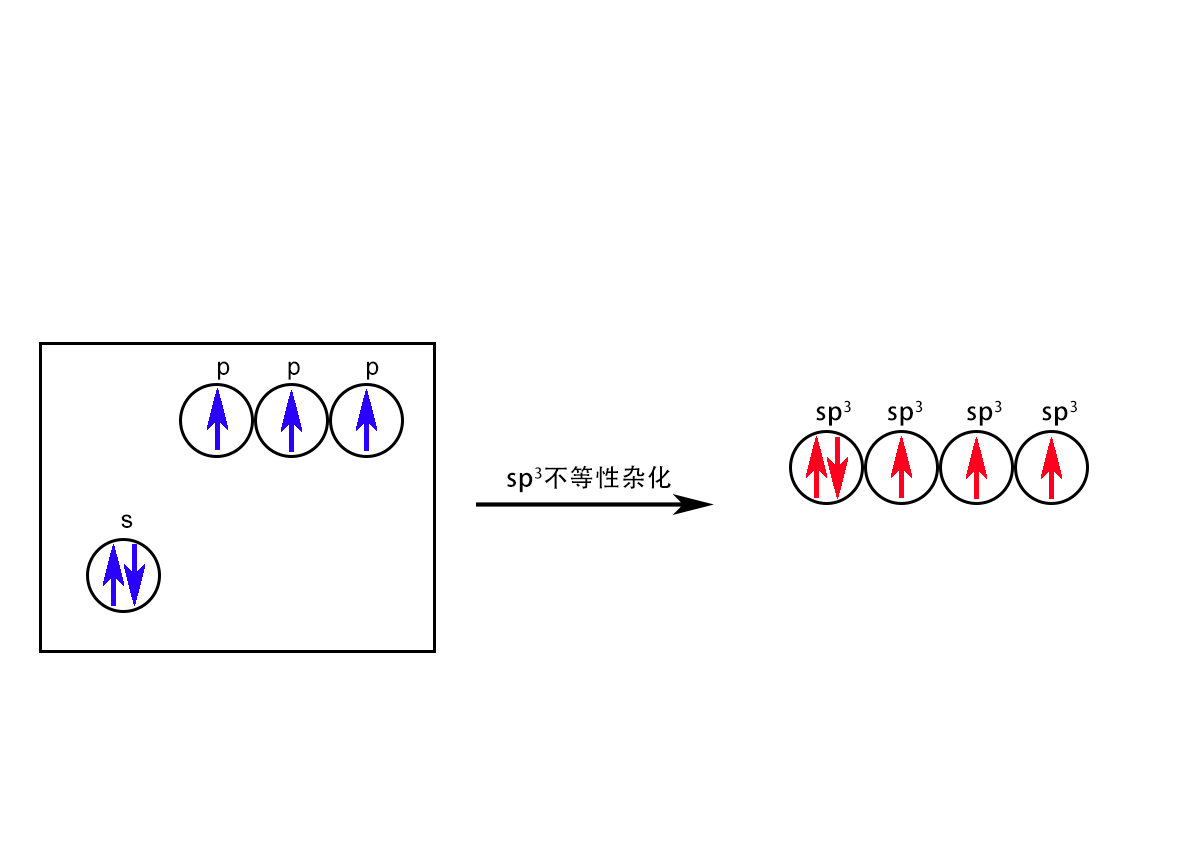
H2O中的sp3不等性杂化
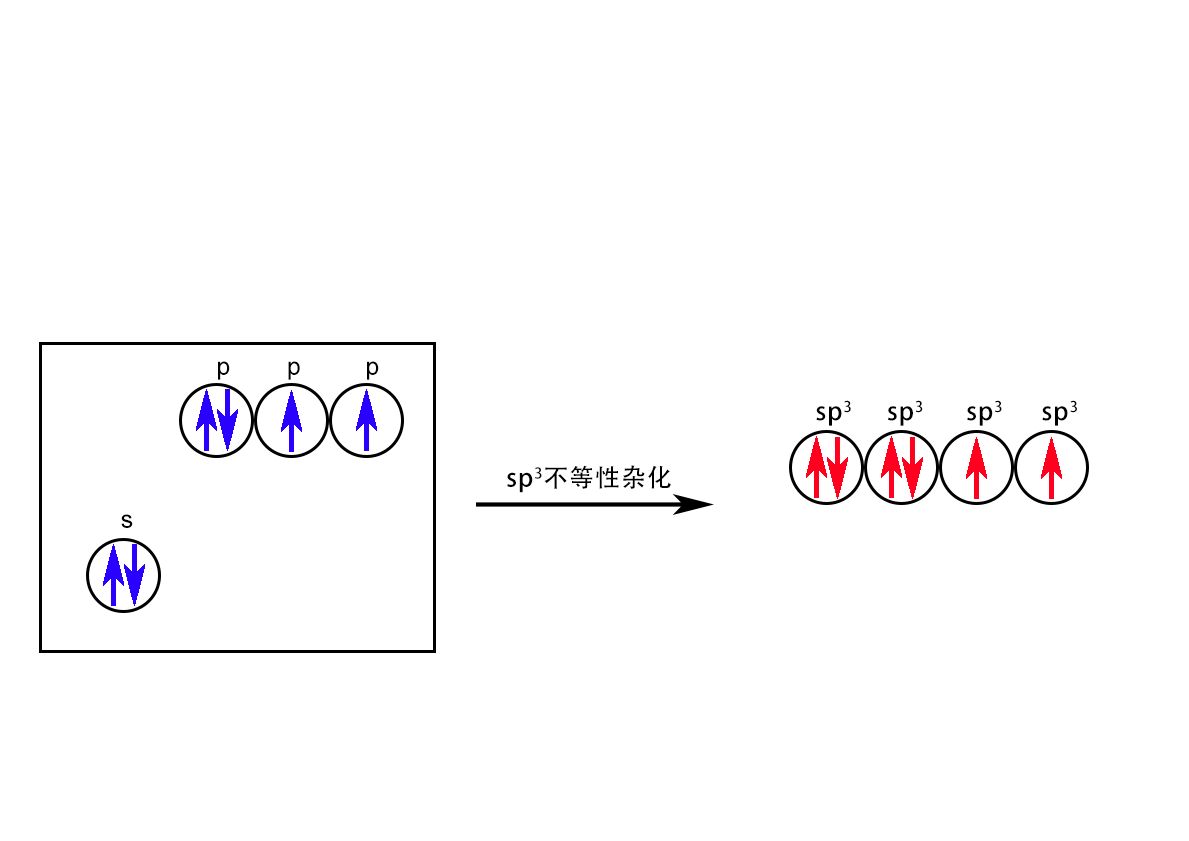
3-12 顺磁性和反磁性:按分子轨道理论,一个原子或分子中所有的电子都成对了,此时分子和原子表现为反磁性,在磁场中运动方向不会受影响。存在未成对电子,表现出的是顺磁性。
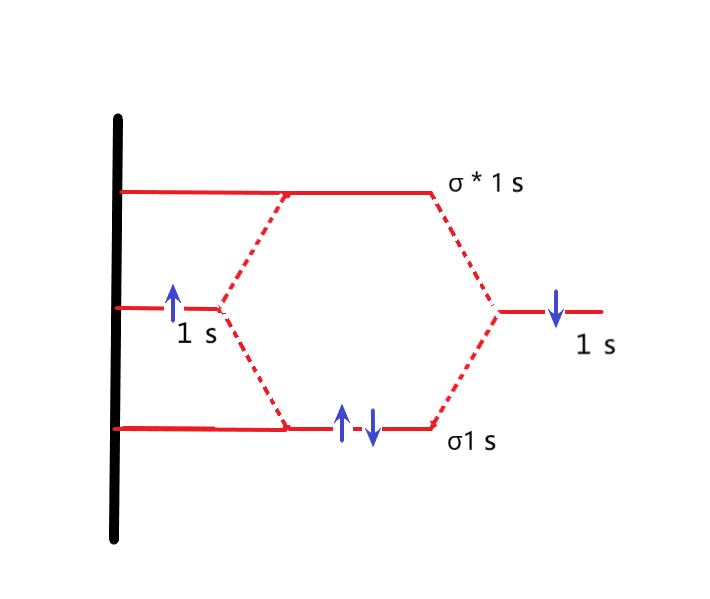
3-13 成键轨道和反键轨道:在形成分子时,二个轨道进行线性组合。二个轨道线性组合后的分子轨道数与组合前各原子的电子轨道数之和相等;原子的二个轨道线性性组合成两个分子轨道,分别表示为σ和σ*。其中σ比原来自由原子的轨道的能量低,叫做〝成键轨道〞;而σ*轨道比原来自由原子的轨道的能量高,叫做〝反键轨道〞。

3-14 键级和分子轨道式:分子轨道式是将分子轨道按能级从小到大、从左到右排成一行,并把每个轨道上的电子数写在轨道符号的右上角。
用〝键级〞定量地表示分子的稳定性: 键级=(n-n*)/2
式中,n为处于成键轨道上的电子总数;n*为处于反键轨道上的电子总数,(n-n*)也称为净成键电子数。键级等于净成键电子数除以2,其就相当于价键理论中的一对共用电子,也就是一根共价键。键级越高,相当于分子中形成的共价键数目越多,分子就越稳定。