6-4 质子条件:在平衡状态,溶液中各种酸失去质子的总数目等于各种碱得到质子的总数目,质子条件体现出酸碱反应中质子转移的守恒,是水溶液酸碱计算的基础条件。直接书写纸自调节要注意:1、选定零水准 因为酸碱是相对的,必须建立一个参照标准物,称为零水平物,往往将电解质的初始状态作为零水平,溶剂水分子也应为零水平物,且为两性物质考虑。2、将零水准得质子后的产物写在等式的左边,失质子后的产物写在等式的右边。根据得失质子的物质的量相等的原则,写出PBE(得到或失去n个质子,要相应的乘以n)。
质子条件: [ H+] = [Ac-] +[OH-]
6-5 pH近似计算:
一元弱酸溶液中[H+]的近似计算式: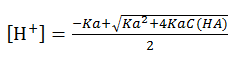 ;
;
最简计算式: 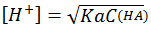 ;
;
两性物质pH值的计算: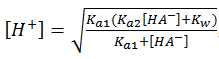
最简式: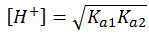
6-6 缓冲溶液:若水溶液的溶质是弱酸(碱)与它的共轭碱(酸)组成,这种溶液叫“pH缓冲溶液”,具有缓冲能力,实验中常用它来维持溶液的pH值。对于弱酸HA及其共轭碱NaA组成的缓冲溶液: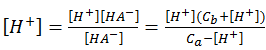
最简式: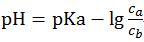
1) 缓冲溶液pH主要由pKa或pKb决定,受酸碱浓度比Ca/Cb影响。
2) 缓冲溶液的缓冲能力是有限的。
3) 缓冲能力与缓冲溶液中各组分的浓度有关,Ca、Cb越大,变化相同pH值,需加入的酸碱越多,即缓冲容量(抗击外加酸碱而引起pH值变化的能力)越大;Ca= Cb时,缓冲能力最强,即pH随加入酸碱的变化程度最小,此时溶液 pH = pKa
