3-1 化学键的分类:化学键是一种存在于分子内的强烈的作用力。由于这种强烈的作用力,使得分子中的各个原子能够克服彼此核外电子及彼此原子核之间随距离接近而急剧增加的排斥力,把原子紧密地维系在一起。按照分子内的强烈作用力形成的机理不同,把化学键分为金属键、离子键和共价键。
3-2 金属键:金属晶体中,金属原子像紧密堆积的球体一样,有规律地聚积在一起。由于金属元素的电负性较小,原子核对核外电子的吸引力较弱,因此价层电子容易脱落下来,以自由电子的形式分布在整个晶体中。自由电子与每一个金属原子或金属正离子之间的静电作用力,就是维系整个晶体稳定存在的所谓〝金属键〞。可见金属键并不是具体存在的一根根可数的、能单独表示的化学键。而是金属晶体内部自由电子与所有金属原子和离子作用力的总和。
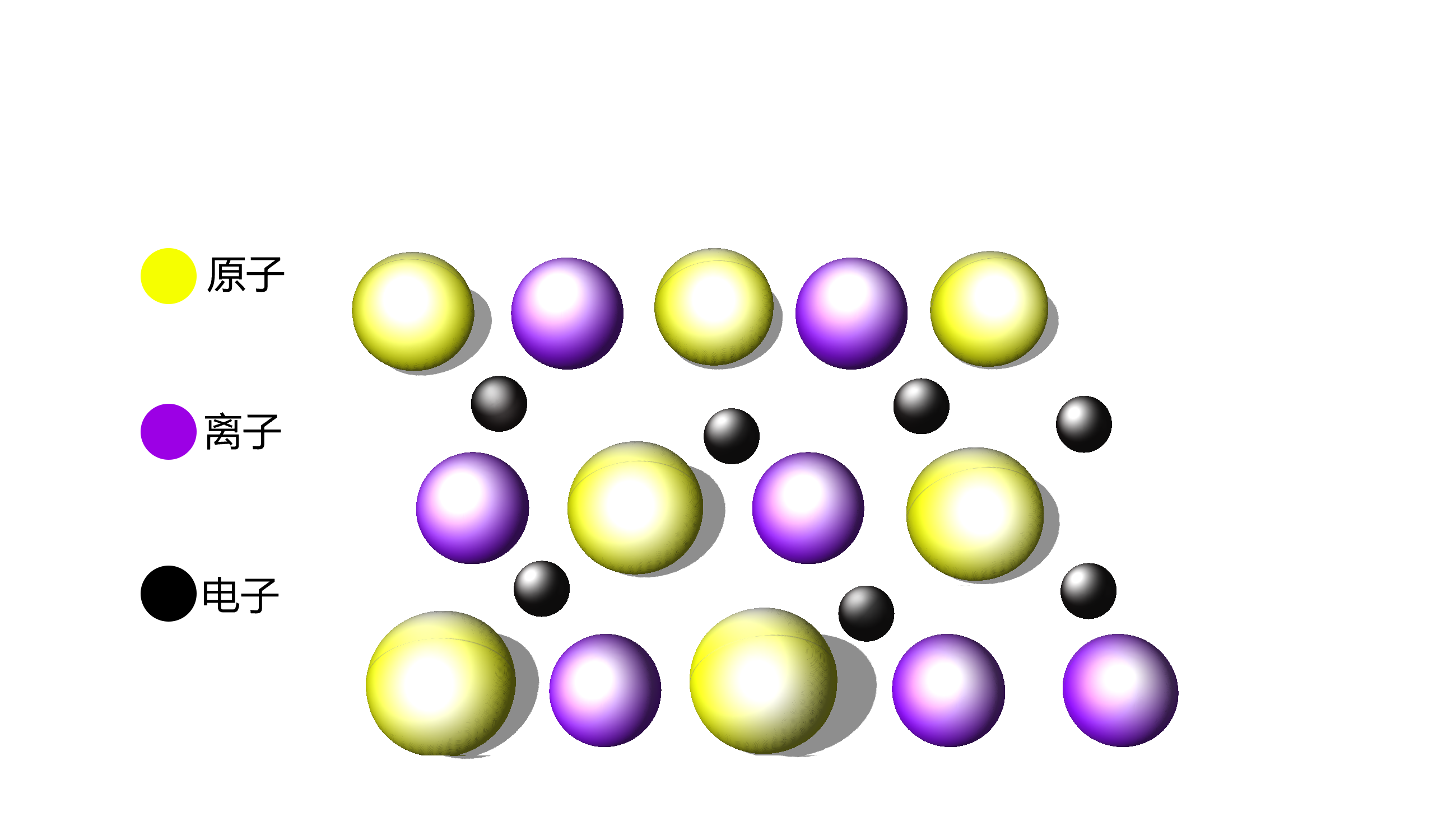
3-3 能带理论:量子力学从物质结构与物质性质的关联性方面更好地揭示了金属中自由电子运动时能量的变化情况,提出了导电性的〝能带理论〞。该理论认为,在一个〝大分子〞中各原子的核外电子不再是属于某一个具体原子核所有,而是属于整个晶体的〝大分子〞所有。描绘这些电子的能级就不再用单个原子的原子轨道,而要用〝大分子〞的分子轨道。
在金属晶体里,原子的数目n趋向于无穷大,可以把这些轨道看成是能量连续的一条能带。形成的分子能带上的电子是充满的,这样一条充满电子的能带叫做〝满带〞。电子非全满、电子能在其中自由运动的能带称为〝导带〞。能级相差很小,它们之间会有部分的重叠,满带上能量较低的电子很容易就跃迁到空带上能量较高的位置,形成了电子的自由运动。两个能级相近的能带的重叠也能组成一个〝导带〞。两个能带之间的区域叫做禁带。因为电子不可能具有与之对应的能量级。对于导体而言,或者有半满的能带,或者满带与空带有重叠,都可形成导带,使得电子可以自由地运动,很容易导电。
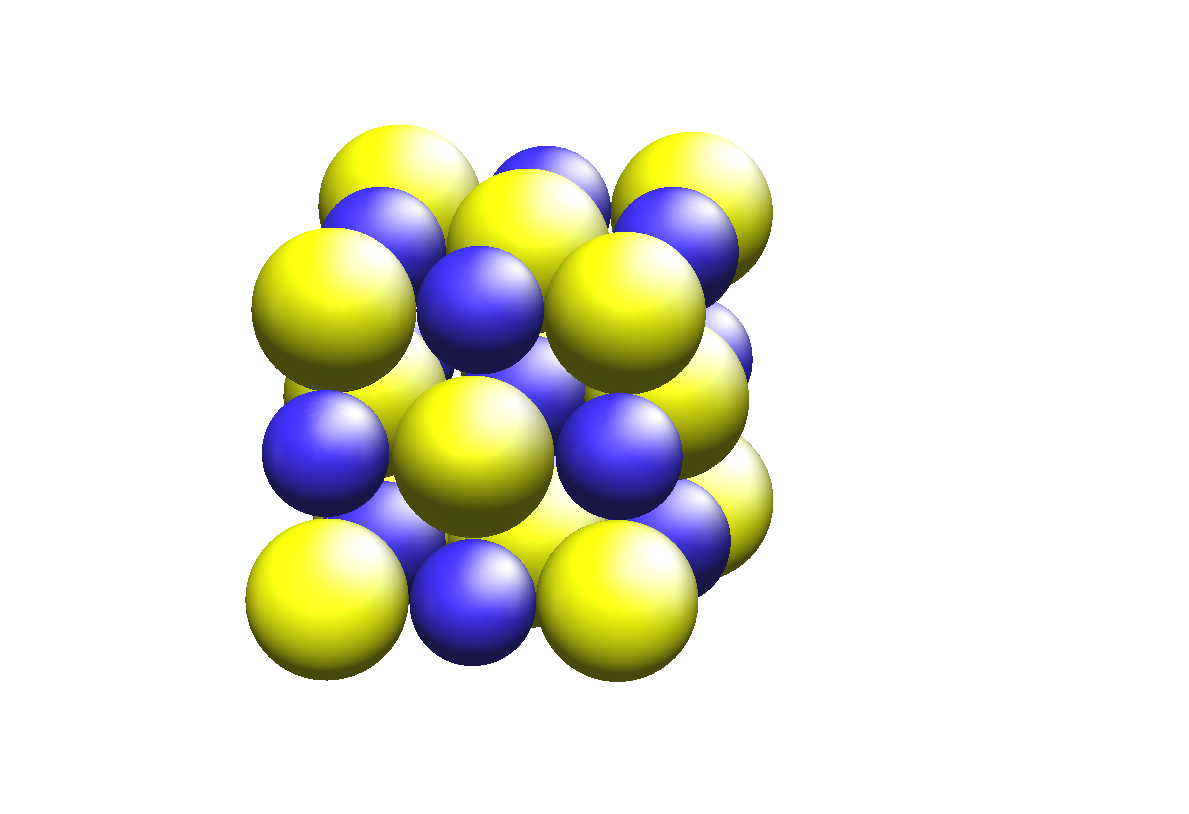
3-4 离子键:当两种元素之间电负性相差较大时,两种元素的原子相遇,电负性较小的原子会失去价电子,形成带正电荷的阳离子;电负性较大的原子会得到相应的电子,形成带负电荷的阴离子。阳离子和阴离子靠静电吸引力而结合在一起,这种靠静电吸引力而结合在一起的化学键称为〝离子键〞,形成的化合物叫〝离子化合物〞,形成的化合物晶体叫〝离子晶体〞。
3-5 共价键:当不同元素的原子之间电负性差值不大,或者是同种元素原子间,价电子就不能在原子之间完全转移,而往往会形成电子对共用的情况。这种依靠电子对共用而形成分子的化学键称为共价键。

3-6 饱和性与方向性:共价键与离子键、金属键一个显著的不同点在于,共价键不是分子内静电作用力的总称,而是具体存在的一对对共用电子对即一根根确定的化学键。共价键是靠〝共同电子对〞形成的。每个原子的价层电子数是有限的,因而原子可形成的共用电子对的数量也是有限的。任何原子能形成〝共同电子对〞或共价键的数目≤价层电子数。这就是共价键的〝饱和性〞。
由于共价键具体存在着一对对共用电子,即是一根根具体存在的化学键。因此存在一个空间上作用力如何取向的问题。若两原子不是同一种元素,则电负性存在差异,共用电子对一定更靠近电负性较大的原子。使电负性较大的原子带一定数量的负电荷,另一个原子则带有数量相等的正电荷。两个原子之间的作用力是沿着共价键的轴方向的。一般规定,作用力方向是从带正电荷的原子指向带负电荷的原子,即共价键的〝方向性〞。
3-7 共价键的键参数:共价键是一根根具体存在的化学键,可以用一些参数来定量地表征共价键,统称为共价键参数。主要的共价键参数有键能、键长和键角。
键能是共价键的稳固程度的表征,单位是kJ·mol-1。它表示将1mol共价键拆散所需要的能量。共价键的键能越大,拆散该键需要的能量越大,显示该键结合得越牢固,分子越稳定。共价键的键长是指形成共价键的两个相邻原子的原子核之间的平均距离。在多原子分子中,一个原子如果形成两根或者两根以上的共价键,这些共价键之间在空间存在着一定的夹角,这种夹角称为键角。
3-8 共价键的极性:如果形成共价键的两个原子的电负性不同,对电子吸引能力存在差异,会造成共用电子对的偏移,从而造成共价键的极性。比如HCl分子中,Cl原子电负性要大于H原子,所以共用电子对偏向于Cl原子,使Cl原子上带一定的负电荷,H原子上带一定的正电荷,这就是共价键的极性。
凡是两个不同的元素原子之间形成共价键,这种共价键一定是极性的。而Cl2分子中,二个Cl原子电负性相同,共用电子对不会向任何一个Cl原子偏移,共价键是非极性的。分子的极性的大小也用偶极矩μ表征。偶极矩越大,分子极性越强,反之亦然。
3-9 分子空间构型:分子的空间构型指的是多原子分子中原子通过具有方向性的共价键结合,在空间排列取向形成的抽象几何体。
对于形如AXn型的多原子分子,可以通过中心原子A最外层(价层)上电子对的情况来判断空间构型。首先判断A价层上的电子的总数,成键的共用电子,两个一对叫做成键电子对,剩下的非成键电子称为孤对电子,两个一对叫做孤电子对,这些电子对之间存在斥力,因此在空间需要分布均匀,伸展向不同的方向,使夹角最大化。最后孤对电子不显形,剩下的成键电子通过形成共价键与外围原子相连,形成了分子结构。
这样一种经验理论称为价层电子对互斥理论,简称VSEPR理论。VSEPR理论的内核是杂化轨道理论。
AX2直线型

AX3平面三角形

AX4正四面体

AX5三角双锥

AX6正八面体












