案例:
“反应停”事件
1961年,德国医生在妇产科会议上报告了一些海豚儿的病例。通过调查,证明这些畸形与患者母亲在怀孕期服用“反应停”有关,这就是震惊世界的“反应停”事件,受害者超过15000人,涉及17个国家。而美国是少数几个幸免于难的发达国家之一。其实美国在1960年就有制药公司申请反应停上市,当时美国FDA官员凯尔西博士审查发现,该药缺乏足够的临床试验资料,于是坚持向该公司要求更多的研究数据,否则拒绝其上市。由于凯尔西博士的坚持,这场灾难没有波及美国,但在美国却引起了公众对药品监督和注册的普遍重视,更加严格了药品注册审批。
讨论:
怎么样在药品注册过程中严格要求,保证药品上市后的安全性呢?
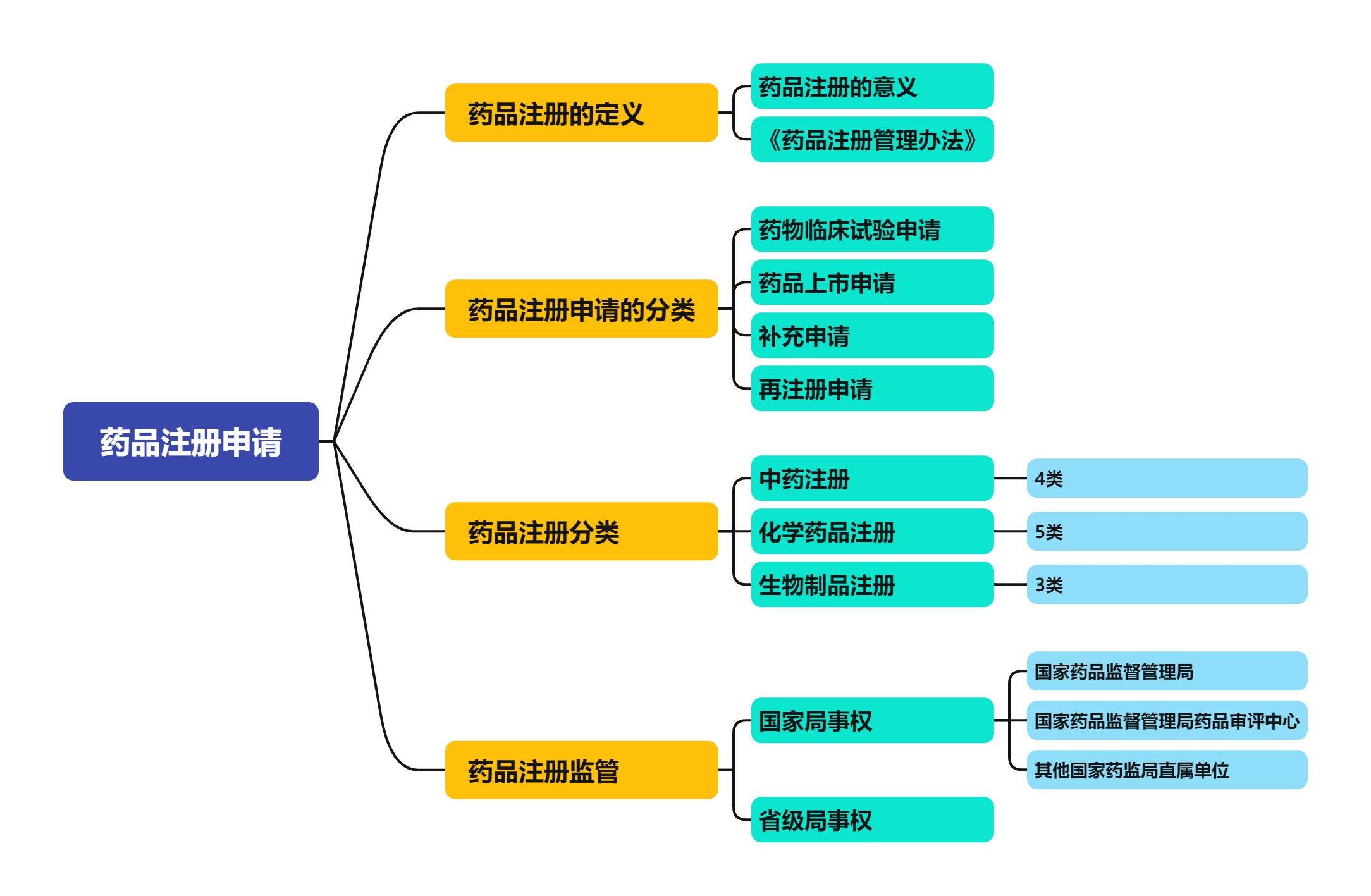
药品注册时又有哪些相关规定呢?
案例分析:
药品注册管理方法对于新药的要求主要包括以下几个方面:
1. 药物质量:新药在注册前需要进行全面的质量评价,确保其符合相关药典标准。药物的物理化学性质、纯度、稳定性等指标必须符合规定要求,以保证药物的有效性和安全性。
2. 生产工艺:药品注册要求提交详细的生产工艺流程和质量控制标准。生产工艺必须规范合理,确保药物的质量和稳定性。同时,也需要提供相关设备、场地等的验证和合规性资料。
3. 临床试验数据:新药注册需要提供充分的临床试验数据,以证明药物的疗效和安全性。临床试验应符合伦理道德要求,采用科学合理的研究设计和方法,确保数据的可靠性和可解释性。
4. 药物标签和说明书:药品注册要求提交药物标签和说明书,以确保患者和医生正确使用药物。标签和说明书应包含准确的药物信息、用法用量、不良反应、禁忌症等内容,以便患者和医生能够正确理解和使用药物。
5. 监测和汇报:药品注册后,需要进行监测和汇报,追踪药物的疗效和安全性。药品注册持有人应及时向监管部门报告药物的不良反应和质量问题,并配合进行必要的调查和处理。
总之,药品注册管理方法对于新药的要求是多方面的,旨在保证药物的质量、安全性和疗效。只有符合相关要求,药品才能获得注册批准,上市供应,以更好地服务于患者的健康需求。