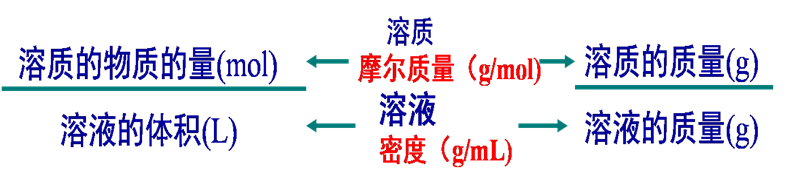
几种常见溶液的配制
教学内容
配制一定百分比浓度的溶液和摩尔浓度的溶液。
5%硫酸亚铁溶液50克
1mol/L硫酸溶液100毫升
掌握实验过程中的操作要点。
基本概念
百分比浓度溶液
质量分数(ω):溶质B的质量和溶液的质量之比。
物质的量浓度溶液
物质的量浓度():单位体积溶液里所含溶质B的物质的量,常用单位为mol/L。
溶液中溶质的质量分数与物质的量浓度的换算
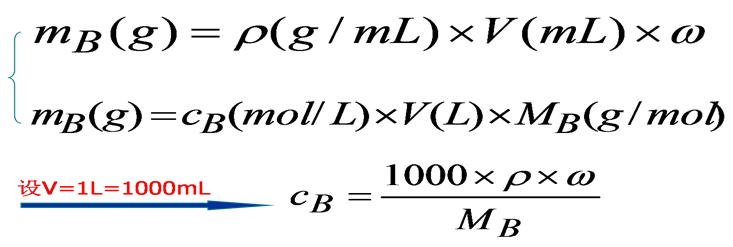
标准操作
试剂的取用
中学中化学药品的取用有“三不准”原则:
(1) 不准用手接触药品;
(2) 不准用口尝药品味道;
(3) 不准把鼻孔凑到容器口去闻气味。
在取用化学药品时,先看清楚标签,确认是所需的药品,然后打开瓶塞,瓶塞应倒放在实验台上,防止瓶塞玷污。取完药品后,盖紧瓶塞,把试剂放回原处。已经取出或用剩后的药品不能再倒回原试剂瓶,应回收实验室中的废弃处理。
固体药品的取用
取用固体药品要用洁净、干燥的药匙。药匙应专用,如用同一药匙取不同的药品应洗净擦干后再使用。当用镊子取用块状固体时,先把容器横放,把药品放入容器口,再把容器慢慢地竖立起来,以免打破容器底部;当取用粉末状或颗粒状的药品时要用药匙或药槽,先将容器横放,把盛药品的药匙或纸槽小心的送人容器底部,再使容器直立。
液体药品的取用
取用少量液体药品时可用胶头滴管。从滴瓶中取用液体药品,要用滴瓶中的滴管,滴管中的滴瓶,滴管决不能深入所用的容器中,应在容器口上方0.5cm左右处,防止滴管接触容器壁被玷污。装有药品的滴管不得横置或管口向上斜放,以防液体药品流入滴管的胶状乳头中。取用较多量的液体药品入试管时,可直接从试剂瓶倾倒,应注意标签向着手心,并且倾斜式管,使瓶口紧挨着试管口,防止试剂污染或腐蚀标签。定量取用液体药品可使用量筒、量杯或移液管等液体计量仪器。量取液体时,视线应与量具内液体的凹液面的最低处保持水平,偏高或者偏低都会造成读数不准确,产生较大误差。
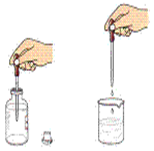
称量仪器的使用
中学化学实验中最常用的质量测量仪器是托盘天平和电子天平。其中托盘天平用于精确度不高的称量,电子天平用于精确度要求较高的称量。
托盘天平
托盘天平由托盘、指针、衡量、平衡螺母、刻度尺、刀口、底座、标尺游码、砝码等组成。托盘天平的规格根据其量程来划分,实验室内常见为200g,其精确度由衡量标尺来决定,衡量标尺的量程为5g时,最小分度值为0.1g,衡量标尺的量程为10g时,分度值为0.2g。读数时可读到小数点最后两位,最后一位是估读数。
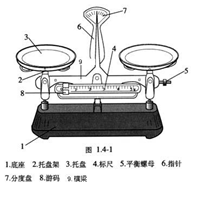
使用方法:使用时,先将托盘天平放在平稳的桌面上。称量前,游码移到零处,然后调整平衡螺母,使指针在平衡时指在零点。左盘放在称量物,右盘放砝码。称量一般药品时,先在左右托盘上各放一张大小相同的纸,药品放在纸上称量。潮湿或者有腐蚀性的药品,必须放在表面皿或小烧杯中进行称量。天平不能用来称量过冷过热的物质。称量物的重量在衡量标尺的量程以内的,可通过移动游码来实现;称量物在衡量标尺的量程范围以外,则将砝码添加在盘内,称量物的质量=砝码的质量+游码的读数。称量完毕后,把砝码放回盒内,游码归到零处。每架天平都有配套的砝码,不能混用。天平要保持清洁干燥。
电子天平
电子天平由载物台、LED显示器、防风罩以及内部的微计算机、传感器等组成。使用的时候,将被测物质放在载物台上,LED显示屏上就会显示物质的质量,使用十分方便。电子天平因为测量的精确度比较高,所以也叫电子分析天平。电子分析天平可以读到小数点后4位,中学化学实验室的电子天平一般是读到小数点后3位。

使用方法:使用前先打开天平防风门,用毛刷将天平打扫干净,接通电源并预热使天平处于备用状态。打开天平开关,使天平处于零位,否则按去皮键清零,使LED显示屏的读数为0.0000。放上器皿,可读取数值并记录,通常可再用手按去皮键清零,使天平重新显示为零。在器皿内加入样品至显示所需重量值,记录读数,如有打印机可按打印键完成。将器皿连同样品一起拿出。用手刷将天平打扫干净,按天平去皮键清零,关好天平防风门,已被再用。
实验步骤
配制50克5%硫酸亚铁溶液的步骤:
(1)计算求算出配制50克5%的硫酸亚铁溶液需绿矾和水多少克。
(2)称量 4.57克绿矾和45.43毫升蒸馏水。
(3)溶解用量筒量取45.43毫升蒸馏水注入100毫升的烧杯内,在将前面称得的4.57克绿矾加入,用玻璃棒搅拌,使其溶解,即得50克5%硫酸亚铁溶液。
配制100毫升1mol/L硫酸溶液的步骤:
(1)计算求算出配制100毫升1mol/L硫酸溶液需浓硫酸的体积。
(2)称量用10毫升的量筒量取所需的浓硫酸。
(3)溶解在80毫升的小烧杯中倒入一些水,用玻璃棒将浓硫酸缓慢引流之水中,不断搅拌。
(4)转移将硫酸溶液转移至100毫升容量瓶中。
(5)定溶往容量瓶中加蒸馏水至离刻度1到2厘米处,改用胶头滴管至刻度线。
(6)摇匀。按住容量品瓶瓶塞颠倒摇匀,反复进行三次。
内容拓展
标准溶液的配制
正确配制、合理使用溶液是实验成功的关键之一。所谓正确配制是指:溶液配制中,要试溶液在使用精度上的要求、试剂的性质,合理选用试剂级别、预处理方法、称量方法、配制量器和配制时的操作过程以及溶液的存储和管理方法。合理使用指:要按具体实验的要求合理选择选择使用溶液,需要准确配制的必须准确配制。
直接配制各种浓度的溶液
用分析天平准确称取一定量的基准试剂,溶于适量的水中,再定量转移到容量瓶中,用水稀释至刻度。根据称取试剂的质量和容量瓶的体积,计算它的准确浓度。
基准物质是纯度很高,组成一定、性质稳定的试剂,它是相当于或高于优级纯试剂的纯度。基准物质可用于直接配制标准溶液或用于标定溶液浓度的物质。而作为基准物质试剂应具备下列条件:
(1) 试剂的组成与其化学式完全相符;
(2) 试剂的纯度应足够高(一般要求纯度在99.9%以上),而杂质的含量应少到不至于影响分析的准确度;
(3) 试剂在通常条件下应该稳定;
(4) 试剂参加反应时,应按反应式定量进行,没有副反应。
间接配制(标定法)准确浓度的溶液
实际上只有少数试剂符合及著名试剂的要求,很多试剂不宜用直接法配制标准溶液,而要用间接的方法,即标定法。这种溶液的配制方法适用于溶质本身性质不稳定或组成易变,无法用直接配置法配制其准确浓度的溶液。这种配制的溶液,需用已知准确浓度的标准溶液或基准物质标定出其准确浓度。
配制物质的量浓度溶液误差分析
| 可能引起误差的操作 | m(n) | V | C(mol·L-1) |
| 药品、砝码位置左右颠倒(使用了游码) | 减小 | 不变 | 偏小 |
| 称量易潮解的物质(如NaOH)时间过长 | 减小 | 不变 | 偏小 |
| 溶质中含有杂质 | 减小 | 不变 | 偏小 |
| 用量筒量取液体(此处液体指溶质为液体,下同)时仰视读数 | 增大 | 不变 | 偏大 |
| 用量筒量取液体时俯视读数 | 减小 | 不变 | 偏小 |
| 溶解前烧杯内有水 | 不变 | 不变 | 无影响 |
| 搅拌时不妨液体溅出或向容量瓶转移液体时有少量液体流出 | 减小 | 不变 | 减小 |
| 未洗涤烧杯和玻璃棒 | 减小 | 不变 | 减小 |
| 未冷却至室温就注入容量瓶 | 不变 | 减小 | 偏大 |
| 定容时,水加多了,用滴管吸出 | 减小 | 不变 | 偏小 |
| 定容摇匀后,发现液面下降,再加水 | 不变 | 增大 | 偏小 |
| 定容时,仰视刻度线 | 不变 | 增大 | 偏小 |
| 定容时,俯视刻度线 | 不变 | 减小 | 偏大 |


