-
1 内容
-
2 测验4.4
一、教学目标
1.了解蛋白质对生物体的重要意义;
2.蛋白质的分类,掌握蛋白质元素组成的特点;
3.掌握氨基酸的结构特点及理化性质;
4.蛋白质一、二、三、四级结构的概念及稳定因素;
5.理解蛋白质结构与功能的关系;
6.掌握蛋白质的理化性质以及这些性质的生理意义及实践意义;
7.了解蛋白质分离提纯常用方法及基本原理。
二、教学重点
1.氨基酸的结构特点及理化性质
2.蛋白质一级结构的概念
3.蛋白质二级结构的概念
4.掌握蛋白质的理化性质以及这些性质的生理意义及实践意义
三、教学难点
1.氨基酸的结构和理化性质
2.蛋白质的结构和功能的关系
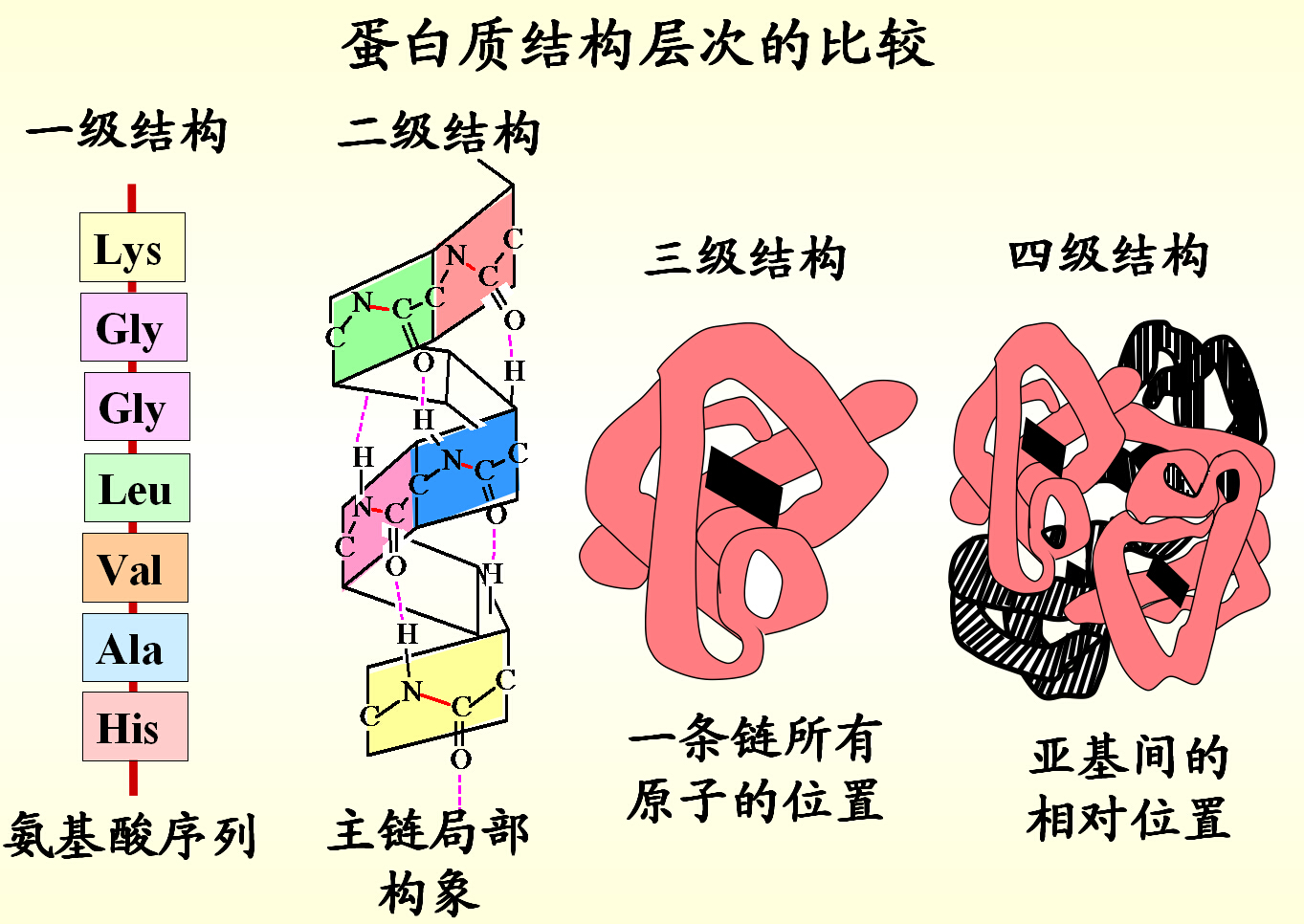
蛋白质的分子结构
一、蛋白质的一级结构
主要的化学键—肽键,有些蛋白质还包括二硫键
二、蛋白质的二级结构
蛋白质分子中某一段肽链的局部空间结构,即该段肽链主链骨架原子的相对空间位置,不涉及氨基酸残基侧链的构象 。
二级结构的主要化学键—氢键
二级结构的基本单位—肽单元
(一)二级结构的基础—肽单元

对肽单元的说明:
(1)Ca1、C、O、N、H、Ca2 6个原子在同一平面,称为肽键平面。
(2)Ca1和Ca2为反式(trans)构型,O和H也是反式构型。
(3)0.127 nm <肽键<0.149 nm,键长0.132nm,部分双键性质,不能自由旋转。
(4)Cα与羰基Co和N相连的单键能自由旋转,角度为ψ 、 j ,该旋转角度决定了相邻2肽单元的相对空间位置。
(二)蛋白质二级结构的主要形式

1、a-螺旋 ( a -helix )
a-螺旋结构要点:①外观:右手螺旋(顺)。②螺距:3.6个氨基酸、0.54nm。③维持因素:氢键。④R基团的位置:螺旋外侧,R基团影响a-螺旋的形成。
2、β-折叠 (β-pleated sheet )
β-折叠结构要点:①肽段折纸状、锯齿状,相对伸展。②几个肽段顺向平行、反向平行0.70nm。③维持因素:氢键。④R基团的位置:锯齿的上下方。
3、β-转角和无规卷曲
β-转角结构要点:
(1)4个氨基酸残基
(2)第二个常为脯氨酸
(3)180°回折
(4)氢键维持
无规卷曲:无确定规律性的肽段的结构
4、模体(motif)

(三)氨基酸侧链基团R对二级结构的影响
(1)R基团的电荷
(2)R基团的大小
(3)R基团的形状
三、蛋白质的三级结构
(一)三维空间的位置排布
维持蛋白质分子构象的各种化学键:氢键;离子键;疏水键

(二)结构域
三级结构中、分割成折叠较为紧密的区域,各行使其功能。
(三)分子伴侣(chaperon)
四、蛋白质的四级结构(quaternary structure)
四级结构—各亚基的空间排布,亚基间相互作用关系
亚基 (subunit)—四级结构中每条具有完整三级结构的多肽链
维持因素—离子键、氢键不包括共价键
五、蛋白质的分类



