-
1 内容
-
2 测验2.2
一、教学目标
1.学生应掌握典型单糖的结构和性质;
2.学会比较、分析的方法去认识各种重要糖类的特征;
3.在学习单糖的结构和性质时要联系有机化学中醛、酮的化学性质。
二、教学重点
1. 糖的概念、分类
2.了解糖的分类,单糖、寡糖及多糖的结构特点及重要的性质。
3. 掌握单糖、重要多糖的结构与功能。
三、教学难点
单糖的化学结构和性质以、多糖的组成结构和重要性质。
一、单糖的结构
(一)单糖的链状结构:以葡萄糖为例
1、确定链状结构的方法(葡萄糖):C6H12O6+(CH3CO)2O→C6H7O6(COCH3)5
(1)羟基:葡萄糖分子内有5个羟基
(2)醛基:与Fehling试剂或其它醛试剂反应,含有醛基。
(3)被弄HNO3氧化生成糖二酸(二羧酸)。
(4)被钠汞齐(钠和汞的合金)和HI还原生成正己烷。
2、单糖的链状结构有醛糖和酮糖之分,用下列通式表示醛糖和酮糖。

3、单糖的构型(configuration)
单糖有D型、L型两种异构体,判断方法以甘油醛(D-Glyceraldehyde,L- Glyceraldehyde)作标准。
将单糖分子中离羰基最远的不对称碳原子上的-OH的空间排布与甘油醛作比较,若与D-甘油醛相同,即羟基在不对称碳原子右边的为D-型,若与L-甘油醛相同,即羟基在不对称碳原子左边的为L-型。D-型和L-型单糖互为对映体。
将甘油醛分子作成立体模型,如图。

(二)单糖的环状结构
链状结构不是单糖的唯一结构。在溶液中,含有4个以上碳原子的单糖以环状结构为主。
1、单糖的链状结构不能解释以下性质:
(1)单糖是多羟醛,应显示醛的性质,但葡萄糖的醛基不能和NaHSO3反应,也不能和Schiff试剂反应,说明葡萄糖的醛基不如一般醛基活泼。
(2)1分子葡萄糖只能与1分子甲醇结合成甲基葡萄糖而不能如一般醛类分子能与2分子甲醇作用形成缩醛。
(3)葡萄糖有变旋现象
一般醛类在水溶液中只有一个比旋光度,但是新配置的葡萄糖水溶液的比旋光度随时间而改变。
2、单糖构型
(1)Fischer式
单糖的链状结构和环状结构实际上是同分异构体。单糖分子中的羟基能与醛基或酮基可逆缩合成环状的半缩醛(emiacetal)。环化后,羰基C就成为一个手性C原子,称为端异构性碳原子(anomeric carbon atom),环化后形成的两种非对映异构体称为端基异构体,或异头物(anomer),分别称为a-型及b-型头异构体。如a-D-葡萄糖和b-D-葡萄糖。

(2)Haworth式
FisCher投影式表示环状结构很不方便,Haworth结构式比Fischer投影式更能正确反映糖分子中的键角和键长度,较准确地反映糖分子的立体构型。
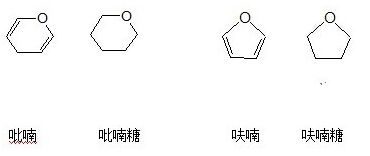
(3)链状、环状互变
单糖的链状、环状可以互变(1-5氧桥的环形糖称为吡喃糖;1-4氧桥的环形糖称为呋喃糖;氧桥-两个碳原子连接):
3.单糖的构象:
构象用来表示一个有机化合物结构中一切原子沿共价键转动而产生的不同空间结构。
构象的改变不涉及共价键的断裂和重新组成,也无光学活性的变化,构象形式有无数种。研究表明,己糖的C-C键都保持正常四面体价键的方向,不在一个平面上,折叠成椅式和
船式两种构象。
几种重要的单糖的链状结构和环状结构
(1) 丙糖:D-甘油醛 二羟丙酮
(2) 丁糖:D-赤鲜糖 D-赤鲜酮糖
(3) 戊糖:D-核糖 D-脱氧核糖 D-核酮糖 D-木糖 D-木酮糖
(4) 己糖:D-葡萄糖(a-型及b型) D-果糖
(5) 庚糖:D-景天庚酮糖
二、单糖的物理化学性质
(一)物理性质
1、构型与构象
(1)构型:
分子中由于各原子或基团间特有的固定的空间排列方式不同而使它呈现出不同的较定的立体结构。一般情况下,构型都比较稳定,一种构型转变另一种构型则要求共价键的断裂、原子(基团)间的重排和新共价键的重新形成。
(2)构象:
由于分子中的某个原子(基团)绕C-C单键自由旋转而形成的不同的暂时性的易变的空间结构形式,不同的构象之间可以相互转变,在各种构象形式中,势能最低、最稳定的构象是优势对象。
2、变旋现象
变旋:一个有旋光性的溶液放置后,其比旋光度改变的现象称变旋。
在溶液中,糖的链状结构和环状结构(a、b)之间可以相互转变,最后达到一个动态平衡,三者间的比例因糖种类而异。
3、构型与旋光性
(1)旋光性
旋光性是分子中具有不对称结构的物质的一种物理性质。一切单糖都含有不对称原子,所以都有旋光的能力,能使偏振光的平面向左或向右旋转。旋光性是鉴定糖的一个重要指标,用比旋光度来表示。

(2)比旋光度:
一个物质的单位浓度(g/ml)在1dm长旋光管内,20、钠光灯下的旋光读数。与糖的性质、试验温度、光源的波长和溶剂的性质有关。
(3)甜度(sweetness)
单糖有甜度,但甜度大小不同。以蔗糖的甜度为标准,定为100度。各糖甜度的大小次序:
果糖>转化糖>蔗糖>葡萄糖>木糖>鼠李糖>麦芽糖>半乳糖>棉子糖>乳糖
(二)化学性质
单糖的化学性质是与其分子中的功能基团醛基或酮基和醇基密切相关,凡醛基、酮基和醇基能产生的反应,醛糖或酮糖一般也产生。
1、由醛、酮基产生的化学性质

(1)单糖的氧化(即单糖的还原性):
在碱性溶液中,单糖的自由醛基和酮基变成非常活泼的烯二醇,具有还原性,能还原Cu2+、Ag+、Hg2+等金属离子,同时糖被氧化成糖酸及其他产物。

(2)单糖的还原反应
单糖可以被还原成相应的糖醇(Sugar alcohol)。如D-葡萄糖被还原成D-葡萄糖醇,又称山梨醇(D-Sorbitol)。果糖还原后可以得到葡萄醇和甘露醇的混合物,因为其第二碳原子上的H和-OH有两种可能的排列方式。

D-葡萄糖 D-葡萄醇(山梨醇) D-甘露糖 D-甘露醇
(3)单糖的异构化
在弱碱性溶液中,D-葡萄糖、D-甘露糖和D-果糖,可以通过烯醇式相互转化(enediol intermediate)。
(4)发酵作用
单糖经酵母的酿酶的作用产生乙醇和CO2。这一反应称醇发酵。
2、羟基(半缩醛羟基和醇性羟基)产生的性质
醛糖和酮糖具有多羟醇的特性,如成酯、成苷、脱水、脱氧和氨基化等单糖的各个醇基的活泼性不一致,C-1的最活泼,其次末端一级醇基,其他二级的活泼性一般较低。
(1)成酯作用
单糖的一切醇基都可与酸结合成酯。
生物体中最常见也是最重要的糖酯是磷酸糖酯和硫酸糖酯。磷酸糖酯及其衍生物是糖的代谢活性形式(糖代谢的中间产物)。
(2)糖苷化
单糖环状结构上的半缩醛羟基与醇或酚的羟基缩合失水成为缩醛式衍生物,通称为糖苷(glycosides)。
(3)脱水
单糖与强酸(如H2SO4,HCl)作用,单糖脱水生成糠醛或糠醛的衍生物。
糠醛或羟甲基糠醛能与酚类物质作用产生各种有色物质,可用作糖的定性测定。
(4)氨基化
(5)脱氧


