-
1 内容
-
2 测验6.2
一、教学目标
1.认识酶的本质,理解酶的特征、催化作用和催化机制;
2.清楚辅酶的结构并把它与维生素和核苷酸联系起来;
3.结合酶的化学本质和催化机制学习各种影响酶反应速率的因素。
二、教学重点
1.酶的化学本质、结构、特性和功能
2.酶反应动力学
3.酶的应用
三、教学难点
1.米氏方程的推导
2.酶活调节机制
酶的活性中心及其作用机理
一、酶的活性中心
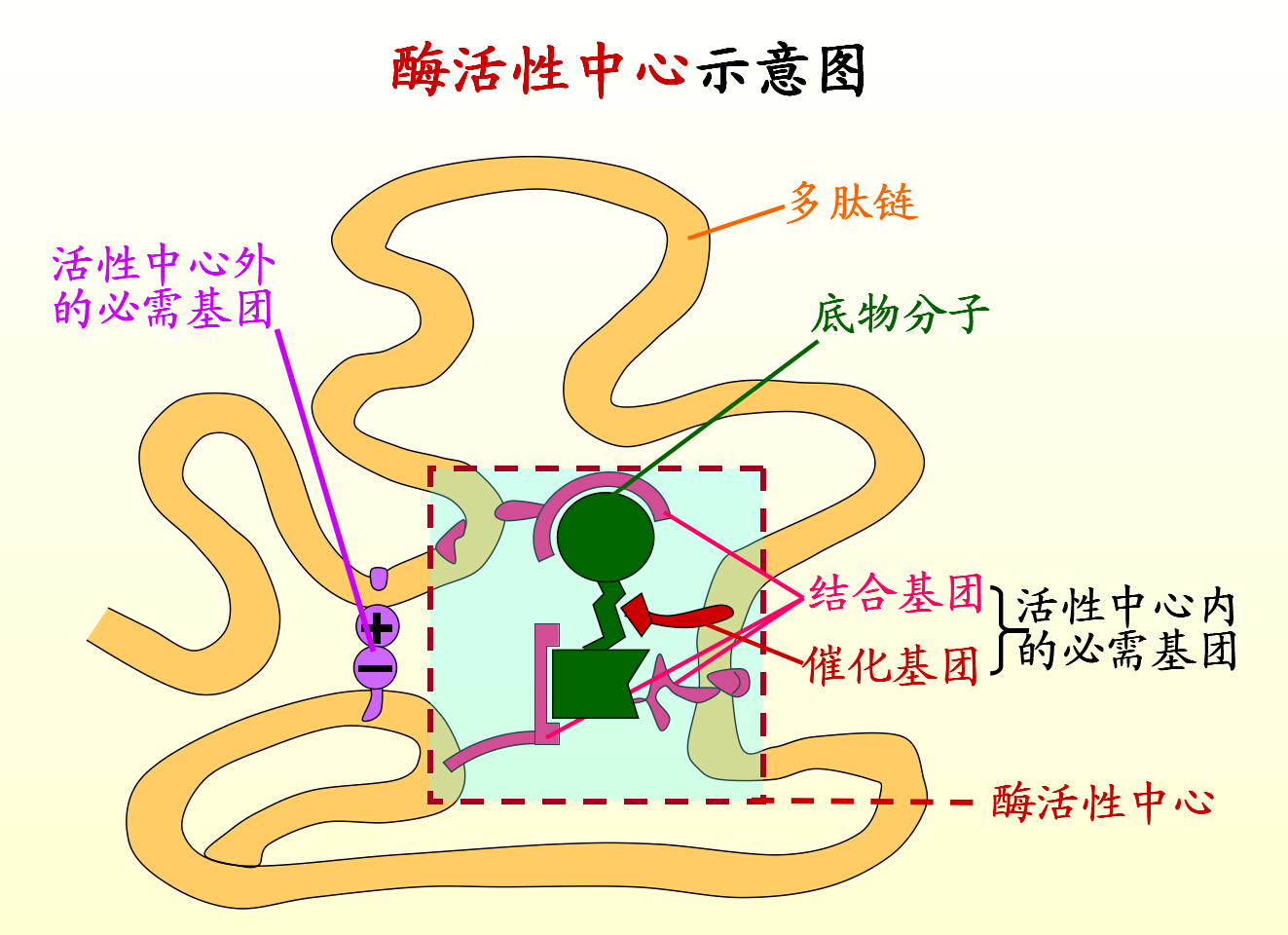
1、活性中心的概念
对于不需要辅酶的酶来说,活性中心就是酶分子在三维结构上比较靠近的少数几个氨基酸残基或是这些残基的某些基团,它们在一级结构上相距可能很远,通过肽链的盘绕、折叠而在空间构象上相互靠近。
对于需要辅酶的酶来说,辅酶分子或辅酶分子的某一部分结构往往就是活性中心的组成部分。
一般认为,活性中心有两个功能部位:底物结合部位,催化部位
活性中心外的部位为活性中心的形成提供了结构基础 。
2、活性中心的氨基酸残基
有七种a.a在酶活性中心出现的频率最高,它们是Ser、His、Cys、Tyr、Asp、Glu、Lys。
活性中心的a.a残基往往分散在相互较远的a.a顺序中,有的甚至分散在不同的肽链上。
(1)接触残基
它们与底物接触,参与底物的化学转变,此类a.a残基的一个或几个原子与底物分子中一个或几个原子的距离都在一个键距离之内(1.5-2A)。
它们的侧链起与底物结合作用的称为结合基团,起催化作用的称为催化基团。
(2)辅助残基
它不与底物接触,而是在使酶与底物结合及协助接触残基发挥作用方面起作用。
(3)结构残基
在维持酶分子正常三维构象方面起重要作用,它们与酶活性相关,但不在酶活性中心范围内,属于酶活性中心以外的必需残基
(4)非贡献残基(非必需基团)
它们对酶活性的显示不起作用,可由其它a.a代替,且在酶分子中占很大比例。
它们可能在免疫,酶活性调节,运输转移,防止降解等方面起作用。
3、活性中心区域的一级结构
由于一些酶的活性中心一级结构结构与催化机理极其相似,可把它们归为一族。
蛋白水解酶就有几个族:
(1)丝氨酸蛋白酶(胰凝乳蛋白酶、胰乳蛋白酶、弹性蛋白酶、枯草杆菌蛋白酶等)
(2)锌蛋白酶(羧肽酶等)
(3)巯基蛋白酶(木瓜蛋白酶等)
(4)羧基蛋白酶(胃蛋白酶等)
4、判断和研究活性中心的主要方法
(1)通过酶的专一性(2)酶的化学修饰法(3)亲合标记法(4)X射线晶体衍射法
酶的作用机理
1、三点结合及锁钥模型(刚性模板学说)
底物结合部位由酶分子表面的凹槽或空穴组成,这是酶的活性中心,它的形状与底物分子形状互补。底物分子或其一部分像钥匙一样,可专一地插入酶活性中心,通过多个结合位点的结合,形成酶—底物复合物,同时酶活性中心的催化基团正好对准底物的有关敏感键,进行催化反应。
三点结合学说指出,底物分子与酶活性中心的基团必须三点都互补匹配,酶才作用于这个底物。
刚性模板学说较好地解释了立体专一性,但不能解释酶专一性中所有的现象,如既能催化正反应,又能催化逆反应;那么,酶的结构不可能既适合于底物又适合于产物。
2、诱导契合模型
酶分子与底物分子接近时,酶蛋白质受底物分子诱导,构象发生有利于与底物结合的变化,酶与底物在此基础上互补楔合,进行反应。
二、高效性的机理
1、邻近效应与定向效应
酶把底物分子(一种或两种)从溶液中富集出来,使它们固定在活性中心附近,反应基团相互邻近,同时使反应基团的分子轨道以正确方位相互交叠,反应易于发生。
两种效应对反应速度的影响
①使底物浓度在活性中心附近很高
②酶对底物分子的电子轨道具有导向作用
③酶使分子间反应转变成分子内反应
④邻近效应和定向效应对底物起固定作用
2、扭曲变形和构象变化的催化效应
酶中某些基团可使底物分子的敏感键中某些基团的电子云密度变化,产生电子张力。
环状反应物I水解开环,环扭曲能量大量释放,加速反应。
底物与酶蛋白接触,加速反应。
①酶从低活性形式转变为高活性形式
②底物扭曲、变形
③底物构象变化,变得更像过度态结构,大大降低活化能。
3、共价催化
酶作为亲核基团或亲电基团,与底物形成一个反应活性很高的共价中间物,此中间物易变成过渡态,反应活化能大大降低,提高反应速度。
①亲核共价催化
丝氨酸羟基、Cys的-SH、His的咪唑基。
②亲电共价催化
亲电基团攻击底物的富电子基团
4、酸碱催化
酶分子的一些功能基团起质子供体或质子受体的作用。
参与酸碱催化的基团:氨基、羧基、巯基、酚羟基、咪唑基。
影响酸碱催化反应速度的两个因素
⑴酸碱强度,咪唑基在pH6附近给出质子和结合质子能力相同,是最活泼的催化基团。
⑵给出质子或结合质子的速度,咪唑基最快
①酸催化酯、酰胺和肽的水解
过程:共轭酸与>C=0氧形成氢键,使>C=0碳带更多正电荷,更易吸引H2O分子上的氧,降低>C=0碳与H2O氧形成共价键的活化能;接着,共轭酸将H+转移给>C=0氧,自己成为共轭碱,并从H2O分子吸引一个H+, 回复原状。
②碱催化酯、酰胺水解
过程:共轭碱先与H2O中H形成氢键,使H2O中氧的电负性增强,更易对>C=0碳进行亲核进攻,降低碳氧键生成的活化能。
5、活性中心的微环境
⑴ 疏水环境
酶活性中心附近往往是疏水的,介电常数低,可加强极性基团间的反应。
⑵电荷环境
在酶活性中心附近,往往有一电荷离子,可稳定过渡态的离子,增加酶促反应速度。如溶菌酶Asp52带负电荷,可以稳定过渡态的正离子。
酶催化反应的高效性,可能是由于以上五种因素中的几种因素协同作用的结果,而非酶催化反应往往只有一种催化机制。
酶作用机理举例
胰凝乳蛋白酶的作用机理:
(1)专一性
该酶需要底物有一个疏水基团结合于酶上的疏水部位,这个结合起定位作用,使底物敏感键对准酶的催化基团。
疏水定位基团:Phe、Tyr、Trp
(2)催化机理
① 活性中心:Ser195—His57—Asp102,三者构成一个氢键体系,His57的咪唑基是Ser195的羟基和Asp102的羧基之间的桥梁,这个氢键体系称为电荷中继网(harge relay network)。通过电荷中继网,进行酸碱催化及共价催化。Ser195由于His57和Asp102的影响而成为很强的亲核基团,它是活性中心的底物结合部位,His57是活性中心的催化部位。
② 胰凝乳蛋白酶对多肽的水解过程
第一阶段 酰化
Ser195--OH 中的氧攻击肽键的羰基碳,形成四联体过渡态(Ser195—OH、底物的酰基、底物的氨基、His的咪唑),敏感肽键断裂,底物中的胺成分通过氢键与酶的His57咪唑基相连,底物的羧基部分酯化到Ser195的羟基上。
第二阶段 脱酰
电荷中继网从水中吸收一个质子,结果产生的OH-攻击连在Ser195上底物的羧基碳原子,形成四联体过渡态,然后His57供出一个质子给Ser195上的氧原子,结果底物中的酸成分从Ser195上释放。



