6.7 其他天然的植物生长物质
在植物体内除了上述五大激素外,随着研究的深入,发现还存在着多种其他微量的天然有机物,它们也对植物的生长发育表现出特殊的调节作用。这些物质主要有油菜素甾体类、多胺类、茉莉酸类和水杨酸类等。
油菜素甾体类化合物的系统研究始于20世纪60年代。当时美国农业部的研究人员在60多种植物花粉的提取液中寻找促进生长物质, 1970年Mitchell等发现在油菜花粉的提取物中有一种物质,能引起菜豆幼苗节间伸长、弯曲及裂开等生长反应。1979年Grove等从227kg油菜花粉中得到10mg高生物活性的结晶,发现这是一种甾醇内酯化合物,故命名为油菜素内酯( brassinolide ,BR1 )(图6-35)。此后,人们又从很多种植物中分离鉴定出油菜素内酯及多种结构相似的化合物,并把这些以甾醇为基本结构的具有生物活性的天然化合物统称为油菜素甾体类化合物(brassinosteroids , BRs)。已报道天然存在的油菜素甾体类化合物达40多种,分别表示为BR1、BR2……BRn,其中生物活性最高的是BR1。
油菜素甾体类化合物在植物界分布很广,裸子植物、被子植物及藻类中都存在,分布于高等植物体的各部分,特别是花粉中含量最高,在细胞中主要存在于质体中。一般油菜
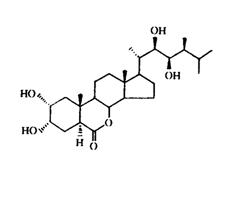
图6-35 油菜素内酯的化学结构
素甾体类化合物在花粉及未成熟种子中含量为1~1000 ng/kg鲜重,茎中为1~100 ng/kg鲜重,果实及叶中为1~10 ng/kg鲜重,根中的含量尚待测定。油菜素甾体类化合物中分布最广的是油菜素甾酮(BR2),其次是油菜素内酯(BR1),且它们具有很高的生物活性,可以说是油菜素甾体类化合物中最重要的两种。
油菜素甾体类化合物的生理作用主要表现在以下几个方面。
1、促进细胞伸长和分裂 用10 ng油菜素内酯处理菜豆幼苗的第二节间,可引起该节间显着伸长弯曲,细胞分裂加快,节间膨大,甚至开裂。油菜素内酯之所以能促进细胞伸长和分裂,因它能提高DNA和RNA聚合酶的活性,从而促进核酸和蛋白质合成;油菜素内酯还能活化质膜上的ATP酶,促使质膜外泌H+到细胞壁,使细胞壁酸化,促进细胞的伸长生长。所以,油菜素内酯促进生长的机理可能同样遵循“酸生长”学说。
分子遗传学试验发现,BRU1基因是一个由油菜素内酯专一调节的伸长基因,此基因编码一种与细胞伸长密切相关的酶:木葡聚糖内转化糖基化酶(XET)。外施油菜素内酯及其类似物能使该基因的转录水平极大提高,但生长素、赤霉素和细胞分裂素等处理却不能增加其转录水平。所以,油菜素甾体类化合物通过调节编码XET基因的表达来增加细胞的可塑性,从而促进细胞的生长。另外,油菜素甾体类化合物还能通过诱导ß-微管蛋白基因的表达来促进微管的形成,进而修饰细胞壁,促进细胞的伸长。ß-微管蛋白还与细胞的分裂有关,所以油菜素内酯促进生长还与它促进细胞分裂有关。
2、促进光合作用 油菜素内酯处理可增强小麦Rubisco活性,提高花生幼苗叶绿素含量,促进水稻叶片中的光合产物向穗部运输,从而提高植物的光合速率。
3、延缓衰老 用表油菜素内酯(epi-BR)处理绿豆下胚轴切段,可以延缓细胞衰老,还可以延长月季切花的瓶插寿命等。
4、提高植物的抗逆性 油菜素内酯处理能提高水稻、黄瓜和茄子等对低温、盐害和病害等逆境的抵抗能力。在低温下,水稻幼苗经油菜素内酯处理可降低细胞内离子的外渗,从而对细胞膜起到一定的保护作用。油菜素内酯对盐胁迫导致大麦叶片叶绿体超微结构破坏有明显的保护作用。
总之,油菜素甾体类化合物促进植物生长的靶区是细胞壁,通过各种机制(XET、微管)促进细胞壁松弛,使细胞体积增大,摄入水分和养分。同时通过促进光合作用,提高核酸和蛋白质的代谢,为细胞的伸长提供物质基础,最终表现出促进植物的生长。所以油菜素甾体类化合物在生产上主要用于增加作物产量;提高作物的耐冷性及耐盐能力;减轻某些农药(如除草剂)的药害等方面。随着对油菜素甾体类化合物研究的深入,以及人工合成了BR及其类似物,油菜素甾体类化合物在生产上的应用必将越来越广泛。
许多试验证实,油菜素内酯所诱导的生长反应与生长素、赤霉素和细胞分裂素的作用往往相似,但应用水稻叶片倾斜角度的变化对油菜素内酯具有专一性这一生物测定法,发现油菜素内酯与前面三类激素的作用并不相同。
许多试验证明油菜素内酯与生长素作用相似或油菜素内酯对生长素活性有增效作用,即油菜素内酯能提高植物组织对生长素的敏感性。但是,油菜素内酯促进生长的信号传导路径与生长素的不同;应用西红柿和大豆突变体也发现,油菜素内酯诱导生长素不敏感突变体的生长,却不能诱导SAUR基因的表达。SAUR为生长素诱导基因,是生长素活性的分子标志。
油菜素内酯与赤霉素促进生长的作用是相对独立的。如赤霉素生物合成抑制剂(如嘧啶醇,ancymidol)能抑制赤霉素促进的生长反应,但不能抑制油菜素内酯促进的生长作用。但是,S-3307却能同时抑制GA和BR的生物合成。所以,一般认为油菜素内酯作用机理与赤霉素是不同的,二者的关系又是复杂的。
油菜素内酯与细胞分裂素促进生长的作用有不同的结果。如油菜素内酯促进在黑暗中生长的黄瓜子叶面积增大,但其效力不及细胞分裂素;油菜素内酯与细胞分裂素对黑暗中生长的苍耳叶片组织的老化有相反的作用等。
多胺类化合物(polyamines , PAs)是一类生物体代谢过程中产生的具有生物活性的低分子量脂肪族含氮碱,包括有二胺、三胺、四胺和其他胺类。通常胺基数目越多,生物活性越强。高等植物中多胺主要有腐胺和尸胺(二胺)、亚精胺(三胺)、精胺和鲱精胺(四胺)(表6—1)。早在20世纪20年代,亚精胺和精胺的化学成分和结构就已被鉴定,但这一类化合物与植物生长发育的关系,直到20世纪60年代后才引起人们的高度重视。
多胺类化合物广泛分布于高等植物中,如单子叶植物中的小麦、大麦、水稻和燕麦等;双子叶植物中的豌豆、烟草、马铃薯和苋菜等。在高等植物中以腐胺、亚精胺和精胺分布最广。植物体内不同器官和组织中多胺的含量不同,一般细胞分裂旺盛的部位,多胺生物合成活跃,多胺的含量也越高。
植物体内多胺生物合成途径见图6-36。多胺生物合成途径的中心产物是腐胺,它可直接由鸟氨酸脱羧生成,或间接由精氨酸脱羧或经过几个中间步骤而生成。甲硫氨酸是作为多胺前体的另一种氨基酸,其作用是提供丙氨基,并和腐胺结合逐步形成亚精胺和精胺。
6—1 高等植物中的主要多胺
胺类名称 化学结构 分 布 |
腐胺(putrescine,Put) NH2(CH2)4NH2 普遍存在 尸胺(cadaverine,Cad) NH2(CH2)5NH2 豆科 亚精胺(spermidine,Spd) NH2(CH2)3NH (CH2)4NH2 普遍存在 精胺 (spermine,Spm) NH2(CH2)3NH (CH2)4NH (CH2)3NH2 普遍存在 鲱精胺(agmatine,Agm) NH2(CH2)4NHC(NH)NH2 普遍存在 |
此外,亚精胺和精胺的生物合成涉及到SAM,SAM也是乙烯生物合成的中间物质。所以,多胺和乙烯生物合成相互竞争SAM。另外,以赖氨酸为前体经脱羧反应可形成尸胺。在多胺生物合成中,精氨酸脱羧酶(ADC)、鸟氨酸脱羧酶(ODC)和S-腺苷甲硫氨酸脱羧酶(SAMDC)都起重要的作用,其中ADC是大多数植物多胺生物合成中的关键酶。
 图6-36 多胺生物合成途径及其与乙烯生物合成的关系
图6-36 多胺生物合成途径及其与乙烯生物合成的关系
(生物合成各步骤酶的抑制剂有:DFMA,DFMO,MGBG,AVG)
多胺生物合成抑制剂如DFMA(二氟甲基精氨酸)、DFMO(二氟甲基鸟氨酸)和MGBG(甲基乙二醛二米基-腙)等分别抑制相应酶的活性,从而抑制多胺的合成。
在植物细胞中,多胺常常与羟基肉桂酸、香豆酸和咖啡酸等酚类化合物相结合。这些结合形式可以与游离多胺一样行使重要的生理功能。
多胺的生理作用非常广泛,主要包括有以下几个方面。
1、促进植物生长 多胺能促进细胞分裂和生长,如休眠的菊芋块茎是不进行细胞分裂的,但是如果在培养基中加入10~100µ M的多胺,则块茎能进行细胞分裂和生长,同时也刺激形成层分化和维管束组织形成。在菜豆幼苗生长期内发现,当子叶中亚精胺和精胺逐渐减少时,幼苗中的亚精胺和精胺则逐渐增加。另外,用精胺处理菜豆能加速不定根的形成和生长。
在正常细胞内的酸性条件下,多胺类化合物以多价阳离子状态存在,易与多价阴离子的核酸、蛋白质和质膜的磷脂相结合,影响这些重要物质的合成与活性等,并影响膜结构及透性等。如精胺与DNA结合能稳定DNA的二级结构,使其不易热变性。多胺还具有稳定核糖体的功能,有利于蛋白质的合成。因此,多胺是通过促进核酸和蛋白质的生物合成而促进生长。
有证据表明它们能加快DNA的转录,增强RNA聚合酶活性和提高蛋白质合成速度。
2、延迟植物衰老 许多试验证实,多胺可延迟黑暗中的燕麦、豌豆和石竹等植物的叶片和花的衰老。多胺之所以能延迟衰老,前期是抑制蛋白酶和RNA酶活性,减慢蛋白质丧失,后期则是保持叶绿体类囊体膜的完整性,阻止叶绿素破坏。此外,亚精胺和精胺与乙烯的前体都是S—腺苷蛋氨酸,所以,通过抑制乙烯的生成也起延缓衰老的作用。据报道,石竹花衰老时,腐胺水平和乙烯水平的提高是平行的。用多胺生物合成抑制剂(如DFMA)抑制多胺合成,则产生较多的乙烯,花衰老较快;相反,用乙烯生物合成抑制剂(如AOA)抑制乙烯合成,则提高多胺水平,延缓花的衰老。
3、适应逆境条件 高等植物多胺代谢对各种不良环境十分敏感。当植物遭遇包括水分胁迫、低温胁迫、渗透胁迫和矿质元素缺乏等影响时,植物体内多胺含量及多胺合成酶活性显著上升。如植物在缺钾和缺镁时,ADC活性提高几倍到几十倍,积累腐胺,以代替钾等主要无机阳离子,影响细胞pH值。根据这个原理,人们提出应用腐胺含量作为缺钾的生化指标,而且比较敏感。在高盐(NaCl)条件下,绿豆苗根的腐胺含量和ODC活性都提高,腐胺由根运往叶片,起着维持阳离子平衡的作用。另外,山梨醇和甘露醇等渗透胁迫条件下,燕麦和大麦等的ADC活性显著加强,腐胺水平显著增加,维持渗透平衡,保护质膜稳定和原生质完整。因此,多胺可以使细胞适应逆境条件,提高植物的抗逆性。
此外,多胺还具有促进胚芽和花芽的分化;促进一些果实的发育;调节与光敏色素有关的生长和形态建成等生理作用。
多胺和乙烯都来自SAM,因此多胺和乙烯的关系引起人们的关注。许多实验表明,多胺与乙烯的关系比较复杂,但二者之间的相互作用是肯定的。它们可能通过以下几个方面来相互影响:(1)因有共同的前体SAM,所以多胺和乙烯的生物合成存在竞争机制,但这可能受品种和环境等影响,或只有在SAM库容量受限时才发生。(2)多胺能降低ACC合酶和ACC氧化酶的转录水平及活性,从而降低ACC的合成与转化。(3)多胺通过影响膜系统的物理性质影响膜上ACC氧化酶的性质,抑制ACC转化为乙烯。(4)多胺具有清除自由基的能力,活性氧能刺激ACC氧化酶,所以多胺能抑制乙烯的产生。(5)乙烯可通过影响ADC和SAMDC等多胺合成酶活性,降低多胺的含量。(6)乙烯合成和多胺合成还受ACC合酶和丙氨基转移酶(亚精胺和精胺合成酶)代谢副产物甲硫腺苷(MTA)的反馈调节。
多胺与其他激素也有密切的关系。如外施IAA、GA和CTK等可以促进多胺的生物合成,JA和MJ可以促进天仙子根培养物中Put的大量增加,而ABA却抑制多胺的合成,从而在延缓衰老等方面表现出不同的效应。
De Mole等于1962年首次从茉莉属素馨花(Jasminum grandiflorum)的香精油中分离到一种香味物质—茉莉酸甲酯(methyl jasmonate,MJ)。1971年Aldridge等又从真菌(Lasiodiplodia theobromae)培养液中分离出游离的茉莉酸(jasmonic acid,JA)。后来人们在苦艾、蚕豆和菜豆等多种植物中均检测到茉莉酸和茉莉酸甲酯。经多年研究,迄今已陆续发现多种在化学结构和生理功能上与茉莉酸相类似的化合物,我们把这些具有茉莉酸基本结构和功能的化合物统称为茉莉酸类化合物(jasmonates , JAs)。到1999年为止,植物中已发现的茉莉酸类化合物成员有25种,其中茉莉酸和茉莉酸甲酯是最重要的代表。
茉莉酸的化学名称是3-氧-2-(2’-戊烯基)-环戊烷乙酸,茉莉酸和茉莉酸甲酯的结构见图6-37所示,(-)JA和(-)MJ和它们的立体异构体(+)-JA和(+)-MJ都是植物体内具有生物活性的成分,其中(+)-JA的活性最高,但不稳定。在正常情况下,(+)-JA很容易转化为 (-)-JA。现已能人工合成(±)-MJ,并通过水解产生(±)-JA。JA在C—1位置上还能与葡萄糖或氨基酸结合而产生多种结合态JA。
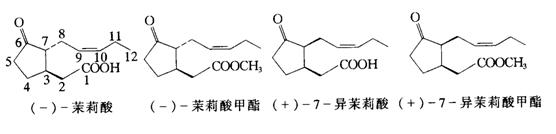
图6-37 代表性的茉莉酸类化合物的分子结构(引自李合生等,2002)
茉莉酸类化合物存在于高等植物、藓类、蕨类、藻类和真菌中,并且分布于植物体内的各部分。通常在生长部位如茎端、嫩叶、未成熟果实及根尖等处,茉莉酸类化合物的含量较高。生殖器官(特别是果实)含量比营养器官(叶、茎和芽)高,如蚕豆中茉莉酸含量为3100 ng/g鲜重,大豆为1260 ng/g鲜重,而叶、茎和芽含量只有10-100 ng/g鲜重。
茉莉酸的生物合成是以亚麻酸(linolenic acid)为前体,亚麻酸为膜脂成分的C18不饱和脂肪酸。亚麻酸首先在脂氧合酶(lipoxygenase , LOX)作用下转化为13-氢过氧化亚麻酸(13-hydroperoxylinolenic acid),然后在丙二烯氧化物合酶(allene oxide synthase , AOS)作用下形成12,13-环氧亚麻酸(12,13-epoxylinolenic acid),再经丙二烯氧化物环化酶(allene oxide cyclase , AOC)作用而产生12-氧代-植物二烯酸(12-oxo-phytodienoic acid),然后经还原酶以及三步的β-氧化产生了茉莉酸(JA),最后由它再衍生出各种茉莉酸类化合物(图6-38)。玉米、小麦及茄子等多种植物的子叶和叶片都能利用亚麻酸为前体合成茉莉酸。茉莉酸在植物体合成后,通常通过韧皮部运输,也可能在木质部及细胞间隙运转。
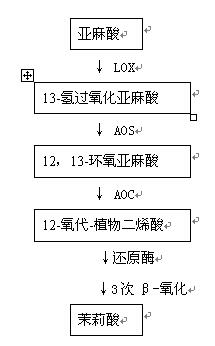
图6-38 茉莉酸在植物体内的合成途径
近年来,植物内源微量有机化合物中最受植物化学家和植物生理学家青睐的莫过于茉莉酸类化合物。大量研究发现,茉莉酸类化合物具有广谱的生理效应,即具有多效性,主要体现在这几个方面。(1)抑制作用:外源茉莉酸类化合物处理能够抑制水稻、小麦和莴苣等植物幼苗的生长;抑制叶绿素的合成和光合作用;抑制种子和花粉的萌发;抑制烟草等植物外植体的花芽分化等。(2)促进作用:促进绿豆下胚轴等插条生根;通过诱导ACC氧化酶而促进乙烯生物合成,从而促进果实的成熟、器官衰老与脱落;茉莉酸类化合物对马铃薯等块茎、甘薯等块根,以及洋葱等鳞茎的形成也具有显着的促进作用等。(3)提高植物的抗逆性:当植物受到机械伤害、病虫害、干旱、低温等逆境时,植物内源茉莉酸类化合物含量会迅速增加。所以外源茉莉酸甲酯处理能提高水稻对低温(5—7℃,3d)和高温(46℃,24 h)的抗性;MJ处理还能提高花生幼苗抗热、抗旱和抗盐性能。
自20世纪80年代起,人们对茉莉酸类化合物的分子调控机理进行了较详尽的研究,发现茉莉酸类化合物调控许多基因的表达。这些基因包括两类:一类是与生长发育有关的基因;另一类是与植物自身防御系统有关的基因。茉莉酸类化合物通过诱导基因表达,产生特异的JA诱导蛋白(jasmonic acid induced proteins , JIPs),从而表现出对真菌感染、病虫害和干旱等逆境的应激等。
通常将茉莉酸类化合物诱导的蛋白分为两类:(1)植物抵抗病虫害和非生物逆境的相关蛋白。据报道,JA或MJ诱导产生的蛋白质有十多种,其中大多数蛋白质是植物抵御病虫害、物理或化学伤害而诱发形成的,具有防卫功能。例如,JA或MJ诱导西红柿和马铃薯叶片形成蛋白酶抑制物Ⅰ(proteinase inhibitor Ⅰ)和蛋白酶抑制物Ⅱ。所以,在西红柿和马铃薯叶片受机械伤害或病虫害的时候,就会产生上述特殊蛋白质,分布于伤口附近或较远的部分,保护尚未受伤的组织,以免继续受害。(2)营养储藏蛋白(vegetative storage protein,VSP)。JA或MJ诱导产生少数蛋白质具有贮藏功能。例如,经JA和MJ处理,可诱导大豆叶片、茎维管束鞘产生营养贮藏蛋白质。在生殖器官发育时,VSP降解,释放出氨基酸供应到花果中去。因此,VSP可能有调节氮利用的功能。另外,JAs调控蛋白质的合成,除在转录水平上增强JIPs基因表达外,JAs还通过某些JIPs在翻译水平上负调正常细胞蛋白质mRNA的翻译,如Rubisco和其它核编码的蛋白等。
近来研究表明,茉莉酸类化合物是一种创伤诱导的内源信号分子,具有可挥发性,可“通知”未受伤部位和邻近植物进入“警戒状态”以抗击病虫害的侵入。如JAs作为信号分子参与植物卷须盘绕过程的信息传递,它们促进卷须盘绕的能力比亚麻酸强。
综上所述,茉莉酸类化合物是负责外部逆境(虫害、病原菌、干旱、机械伤害和渗透胁迫)与细胞内大分子(蛋白质和核酸)逆境反应之间的信号传递的,最终通过某种JIPs活化防卫基因。
茉莉酸类化合物与脱落酸在许多方面有类似的功能,如抑制根和茎的伸长生长、抑制种子和花粉的萌发、促进气孔的关闭、促进器官衰老和脱落以及提高植物的抗逆性等。如用JA、ABA处理均能诱导某些逆境蛋白的形成,这些逆境蛋白的累积与内源JA、ABA水平的升高相偶联;在同一植物中某些能被JA诱导的蛋白也能被外源ABA所诱导;植物遇到某些逆境 (昆虫、病原菌、水分亏缺和渗透胁迫)都会导致体内ABA和JA水平的明显升高等等。但JA和ABA也有不同之处,如在莴苣种子萌发中,JA不如ABA活力高; JA促进叶片老化效果比ABA大;植物某些创伤诱导蛋白或JIPs不能被外源ABA所诱导;用JA生物合成途径中关键酶——脂氧合酶的抑制剂,能抑制JIPs的形成,而用ABA合成的抑制剂或采用ABA 合成缺陷型突变体为试验材料,JIPs的形成则不受任何影响。所以,JIPs的形成是与内源JA含量增高严格相关,但与ABA没有必然关系。另外,有关实验还表明ABA在逆境信号传递链中不是基本的,而是辅助性的,但可能在不同的植物中有所不同。至于某些JIPs能被外源ABA诱导的事实,可能暗示形成的内源ABA和JA以一个共同的、至今尚未知的方式作用于遗传物质的翻译“机器’去产生同类蛋白,或者ABA和JA在对逆境反应方面有不同的传导途径,但在后面的几步中又相关,最后合成相同的逆境反应产物。总之,ABA和JA在植物对逆境反应中的相互关系十分复杂,目前的实验证据尚不足以阐明。
茉莉酸类化合物还与多胺、水杨酸、生长素、赤霉素、细胞分裂素和乙烯等微量调节性分子间存在复杂的相互关系,从而在基因表达的调控中起着多方面的重要作用。这也是近年来JA研究受到人们极大关注的一个原因。
早在—个世纪以前,古希腊人和印地安人分别发现柳树皮和柳树叶片具有镇痛解热作用。1828年Johann Buchner成功地从柳树皮中分离出微量的水杨醇糖苷(salicyl alcohol glucoside)。1838年Piria将这种活性组分命名为水杨酸(salicylic acid ,SA) ,其化学成分是邻羟基苯甲酸。1874年,人们首次合成了水杨酸,其功效与1898年Bayer公司推出的阿斯匹林(aspirin,即乙酰水杨酸)相似(图6-39)。以后,从各种植物(包括绣线菊属植物和冬青植物)中分离出水杨酸和其它水杨酸类物质(主要是水杨酸的甲基酯和糖酯,它们很容易转变为水杨酸)。水杨酸能溶于水,易溶于极性有机溶剂(如乙醇),水溶液的pH值是2.4。

图6-39 水杨酸和乙酰水杨酸的分子结构
水杨酸类(SAs)是肉桂酸的衍生物,一般认为水杨酸类的生物合成是经过莽草酸途径来完成的,即莽草酸经过一定的反应生成苯丙氨酸,后者在苯丙氨酸解氨酶(PAL)的催化下生成反式肉桂酸,反式肉桂酸先发生羟基化产生邻香豆酸,后者再经β—氧化产生水杨酸。但同位素示踪技术却显示植物体内反式肉桂酸是先通过β-氧化产生苯甲酸,然后再羟基化产生水杨酸,并且其限速步骤是β-氧化。现已知植物体内水杨酸有游离态和结合态(如SA-β-葡萄糖苷)两种形式,植物体内水杨酸类物质以游离态的形式通过韧皮部运输。水杨酸类物质在植物体内含量很低,大约1µ g/g鲜重,但在产热植物的花序含量却较高,如某种天南星科的植物花序,含量可达3µ g/g鲜重。在不产热的叶片等器官中也有水杨酸类物质的存在。
1、生热效应 天南星科植物佛焰花序的生热现象很早就引起人们的注意。1973年Adriaan van Herk认为天南星科植物佛焰花序的生热现象是由生热素引起的。直至1987年,Raskin等人的试验才确定这种生热素就是SA。实验发现,在佛焰花序开始产热时,内源SA浓度大幅度增加,此时佛焰花序的温度比环境温度高很多(可高达14℃)。若外源施用SA也可使佛焰花序的温度提高。其原因是佛焰花序开花前,雄花基部产生SA,诱导抗氰的非磷酸化途径活跃,导致剧烈放热。实验还发现,纯化的百合雄花提取液和SA都能激活编码交替氧化酶的核基因。这可能是SA诱导发热的作用机理之一。这种现象的生物学意义是:严寒时,花序产热,局部维持高温,适于开花结实,也有利花序产生具臭味的胺类和吲哚类物质蒸发,吸引昆虫传粉。可见,植物产热是对低温环境的一种适应。
2、提高抗性 SAs最受关注的效应是其与植物的抗病性相关。一般植物被病原菌侵染后,在被侵染部位以局部组织迅速坏死的方式——过敏反应(hypersensitive reaction , HR)来阻止感染范围的进一步扩散;而非侵染部位则获得了一种在较长时间内都可以保持对这种病原及其他病原较强抗性,即系统获得抗性(systemic acquired resistance , SAR)。与过敏反应和系统获得抗性相伴随发生的是病原相关蛋白(pathogenesis-related proteins,PRs,)基因的表达。一些抗病植物受病原微生物浸染后,会诱发SA的形成,而SA诱导抗病基因的活化和病原相关蛋白的形成,从而增强抗病性。试验证明,外施SA于烟草,浓度越高,病原相关蛋白产生就越多,对烟草花叶病毒(tobacco mosaic virus,TMV)的抗性越强。在抗TMV的烟草品种中,内源SA水平在接种TMV的叶片内能增加40倍左右,在同一植株的其它未感染叶片内增加10倍左右。有些感病植物也含有相关的抗病基因,只是病原的侵染不能导致SA含量的增加,故抗性基因不能活化,这时如果用SA外源处理,也可增加抗病性。初步研究表明,SA首先与过氧化氢酶结合,抑制其活性,使体内H2O2水平上升,从而起到诱导和增强植物抗病性的作用。
水杨酸酸类还具有其他生理作用,如抑制ACC转变为乙烯,从而延长切花等的寿命;诱导长日照植物浮萍属在非诱导条件下开花;抑制雌花分化并促进较低节位上的雄花分化,显著影响黄瓜性别表达。
SA与JA有许多相似生理作用。如都能诱导气孔关闭、抑制Rubisco生物合成、影响植物对N、P的吸收等。更重要的是JA和SA都是植物体对外界伤害作出反应,表达抗性基因的信号分子。通常情况下,植物体将伤信号传给JA,JA诱导产生碱性PR蛋白;而病原菌侵染的信号是传给SA,在SA 刺激下产生酸性PR蛋白。它们都能诱导许多伤害诱导基因的表达和抗病相关蛋白的合成。但水杨酸可抑制茉莉酸类的合成及其所诱导的蛋白基因的表达,如水杨酸和乙酰水杨酸能抑制创伤和亚麻酸等诱导产生的蛋白酶抑制物PⅠ的合成;茉莉酸却能阻止病原侵染后所产生的水杨酸的增加及水杨酸诱导的酸性PR基因的表达。水杨酸和茉莉酸这两类信号传导途径相互配合,在植物防卫信号传导过程中交叉起作用。
许多实验表明,植物具有交叉适应能力,即某种非致死逆境条件不仅可以增强植物对这种逆境的抗性,而且同时增强对其他逆境的适应性。如乙烯预处理绿豆诱导了对臭氧的抗性;水分亏缺下的棉花对除草剂的抗性增强了等。大量的实验表明,这种交叉抗性是由ABA介导的,即ABA是植物交叉反应过程中重要胁迫信号分子。SA也介导或参与胁迫引起的防卫反应,这些事实提示SA和ABA信号途径可能存在某种程度的交叉。
1962年Stob等从玉米赤霉菌的培养物中分离出一种活性物质,发现它具有动物雌性激素作用。1966年Urry等确定了该物质的化学结构属于二羟基苯甲酸内酯类化合物,并命名为玉米赤霉烯酮(zearaienone)。我国科学家李季伦、孟繁静等先后从小麦、玉米、棉花等10多种植物的不同器官中检测出玉米赤霉烯酮的存在,而且生殖器官比营养器官含量高,并发现它在春化作用、花芽分化、营养生长及抗逆中具有重要作用。
系统素(systemin , SYS)是1991年Pearce首次从受伤番茄叶片中分离到的。而后在其他几种茄科植物中也分离鉴定到系统素。系统素是一种由18个氨基酸组成的多肽,是植物感受创伤(wounding)的信号分子,在植物防卫反应中起十分重要的作用。植物体内合成的抵御害虫和病原菌侵染的众多防卫分子中,最重要的是蛋白酶抑制剂家族,但系统素是蛋白酶抑制剂最有效的诱导物,它在10-15mol/L时就具有很强的诱导性。它通过调节蛋白酶抑制剂基因的表达,参与植物对病虫害侵染的防卫反应。研究还表明,人工合成的和内源的系统素具有同样的功效。外源施用系统素可通过韧皮部快速地运输到植物的各器官和组织中。
近年来发现,某些细胞壁的降解产物——寡糖与激素相似,它们依赖糖链结构的不同调控着植物的生长发育和对逆境防御等重要生理过程。如诱导膜的快速去极化、促进蛋白磷酸化、促进RNA的合成和提高植物的抗逆性等。外源施用实验证明,这些寡糖分子在很低浓度(nmol/L)下,就可作为一种信号分子调控植物的生长发育和植物抵抗逆境(虫害、病原菌入侵、生理逆境)的防卫反应。这些有生物活性的一类寡糖分子统称为寡糖素(oligosaccharin)。
6.8 植物生长调节剂及其应用
植物内源激素的含量非常低,难于提取,价格也贵。为满足生产需要,人们利用化学合成法,合成许多与天然激素具有类似生理功能的有机化合物,即植物生长调节剂。
植物生长调节剂问世后,就被迅速地应用于农业和林业等生产中,获得显著的社会和经济效益。用植物生长调节剂去调节和控制植物生长发育的手段,简称为植物化学调控或化学调控。与传统的农业技术相比,化学调控具有成本低、收效快、效益高以及节省劳动力等优点,所以,它已成为现代化农业的一项重要技术措施。
植物生长调节剂种类很多,一般根据生理功能的不同,分为三类:植物生长促进剂、植物生长抑制剂和植物生长延缓剂。
植物生长促进剂的基本特征是促进细胞分裂、分化和伸长生长,也能促进植物营养器官生长和生殖器官发育。如生长素类调节剂有IBA、NAA、2,4-D和2,4,5-T等。它们在植物体内不会被IAA氧化酶所降解,因而比较稳定,而且通常比IAA具有更强的生理活性等。因此,这类化合物在生产上得到广泛的应用。另外,植物生长促进剂还包括细胞分裂素类调节剂如6-BA、KT和CPPU等。
植物生长抑制剂(plant growth inhibitors)的基本特征是抑制顶端分生组织细胞伸长和分化,促进侧枝的分化和生长,使植物丧失顶端优势,植株形态发生很大的变化。外施生长素等可以逆转这种抑制效应,而外施赤霉素则无效。常用的植物生长抑制剂有以下几种(图6-40):
1、三碘苯甲酸 三碘苯甲酸(2,3,5-triiodobenzoic acid , TIBA)的分子式为C7H3O2I3,相对分子质量为500.92。纯品为白色粉末,熔点224-226℃,不溶于水,易溶于乙醇、乙醚和苯等。TIBA是一种阻碍生长素运输的物质,它改变了生长素在植物体各部分的分配,从而也改变了植物体各部分生长素和其它激素间的相对比例。因而能抑制顶端分生组织细胞分裂,使植株矮化,消除顶端优势,促进腋芽发育,促进花芽的形成。TIBA多用于大豆生产。在大豆开花期喷施TIBA,植株变矮,分枝增加,提高结荚率,提早成熟,防止倒伏,增加产量。
2、马来酰阱 马来酰阱(maleic hydrazide , MH)在我国又称青鲜素,化学名称是顺丁烯二酰阱,分子式为C4H4O2N2,相对分子质量为112.09。纯品为白色结晶,熔点296-298℃。难溶于水,易溶于冰醋酸、二乙醇胺。MH主要传导至生长点,其作用正好与生长素相反,能抑制芽的生长和茎的伸长。这是因为MH的结构与RNA的组成部分——尿嘧啶非常相似。MH进入植物体内可代替尿嘧啶的位置,但不起作用,因而阻止了核酸的合成,干扰正常代谢的进行,从而抑制生长。MH主要用于鳞茎和块茎植物如洋葱、大蒜和马铃薯等在储藏期的发芽以及抑制烟草侧芽生长,还可控制树木和灌木(行道树和树篱)的过度生长。另外,据报道MH可能是一种致癌物,因而不应该应用于植物生产的食用部分上。
3、整形素 整形素(morphactin)化学名称是9-羟芴-羧酸,分子式为C15H11ClO3,相对分子质量为228.7。纯品为无色结晶,熔点152℃,微溶于水,可溶于乙醇、丙酮等。整形素是一种抗生长素物质,它能阻碍生长素从顶芽向下转运,提高吲哚乙酸氧化酶活性,使生长素含量下降。它能抑制细胞的有丝分裂,抑制顶芽生长,促进侧芽发生。所以,经整形素处理的植株表现出矮化或成丛生状,这已在塑造木本盆景生产上得到应用。
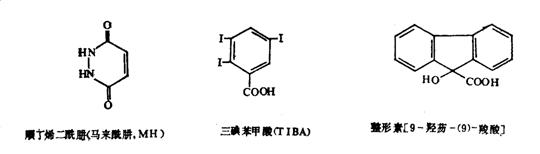
图6-40 几种植物生长抑制剂的化学结构
植物生长延缓剂(plant growth retardants)的基本特征是抑制内源赤霉素的生物合成,从而抑制近顶端分生组织的细胞延长,使节间缩短,但叶数和节数不变,生殖器官不受影响或影响不大,株型紧凑、矮小。外施赤霉素可逆转生长延缓剂的抑制作用。不同种类的生长延缓剂抑制赤霉索生物合成过程中的不同环节。如:CCC抑制赤霉素生物合成过程中的GGPP至内根-贝壳杉烯的过程;PP333、S-3307和B9抑制内根-贝壳杉烯至内根-贝壳杉烯酸的合成。生长延缓剂都是抗赤霉素物质。一般来说,施用生长延缓剂后植株矮小、茎粗、节间短、叶面积小、叶厚和叶色深绿。农业生产上常用于培育壮苗和矮化防倒伏等。生产上常用的植物生长延缓剂有以下几种(图6-41):
1、CCC CCC是氯化氯胆碱(chlorocholine chloride)的简称,国内俗称矮壮素。它的化学名称是2-氯乙基三甲基氯化铵,分子式为C5H13C12N,相对分子质量为158.08。纯品为白色结晶,易溶于水。CCC是一种生产上常用的生长延缓剂,它不易被土壤所固定或被土壤微生物分解,一般作土壤施用效果较好。生产上用于防止小麦、水稻和棉花等植物的徒长和倒伏。
2、Pix Pix的化学名称是1,1-二甲基哌啶嗡氯化物(1,1-dimethy-piperidinium chloride),国内俗称缩节安、助壮素等。它的分子式为C7H18ClN,相对分子质量为149.7。纯品为白色结晶,易溶于水。在土壤中容易分解,半衰期约为2周。Pix在生产上用于控制棉花徒长效果比较肯定,它使植株矮化,并提高同化能力,促进成熟,增加产量。
3、PP333 PP333(paclobutrazol)又名氯丁唑,国内商品名为多效唑。它的化学名称是(2RS,3RS)-1-(4-氯苯基)-4,4-二甲基-2-(1H-1, 2,4-三唑-1-基)-3-戊醇,分子式为C15H20N3OCl,相对分子质量 为293.5。纯品为白色结晶,水中溶解度为35mg/kg。在土壤中半衰期为6~12个月。PP333广泛应用于果树、花卉、蔬菜和大田作物,可使植株根系发达,植株矮化,茎杆粗壮,并可以促进分枝,增穗增粒和提高抗逆性等。如:PP333应用于稻田能改善株型,
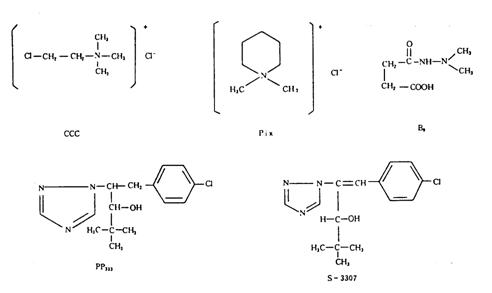
图6-41 常用的几种生长延缓剂的化学结构
增加有效穗数,减少倒伏,有显著的经济效益;应用于多种果树能增加花芽,提高座果率,改善品质;应用于多种花卉,能矮化株型,增加花数。
4、S-3307 S-3307(uniconazol)在国内商品名为烯效唑或优康唑,它的化学名称是(E)-(对-氯苯基)-2-(1,2,4-三唑-1-基)-4,4-二甲基-l-戊烯-3-醇,分子式为C15H18ClN3O,相对分子质量为291.5。纯品为白色结晶,水溶解度为14.3 mg/L(24℃),可溶于丙酮、甲醇和氯仿等有机溶剂中。在生产上应用有矮化植株,抗倒伏增产,除杂草和杀菌等作用,土壤施用效果好于叶片。
5、B9 B9是二甲基氨基琥珀酰胺酸(dimethyl amino succinamic acid),又名B995等。B9的分子式为C6H12N2O3,相对分子质量为160,纯品为白色结晶。在25℃时溶解度为:水10%,甲醇5%,丙酮2.5%。B9 能够抑制生长素运输和赤霉素生物合成,常用于果树生产上。它可使植株矮化,促进花芽分化和提高坐果率,促进果实着色和延长储藏期等。B9在土壤中稳定,残效达1~2年,所以一般不作土壤施用。B9对人体有致癌作用,因此不应在食用植物的食用部分上施用。
植物生长调节剂的种类繁多,生理作用也很广泛。有的促进生长发育,也有的抑制生长发育,即使同一种植物生长调节剂,也会因其使用浓度、部位、方法和时期等不同,而产生不同甚至相反的效果。因此,在实际应用中,除了熟悉各种调节剂的基本知识和性能外,还需要掌握生长调节剂的应用策略,达到合理地利用植物生长调节剂。
1、分析生产存在问题的实质 要应用植物生长调节剂去控制植物的生长发育,解决生产上存在的问题,必需先了解问题的实质。正确分析生产问题的实质,首先要了解作物的生长发育规律,如要保花保果,就要使花果得到充分的营养,抑制花(果)柄基部离层细胞的分化,重点落在离层形成问题上。其次,还要运用植物生理学、生物化学和植物解剖学等知识,并结合现场考察,才能判断出问题的本质,有针对性地提出合理的化控措施。
2、 拟定解决问题的方案
(1)选择合适的生长调节剂 生长调节剂的种类繁多,性质和功能各不相同。要根据生产问题的实质,选出合适的生长调节剂种类。如欲使花生增产,最佳的选择是用生长延缓剂控制营养生长,改变光合产物运输的方向,使其集中运输到正在生长中的荚果,达到荚果多且饱满。在同一类调节剂中,还应进一步考虑哪一种效果显著、使用方便、价格便宜、残效期短以及人畜安全等。如抑制生长以ABA效果显著且安全,但目前ABA的价格高,不可能应用在大规模生产中。若用生长延缓剂也可达到延缓生长的作用,同时还能提高内源ABA的水平。即使对于生长延缓剂中的不同物质,也要根据实际效果选择使用。如三唑类中,烯效唑抑制生长的效果比多效唑强。 每种生长调节剂虽有其独特的效果,但不全面,有局限性。生产中常采用两种或两种以上生长调节剂混合使用或先后使用的方式,以达到取长补短,更完善地发挥它们的调节作用,这是当前生长调节剂应用的新方向之一。如乙烯利可以矮化玉米株高,促进根系发育,抗倒伏,但果实发育也受到明显地抑制。BR促进玉米果穗发育,减少秃尖,但无防止倒伏的效果,两者混合喷施玉米植株,取得既抗倒伏又增产的效果。
(2)决定施用时期 外施植物生长调节剂被植物吸收并运输到靶部位,诱导一系列生理生化反应,才表现出对植物生长发育的调控作用。这个过程需要一定的时间,因此实际应用时要根据待解决问题的发生时间,提早几天喷施生长调节剂,若土壤施用则提前更长时间,施用时间过早或过迟都难以达到效果。如控制禾谷类徒长,应该选择拔节初期施用较好,过迟无效,过早效果也差。
(3)确定处理部位 通常要根据问题的实质确定处理部位。如用2,4-D防止落花落果,技术上可行的话,应该将药剂涂抹在花朵上,抑制花柄离层的形成,如果将药剂处理幼叶,则会造成伤害。又如以乙烯利促进橡胶排胶,应将乙烯利油剂涂在树干割胶口下方宽2cm处,刺激乳胶不断分泌,提高产胶量。
(4)选择施用方式 外施的植物生长调节剂可通过根部或叶片和茎部进入植物体内。不同生长调节剂进入植物体途径不同,施用方式的选择也应不同。如植物主要通过根部吸收PP333,因此可把药剂施人土中。TIBA,2,4-D等则不同,主要由叶面吸收,所以一般采用喷施而不宜施入土壤中。
(5)拟定施用浓度和次数 施用药剂的浓度和次数是试验成败的关键因素。生长调节剂作用具有多效性,浓度过低不起作用,浓度过高可能会杀死植物,只有适当浓度才起促进或延缓生长的作用。如2,4-D可因施用浓度的高低,表现出促进生长、促进单性结实乃至杀死植物(作为除草剂)等不同效应。另外,施用浓度与次数与植物的生长状况有关。如生长旺盛的作物,施用生长延缓剂的浓度可高些,若抑制不住徒长,可再施1到2次。长势一般的作物,施用生长延缓剂的浓度就要降低,并且可能1次施用即够。不同的剂型(水剂、油剂和粉剂等)配合合理的施用方法(溶液喷撒、溶液点滴、溶液浸泡、溶液涂抹、溶液灌注、土壤施用和气体熏蒸),才能获得明显的效果。此外,还要考虑气象等因素的影响,如不在降雨前施用等。
3、 进行预备试验 作物的种类、品种、所处的土壤和气候环境等的不同均会影响生长调节剂的效果,而且,同一药剂因生产厂家、批号及存放时间的不同也可能存在差异。因此,即使所拟定的方案非常合理详尽,在大规模应用前还必须进行小规模或局部的预备试验。通常先以拟定的方案处理少量植株,数天后观察供试植株,若无烧伤和其他异常现象,才可用于大规模生产。
4、配合其他农业技术措施 植物生长调节剂是对植物生长发育的某个环节进行调节的微量物质,它不能代替肥料、农药及其他农业技术措施而起作用。要使生长调节剂在生产上获得理想的效果,一定要配合水、肥管理以及其他农业技术措施。如奈乙酸和吲哚丁酸处理插条后,苗床内要保持一定的湿度和温度.才能使插条顺利生根。
5、植物生长调节剂的残留 植物生长调节剂施用后,在植物体内和土壤中会残留多长时间?它们对人畜的毒性如何?这些问题已成为使用生长调节剂不可忽视的因素。植物生长调节剂属于农药一类,大部分属于低毒类,如NAA、2,4-D、6-BA、TIBA、MH、B9、CCC和PP333等。生长调节剂在植物体内通过酶作用和化学作用,逐渐降解,药效就会消失。在正常使用量标准下,药物在植物体内残留时间,短的只有几天(如乙烯利),长的可达数月(如多效唑),更长的可达一年(如B9)。土壤中植物生长调节剂除被植物吸收外,其余的能被微生物、光和碱分解以及蒸发分解,但仍有部分被土壤胶粒所吸附。土壤中残留的生长调节剂会影响后作作物的生长发育。如用B9处理花生,在同一地块上连续三茬还保持其植株矮化状态。
生产上减少植物生长调节剂残留的方法有以下几种:(1)利用生物农药,其中包括植物体产生的激素,这是最根本的方法。如无毒性的赤霉素是赤霉菌产生的,三十烷醇是蜂蜡等农产品的成分。(2)合成毒性低和分解快的生长调节剂。如奈乙酸和乙烯利等。(3)在相同效果的前提下,选用残效期短和毒性低的种类。如培育水稻和油菜壮苗,应用烯效唑代替多效唑,因前者的残留期比后者短得多,而且使用量也比后者低5~10倍。(4)掌握正确的施用浓度、次数、时期和方法。在不影响生物效应的前提下,尽量减少用量。如以施用时期来说,最好在作物生育初期施用,严禁在临近收获期施用具毒性或残效期较长的生长调节剂于食用的粮食和果蔬作物。(5)提高药效,降低用量。如与表面活性剂(吐温等)混合施用,可增加植物体对生长调节剂的吸收量,减少生长调节剂的用量。
植物生长调节剂对农林业等生产有着不可低估的贡献,未来仍将具有广阔的应用前景。今后的研究仍然应该是基础研究和应用研究相结合,既要注重内源激素的代谢及机理的研究,又要注重各种生长调节剂形态生理效应。还要研究各种药剂的吸收、运转,药剂浓度、环境因素与药效的关系以及残毒和环境保护等问题。生长调节剂的研究,同其他植物生长物质的研究一样,也会成为2l世纪农林业等生产的突破口之一。
关键词
植物生长物质(plant growth substances) 植物激素(plant hormones) 植物生长调节剂(plant growth regulators) 生长素类(auxins) 赤霉素类(gibberellins) 细胞分裂素类(cytokinins) 乙烯(ethylene) 脱落酸(abscisic acid) 油菜素甾体类(brassinosteroids) 多胺类(polyamines) 茉莉酸类(jasmonates) 水杨酸类(salicylic acids) 植物生长促进剂(plant growth stimulators) 植物生长抑制剂(plant growth inhibitors) 植物生长延缓剂(plant growth retardants) IAAs NAA IBA Gas CTK 6-BA ABA ABP1 ETH JA PA SA BR PP333 CCC TIBA ACC 2,4-D B9 KT Pix MH SAM MVA
思考题
1、五大类植物激素的主要合成部位和运输方式有何异同?
2、生长素和赤霉素都能促进茎的伸长,但茎对生长素和赤霉素的反应在哪些方面表现出差异?
3、赤霉素水平随着种子成熟过程而降低,而脱落酸水平却上升,这有什么生理意义?
4、细胞分裂素如何延缓植物的衰老?
5、为什么说乙烯是一种促进衰老的激素,也是一种催熟激素和应激激素?
6、在调控植物生长发育方面,五大类植物激素之间,在哪些方面表现出相互促进或相互拮抗的关系?
7、你认为油菜素内酯、多胺、茉莉酸、水杨酸最具独特的生理作用是什么?
8、合理使用植物生长调节剂时要注意什么问题?
9、植物激素两种基本作用模式是什么?
10、植物激素受体应具备哪些特征?
11、酸生长学说的依据及内容是什么?
12、ABA调节气孔开关的机理如何?
13、为什么IAA在某些器官的运输是极性运输?
主要参考文献
1、丁秀英,张军,苏保林,徐惠风. 水杨酸在植物抗病中的作用. 植物学通报,2001,18(2):163-168
2、王忠主编. 植物生理学. 北京:中国农业出版社,2000
3、王金祥,李玲、潘瑞炽. 高等植物中赤霉素的生物合成及其调控. 植物生理学通讯,2002,38(1):1-8
4、王晓云,邹琦. 多胺与植物衰老关系研究进展. 植物学通报,2002,19(1):11-20
5、李宗霆,周燮 著. 植物激素及其免疫检测技术. 南京:江苏科学技术出版社,1996
6、李合生主编. 现代植物生理学. 北京:高等教育出版社,2002
7、李春香,周燮. MeJA对大蒜鳞茎膨大及内源激素含量的影响. 生命科学研究, 2002,6(2):183-185
8、刘新,张蜀秋. 在伤信号传导中茉莉酸与水杨酸的关系. 植物学通报,2000,17(2):133-136
9、余叔文,汤章城 主编. 植物生理与分子生物学. 北京:科学出版社,1999
10、吴劲松,种康. 茉莉酸作用的分子生物学研究. 植物学通报,2002,19(2):164-170
11、侯雷平,李梅兰. 油菜素内酯(BR)促进植物生长机理研究进展. 植物学通报,2001,18(5):560-566
12、倪迪安, 许智宏. 生长素的生物合成、代谢、受体和极性运输.植物生理学通讯,2001,37(4):346-352
13、曾广文,蒋德安 主编. 植物生理学. 北京:中国农业科技出版社,2000
14、潘瑞炽主编. 植物生理学(第四版). 北京:高等教育出版社,2001
15、潘瑞炽,李玲. 植物生长发育的化学控制. 广东:广东高等教育出版社,1995
16、Clowe JM,Sassa JM . Brassinosteriods: Essential regulators of plant growth and development. Annu Rev Plant Physiol Plant Mol Biol, 1998,49:427-451
17、Emery RJIV, Longnecker NE, Atkins CA . Branch development in Lupinus ugustifolium L. II. relationship with endogenous ABA, IAA and cytokinins. J Exp Bot, 1998,49: 555-562
18、 Milborrow BV. The pathway of biosynthesis of abscisic acid in vascular plants: a review of the present state of knowledge of ABA biosynthesis. Journal of Experimental Botany , 2001,52(359):1145-1164
19、Machácková I, Konstantinova TN, Sarguva LI, Lozhuikova VN, Golyanovskoya SA, Dudko ND, Eder J, Aksenova NP. Periodic control of growth, development and phytohormone balance in Solanum tuberosum . Physiol Plant, 1998, 102: 272-278
20、Mok DWS,Mok MC. Cytokinin metabolism and action.Annu Rev Plant Physiol Plant Mol Biol,2001,52:89-118


