中文课件:
6.2.1
.1赤霉素的发现
赤霉素(gibberellin,GA)是日本学者在研究水稻恶苗病的过程中发现的。早在十九世纪末,日本水稻苗出现异常徒长现象,当时,日本农民曾用“笨苗”来形容这种症状。Hori(1889)最早指出这种异常徒长现象起因于真菌病害。Sawada(1912)进一步指出这是由真菌分泌的物质感染稻苗所导致的结果。Kurosawa(1926)发现用赤霉菌(Gibberellin fujikuroi)培养液处理未受感染的水稻植株,也能刺激稻苗徒长,提示该症状是赤霉菌所分泌的某种化学物质引起的。Yabuta等(1938)从诱发水稻恶苗症的赤霉菌中分离并结晶到了这种物质,定名为赤霉素。由于二战这项研究工作被迫停止。战后,日本的赤霉素研究引起各国的关注。英美学者以日本赤霉素的发现为基础,展开了进一步的研究。1954年美英科学家分别从赤霉菌培养液中提取并鉴定到了赤霉酸(gibberellic acid,GA3)。1955年,日本学者重新分析他们早期得到的赤霉素产品,并提取到了3种赤霉素,即GA1、GA2和GA3。Phinney等(1957)最早报道在高等植物中存在有赤霉素。他们以突变矮化的玉米品种为材料,并且在不同属、种的植物种子或果实提取液中均发现有类似赤霉素的物质存在。1958年,MacMillan等在连荚豆(Phaseolus multiflora)未成熟种子中分离得到GA1结晶,这说明赤霉素类化合物是高等植物的天然产物。此后,又陆续在其他高等植物中发现存在多种赤霉素。现已证实,赤霉素是植物界中普遍存在的一类植物激素。到2000年底,在植物和真菌中已发现有127种不同结构的赤霉素,其中大多数种类存在于高等植物中,其他种类中一部分存在于真菌,另一部分真菌与植物中均有。按其发现的顺序,分别简写为GA1、GA2、GA3……GA127。
在植物激素中,仅有赤霉素类(gibberellins,GAs)是根据其化学结构来分类的。赤霉素类基本结构是赤霉烷(gibberellane),它是一种双萜,由4个异戊二烯单位组成,含有4个碳环(A、B、C、D)。在赤霉烷上,由于双键、羟基的数目和位置不同,以及内酯环的有无,形成了不同的赤霉素(图6-13) 。根据赤霉素分子中碳原子数目的不同,可分为C19和C20两类赤霉素。GA1、GA2、GA3、GA7、GA9、GA22等属于C19赤霉素,GA12、GA13、GA25、GA27等属于C20赤霉素。C19- GAs是由C20- GAs转变而来的,但前者所包含的种类多于后者,且生理活性也高于后者。各种赤霉素都含有羧酸,所以赤霉素呈酸性。
在GAs家族中,大多数成员没有生物活性或活性很低。少数具有高生物活性的赤霉素都有相同的结构特点。如第7位碳原子上的羧基是所有GAs所共有,也是产生活性所必需的;C19-GAs比C20-GAs具有更强的生物学活性;具有活性的GAs均在第3位碳上被羟基化等。但若在第2位碳上引入一个羟基,就会导致GAs活性的丧失。一些生理活性强的赤霉素有GA1、GA3、GA4、GA7、GA30、GA38等;生理活性弱的赤霉素有GA13、GA17、GA25、GA28、GA39等。最有代表性的赤霉素是赤霉酸(GA3),分子式是C19H22O6,相对分子质量为346。
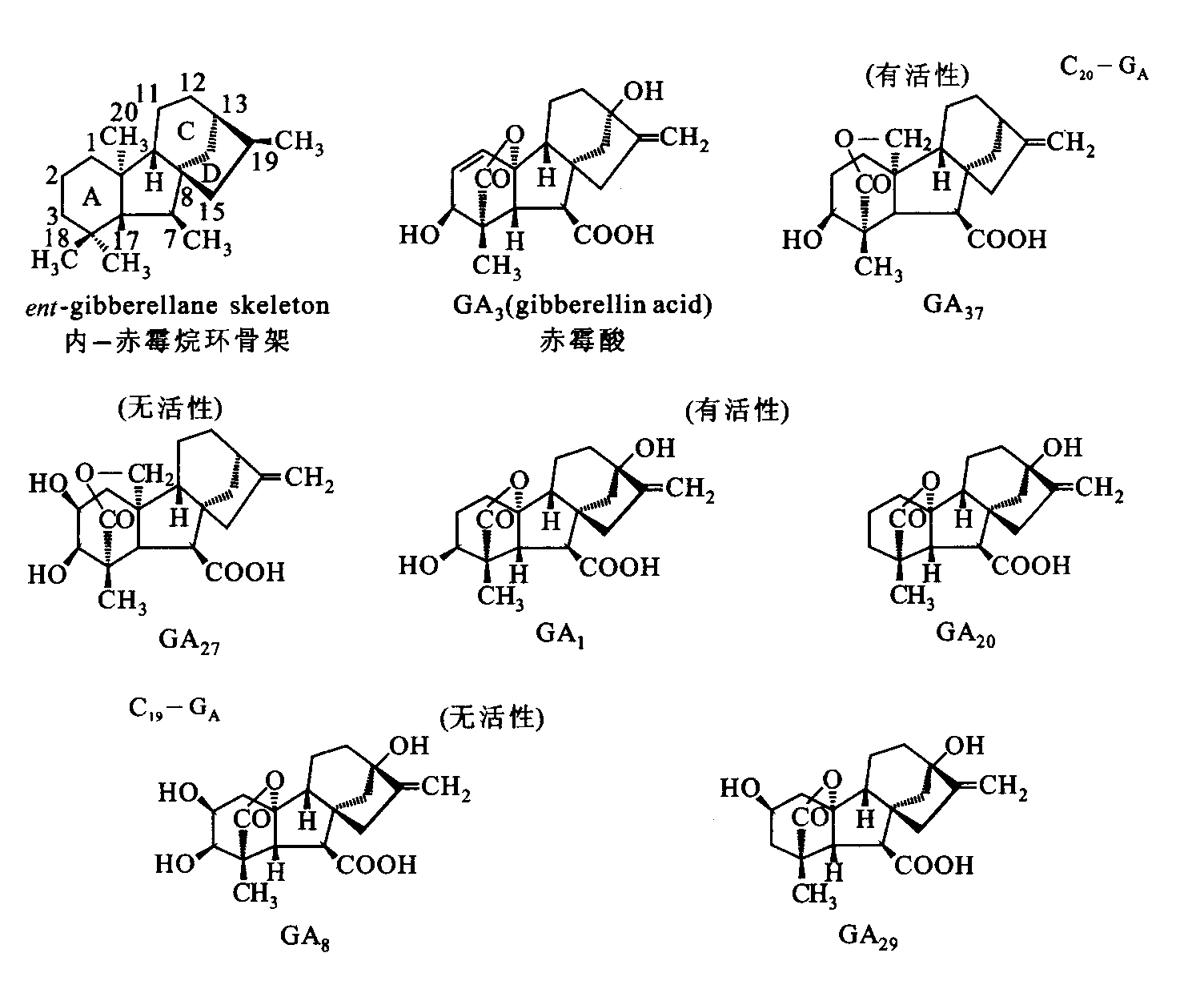 图6-13 赤霉烷环骨架和一些活性与非活性的GAs的化学结构(引自李合生,2002)。
图6-13 赤霉烷环骨架和一些活性与非活性的GAs的化学结构(引自李合生,2002)。
图中C19-GA包括有活性GA1和GA20,无活性的GA8和GA29;C20-GA有活性的GA37和无活性的GA27。
赤霉素有游离态赤霉素(free gibberellin)和结合态赤霉素(conjugated gibberellin)之分。结合态赤霉素是赤霉素和其他物质(如葡萄糖)结合形成赤霉素葡萄糖酯和赤霉素葡萄糖苷,它无生理活性,是一种赤霉素储藏和运输的形式。在植物不同发育时期,结合态赤霉素和游离态赤霉素可以相互转化。如在种子成熟时,游离态赤霉素不断地转化为结合态赤霉素而储藏起来;而在种子萌发时,结合态赤霉素通过水解或蛋白酶分解释放出具生物活性的游离态赤霉素,从而发挥其生理作用。
赤霉素广泛分布于被子植物、裸子植物、蕨类植物、褐藻、绿藻、真菌和细菌中。赤霉素和生长素一样,较多存在于植株生长旺盛的部位,如茎端、嫩叶根尖、果实和种子中。高等植物的赤霉素含量一般为1~1000ng/g鲜重,在根、茎等营养器官中仅1-10ng/g鲜重,而在果实和种子(尤其是未成熟的种子)等生殖器官中赤霉素可高达10000 ng/g鲜重。在同一植物中往往含有多种赤霉素,如在南瓜、菜豆种子中至少分别含有20种、16种赤霉素。甚至每个器官或组织都含有2种以上的赤霉素。而且赤霉素的种类、数量和状态(游离态或结合态)还因植物发育时期而异。
赤霉素在植物体内的运输没有极性,可以双向运输。根尖合成的赤霉素沿着导管向上运输,而嫩叶产生的赤霉素则向下运输。运输速度与光合产物运输速度相同,一般为50~100cm/h。不同植物差异很大,如矮生豌豆是5 cm/h,豌豆是2.1cm/h,马铃薯是0.42cm/h。
人工合成赤霉素从1986年开始,已合成出GA3、GA1、GA19等,但成本较高。目前生产上使用较多的GA3等仍然从赤霉菌的培养液中提取,成本较低。
在高等植物体内赤霉素的生物合成部位至少有3处:发育着的果实和种子、茎端和根部,其中发育着的果实和种子是赤霉素生物合成的主要部位。赤霉素在细胞中的合成部位是微粒体、内质网和细胞质可溶性部分等。
赤霉素是通过类萜途径合成的。其生物合成前体是牻牛儿牻牛儿焦磷酸(geranylgeranyl pyrophosphate , GGPP)。近来发现,植物细胞内的GGPP形成途径有两条:甲羟戊酸途径和非甲羟戊酸途径。(1)在线粒体、细胞质和内质网,GGPP是通过甲羟戊酸途径形成的。3分子的乙酰CoA形成一个C6-的甲瓦龙酸(又名甲羟戊酸)(mevalonic acid, MVA);MVA再通过加磷酸基团反应和脱羧反应形成一个异戊二烯焦磷酸(isopentenyl pyrophosphate, IPP);IPP与其异构体—二甲丙烯焦磷酸(dimethylallyl pyrophosphate, DMAPP)结合成为C10-中间产物牻牛儿焦磷酸(geranyl pyrophosphate, GPP);GPP与另一个IPP分子缩合为C15-法呢焦磷酸(farnesyl pyrophosphate, FPP,);FPP进一步与第3个IPP分子缩合为C20-中间产物牻牛儿牻牛儿焦磷酸(geranylgeranyl pyrophosphate, GGPP)。即3乙酰CoA→MVA→IPP→DMAPP→GPP→FPP→GGPP。(2)GGPP通过非甲羟戊酸途径主要是发生在质体中,如在叶绿体中IPP是由甘油醛-3-磷酸和丙酮酸缩合成5-磷酸木酮糖转化而成的。以后由IPP形成GGPP的过程与甲羟戊酸途径一样。
由GGPP合成GAs的过程大致可分为3个阶段(图6-14):
1、从GGPP合成内根-贝壳杉烯(ent-kaurene)。这些反应是在细胞质中进行的。在古巴焦磷酸合酶(copalyl pyrophosphate synthase, CPS)的催化下,GGPP环化形成古巴焦磷酸(copalyl diphosphate, CPP),后者在内根-贝壳杉烯合酶(ent-kaurene synthase, KS)催化下环化成为赤霉素的前身—内根-贝壳杉烯。
2、内根-贝壳杉烯氧化为GA12-醛(GA12-aldehyde)。这些反应是由一类存在于内质网膜上的CytP450的单加氧酶(monooxygenase)催化的,每步氧化过程需要O2和NADPH的参与。内根-贝壳杉烯氧化为内根-贝壳杉烯醇(ent-kaurenol)、内根-贝壳杉烯醛(ent-kaurenal)、内根-贝壳杉烯酸(ent-kaurenoic acid),内根-7a-贝壳杉烯酸(ent-7a-hydroxykaureoic acid),再到GA12-醛。
3、GA12-醛进一步氧化为不同的GAs。此过程是在细胞质中进行,因催化这一阶段有关的酶,如GA20-氧化酶、GA3β-羟基化酶和GA2β-羟基化酶都是细胞质中的可溶性酶。首先,把GA12-醛第7位碳上的醛基氧化成羧基,生成了GA12。这是重要的第一步,因为第7位碳上羧基为所有GAs所共有,亦为生物活性所必需。然后,GA12第20位碳上的甲基氧化成羟甲基,形成GA53。GA12和GA53分别在GA20-氧化酶(GA20-oxidase)、GA3β-羟基化酶(GA3β-hydroxylase)作用下,形成有生物活性的GA1、GA4。在这一过程的关键步骤是第20位碳原子逐步氧化,以丧失CO2的方式把GA20-GA转变为GA19-GA。GA1和GA4在GA2β-羟基化酶(GA2β-hydroxylase)作用下,转变为无生物活性的GA8、GA34。从GA12-醛转变为不同的GAs的途径因植物种类乃至植物的组织而异(图6-15)。
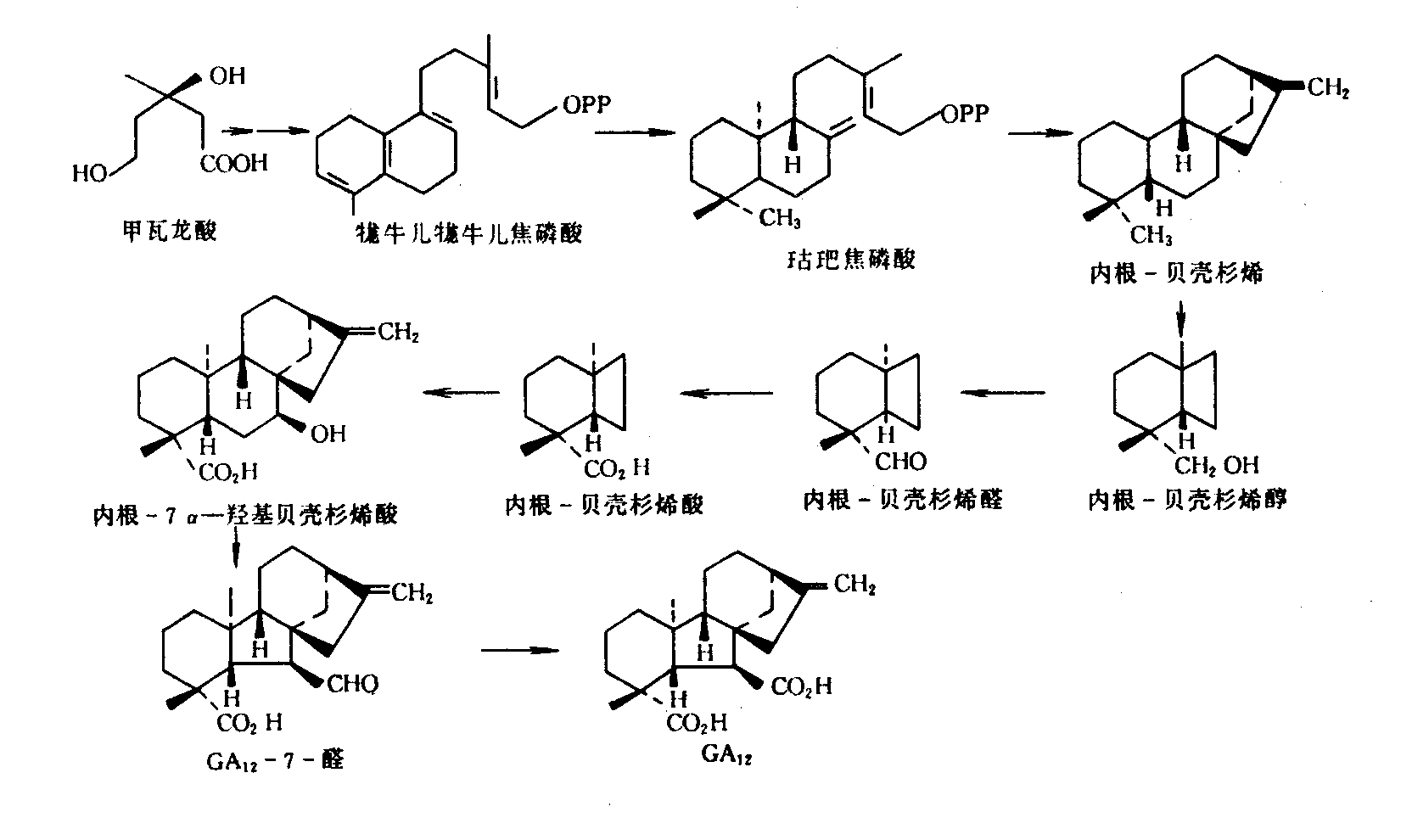 图6-14由甲瓦龙酸合成GA12的过程(引自潘瑞炽,2001)
图6-14由甲瓦龙酸合成GA12的过程(引自潘瑞炽,2001)
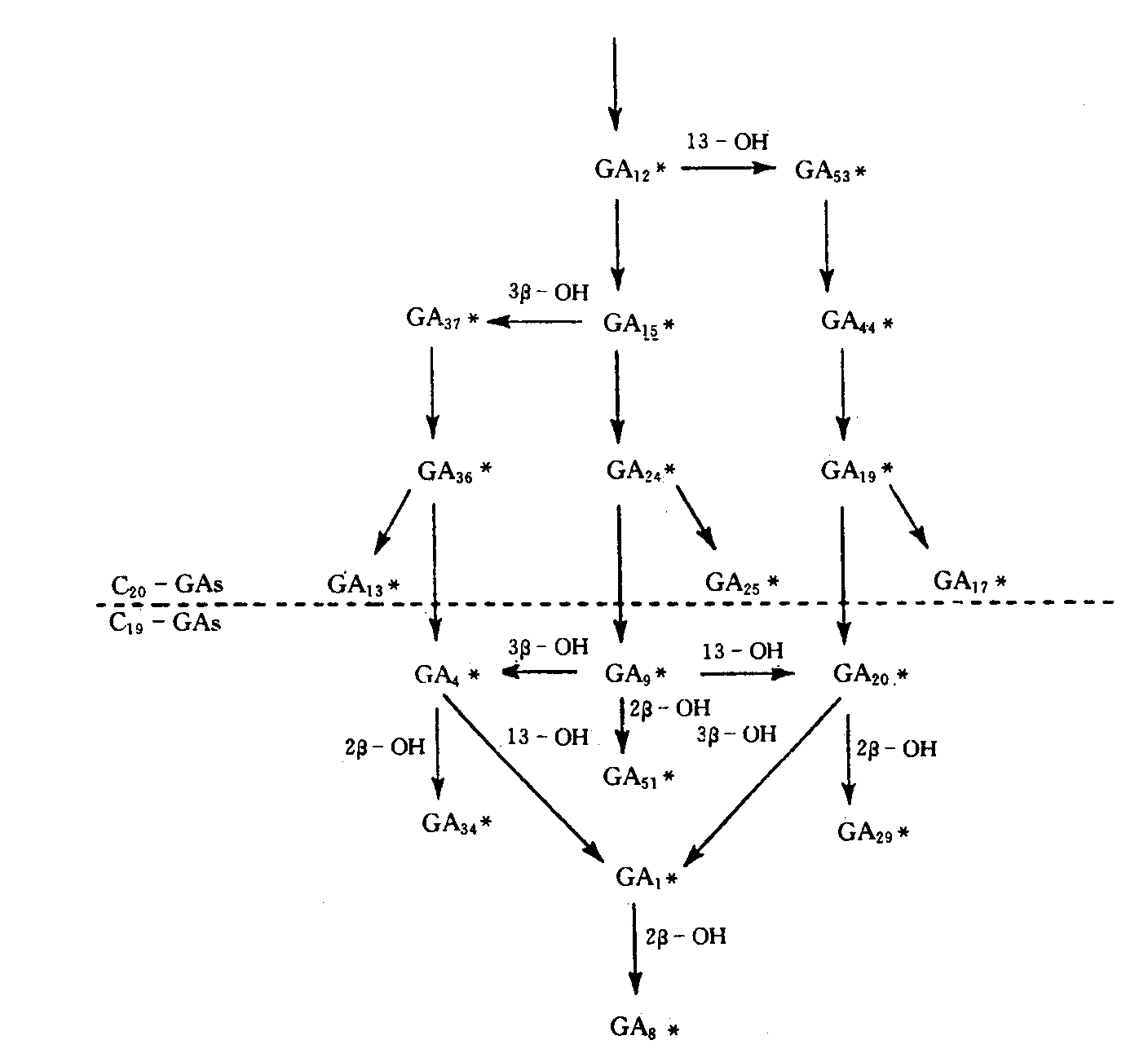
图6-15拟南芥的GA代谢(*代表内源GA)(引自余叔文,1999)
植物体内GAs的生物合成是一系列的酶促反应过程。所以,一方面可通过调控GA合成酶基因的表达,改变GA合酶的种类、含量来调节GAs生物合成。目前,已发现:(1)具有生物活性的内外源GAs能降低编码GA20-氧化酶和GA3β-羟基化酶基因的表达,从而对GA的生物合成起反馈调节作用。(2)光能影响GA20-氧化酶、GA3β-羟基化酶和GA2β-羟基化酶等基因的表达和翻译,也对GA生物合成也具有调节作用。另一方面,通过抑制酶的活性来调节GAs的生物合成。如催化GGPP环化形成内根—贝壳杉烯合成酶的活性能被AMO—1618、矮壮素(cycocel,CCC)、Phosphon—D和缩节胺(mepiquat chloride, pix)等化合物所抑制。由内根—贝壳杉烯形成内根—贝壳杉烯酸的氧化反应,是受内根—贝壳杉烯氧化酶催化的,此酶的活性被嘧啶醇(ancymidol)和多效唑(paclobutrazol,PP333)等三唑类化合物所抑制。这些化合物通过抑制合成过程有关酶的活性来抑制GAs的生物合成。因此,它们被称为植物生长延缓剂(plant growth retardant)或抗赤霉素(antigibberel1ins)化合物。
赤霉素能促进植物茎的伸长生长,尤其是对矮生突变品种的效果特别明显。用GAs处理能使节间的伸长加快,而不改变节间数。但对离体的茎切段的伸长没有明显的效果。外源施加赤霉素处理能使矮生植物长高早已得到证实。阻碍矮生植株伸长的原因是由于矮生植物内源GAs的生物合成受阻,使得体内GAs含量水平比正常品种低的缘故。如分析不同遗传型品系油菜,发现矮化品系茎内源GAs(GA1和GA3)含量只有正常品系的36%。在玉米中存在着30多种矮生型突变体,它们均表现为节间缩短的性状,成熟时植株的高度仅为正常植株的20-25%,实验发现其中的5个突变体(d1、d2、d3、d5和an1),在用赤霉素处理后呈现出与正常植株相似的高度。进一步研究发现,每个突变体控制着赤霉素生物合成途径中的一个酶,从而分别阻断了GA1生物合成途径中的不同的步骤。目前已有许多实验表明,GA1是矮生玉米、豌豆、油菜、大豆等植物茎伸长所需活性赤霉素,其他赤霉素可能先转化为GA1后起促进茎的伸长。
GAs促进茎伸长的生理作用,已在生产上得到广泛的应用。如在水稻“三系”的制种过程中,不育系往往包穗,影响结实率,若在主穗“破口”刚到见穗时喷施GAs,使节间细胞延长,可减少包穗率,提高制种产量。GAs还可提高叶茎类作物如芹菜、莴苣、韭菜、牧草、茶、苎麻等的产量。
在大麦种子吸胀之后12-14h,胚中释放出相当数量的赤霉素(赤霉素来自结合态的释出或重新合成的),通过胚乳扩散到糊粉层细胞,并诱导a-淀粉酶和蛋白酶等水解酶的合成(图6-16)。胚乳中不溶性的贮藏物质在这些水解酶作用下降解,并转化为可溶性的碳水化合物和氨基酸,为胚生长发育提供所需的物质和能量。所以用赤霉素处理种子能促进萌发,如GAs缺乏型拟南芥突变体的种子,因缺内源GAs而不能萌发,外源GA4和GA7处理能显著促进萌发,处理溶度达10µmol/L以上时,萌发率可达100%。
赤霉素诱导a-淀粉酶的形成,已被应用在啤酒生产中。用GA处理萌动而未发芽的大麦种子,可诱导糊粉层a-淀粉酶的产生,使胚乳物质糖化,发酵生产啤酒。这种处理不仅可大大降低大麦发芽所消耗的大量养分(约占原料大麦干重的10%),还可节省人力和设备,并且缩短生产周期,从而降低成本。

图6-16 GA诱导大麦种子糊粉层细胞a-淀粉酶生成(引自曾广文等,2000)
a.由胚释放GA进入糊粉层 b.在糊粉层细胞GA诱导a-淀粉酶生成 c.由糊粉层内释放出a-淀粉酶进入胚乳 d. a-淀粉酶将淀粉分解为麦芽糖及进一步分解为葡萄糖 e.单糖分子合成为双糖分子-蔗糖运入胚芽鞘及胚根等部位供胚生长发育需要
赤霉素除了具有促进茎的伸长和诱导水解酶的合成外,赤霉素还能影响花的形成,表现在诱导开花和控制性别两方面。某些二年生植物如甘蓝、油菜、萝卜等,要求长日照和低温才能抽苔开花。若用赤霉素处理可以代替上述环境因子的作用,促使这类植物抽苔开花。GAs在性别分化方面主要是促进雄花的形成,如在黄瓜等葫芦科植物花芽分化初期施用GAs能促进雄花的发育,而施用GAs合成抑制剂则有促进雌花发育的趋向。GAs和生长素一样,促进某些植物座果和单性结实,这已在梨、杏、草莓、葡萄等植物上得到证实,但对不定根的形成却起抑制作用,这与生长素作用有所不同。此外,GAs还有延缓衰老与成熟等生理作用。
大量研究表明赤霉素的受体位于细胞质膜上。cGMP、G蛋白、Ca2+/CaM、三磷酸肌醇(IP3)及蛋白质磷酸酶(PP1和PP2A)都不同程度参与了GA响应的信号传导过程。信号通过信息传递途径到达细胞核,调节细胞延长和蛋白质形成。
植物茎伸长是与组成茎的细胞数目的增加及细胞伸长有关。所以GA显著促进茎的伸长可能与增加细胞分裂、促使细胞壁松弛和增加细胞渗透吸水有关。
实验表明GA能促进莲座天仙子等一些长日植物的细胞分裂,主要是GA促进G1期细胞进入S期以及相应缩短了S期,从而缩短了细胞分裂间期,促进DNA的合成。
近年大多数研究都认为,GA促进茎伸长主要是与细胞壁的伸展性有关。至于如何改变细胞壁的伸展性,目前有不同的解释。一种认为:GA是通过降低细胞壁Ca2+的水平来促进细胞的伸长生长。Moll等(1981)报道,用CaCl2处理过的莴苣下胚轴生长变慢,当加
 图6-17 CaCl2和GA3对莴苣下胚轴生长速度的影响
图6-17 CaCl2和GA3对莴苣下胚轴生长速度的影响
入50µmol/L GA3后生长速度增快(图6-17)。所以GA促进茎伸长的作用可能与刺激Ca2+从细胞壁释放有关。在细胞壁中,Ca2+是与细胞壁聚合物交叉点的非共价离子结合在一起的,因此Ca2+使细胞壁不易伸展而制约细胞伸长。GA能使细胞壁内的Ca2+移开并进入细胞质,使细胞壁Ca2+水平下降,结果细胞壁伸展性加大,细胞生长加快。另一种认为:GA是通过影响细胞壁结构而控制植物伸长生长。即GA通过降低细胞壁内过氧化物酶的活性,来阻止细胞壁硬化,增加细胞壁的伸展性;GA通过提高木葡聚糖内转糖基酶(xyloglucan endotransglycosylase ,XET)活性,增加细胞壁组成分木葡聚糖的含量,从而使细胞延长。
赤霉素对RNA和蛋白质影响的研究,一般以禾谷类的种子为材料。提取有活性的糊粉层细胞及其原生质体作为实验对象,已成为分子和基因水平研究激素的通用模式系统。研究表明:GA的处理诱导a-淀粉酶的重新合成(GA诱导大麦离体糊粉层细胞内新合成的蛋白质中,a-淀粉酶的比例可高达70%),主要是增加细胞的a-淀粉酶总mRNA数量,也即是增加a-淀粉酶基因的转录速率。如用大麦糊粉层细胞核进行转录实验,在GA3处理后1-2h内,a-淀粉酶mRNA含量开始增加,20h达到高峰,其含量是对照的50倍。这说明赤霉素促进a-淀粉酶形成主要来自新产生的mRNA的翻译的结果,并且GA还能在一定程度上增强翻译水平,产生a-淀粉酶(图6-18)。
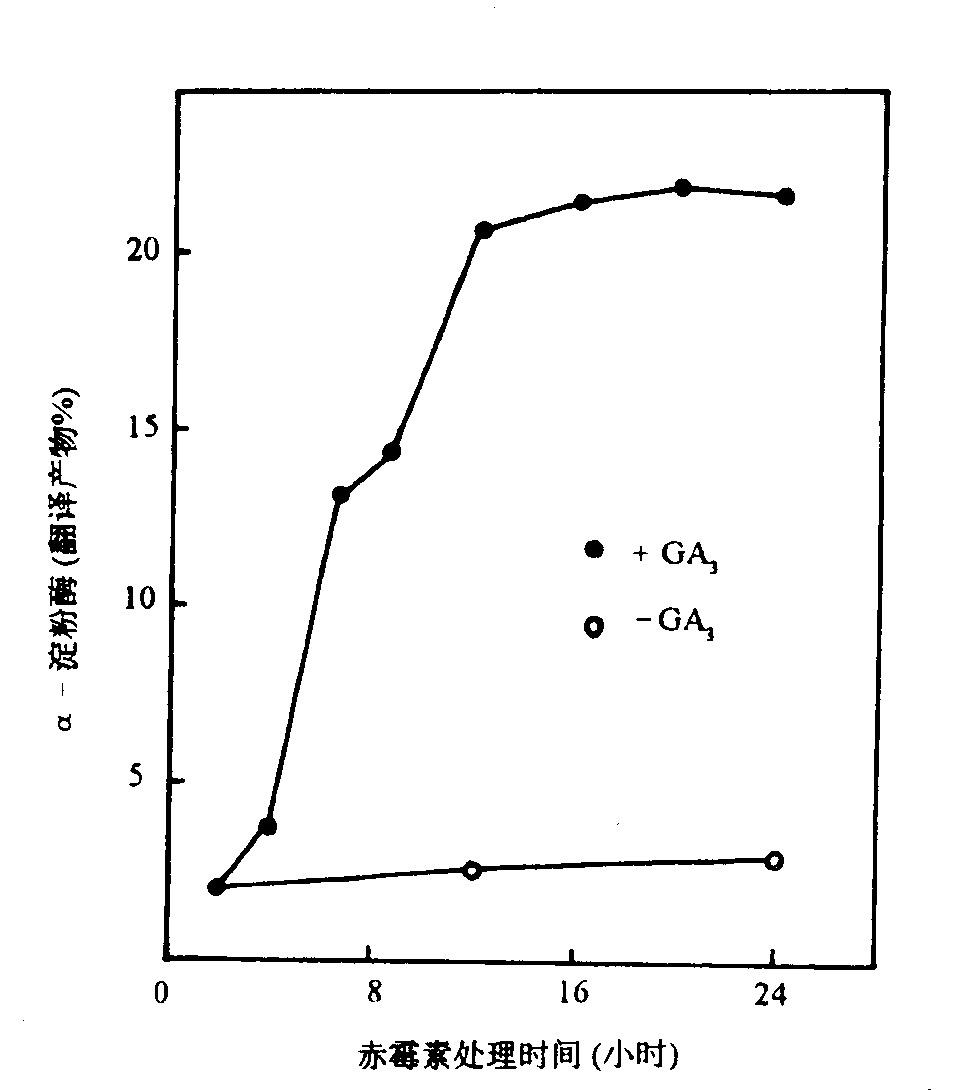 图6-18 GA3处理时间与大麦种子糊粉层a-淀粉酶mRNA翻译能力的关系
图6-18 GA3处理时间与大麦种子糊粉层a-淀粉酶mRNA翻译能力的关系


