2.2植物细胞对矿质元素的吸收
2 mineral element uptake of plant cell.ppt(下载附件 7.4 MB)
中文课件:
生物膜的特性
能斯特方程及对运输方式的判定
被动运输
主动运输
植物细胞是构成植物体的基本单位。生命活动主要是在细胞内进行的。因此,要了解植物体对矿质元素的吸收,必须首先了解植物细胞对矿质元素吸收的机理。植物细胞所吸收的矿质元素来自于细胞生存的环境,此环境可以是植物生存的外部环境(如土壤),也可以是植物体的内部环境,即一个细胞的周围环境组织。植物对矿质元素的吸收主要是通过对矿质离子的吸收来实现的。矿质离子通常作为重要的溶质(solute)存在于环境溶液中和组织质外体溶液中。由于细胞与其环境之间以细胞膜相隔,物质交流必须通过细胞膜(特别是质膜)来进行。因此从一定意义上讲,细胞对矿质元素的吸收,主要与溶质的跨膜运输(transport across membrane)有关。由于矿质离子都是带电荷的,不能通过膜脂双分子层自由扩散,所以矿质离子的跨膜运输都是由膜转运蛋白(membrane-bound translocating proteins)完成的。近年来,由于分子生物学等学科迅速发展,植物细胞中大部分离子膜转运蛋白的基因已克隆,某些转运蛋白(K+通道蛋白、Ca+转运体)等的结构及调控特性也比较清楚。植物细胞对矿质元素的吸收方式可分为被动吸收(passive absorption)、主动吸收(active absorption)和胞饮作用(pinocytosis)三种类型。其中胞饮作用不太普遍,因此溶质的跨膜运输主要通过被动吸收和主动吸收进行,溶质分子跨膜运输的几种方式总结于图2-2。
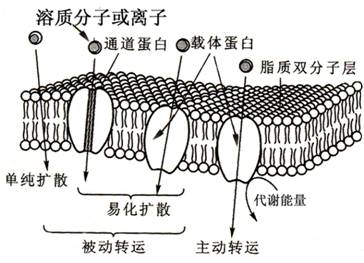
图2-2溶质跨膜转运的几种方式
被动吸收(passive absorption)是指细胞对溶质的吸收是顺电化学势梯度进行的,这一过程不需代谢能量的直接参与。主要包括单纯扩散和易化扩散,后者又包括通道运输和载体运输。
溶液中的溶质从浓度较高的区域跨膜移向浓度较低的邻近区域即为单纯扩散(simple diffusion)。因此,当外界溶液的浓度高于细胞内部溶液的浓度时,外界溶液中的溶质就会扩散入细胞内部。当细胞外内的浓度差(浓度梯度)大时,细胞便大量地吸收物质,但随着浓度差变小,吸收也随之减小,直至细胞外内浓度达到平衡为止。所以,细胞外内浓度梯度是单纯扩散中的主要决定因素。单纯扩散符合斐克定律(Fick's law),即某物质的扩散速率与该物质的浓度梯度成正比。
膜中的脂质是扩散途径中的主要障碍。脂溶性较好的非极性溶质能够较快地通过膜。O2、CO2、NH3均可以单纯扩散方式穿过膜的脂质双分子层。带电荷的离子不能通过单纯扩散方式通过脂质双分子层,但可以通过通道蛋白等进行扩散转运。
易化扩散(facilitated diffusion)是溶质通过膜转运蛋白顺浓度梯度或电化学势梯度进行的跨膜转运。参与易化扩散的膜转运蛋白主要有通道蛋白(channel)和载体蛋白(carrier)。
在易化扩散中,不带电荷的溶质传递的方向取决于溶质的浓度梯度,而带电荷的溶质(离子)传递的方向则取决于溶质的电化学势梯度。与单纯扩散一样,易化扩散可以双向进行,当跨膜双向传递的速率相同时,净转移就会停止。两者最终都不会导致溶质逆电化学势梯度积累。
1.通道蛋白 通道蛋白简称通道(channel)或离子通道(ion channel)。其构象可随环境条件的改变而改变。在某些构象时,其中间会形成允许离子通过的孔,孔内带有表面电荷并填充有水。孔的大小及孔内表面电荷等性质决定了通道转运离子的选择性,即一种通道通常只允许某一离子通过。离子的带电荷情况及其水合规模(hydrated size)决定了离子在通道中扩散时通透性(permeablity)的大小。通过通道进行的扩散依赖于离子的水合规模是由于与之相关联的水分子必须与离子一起扩散。所有的通道蛋白均有使离子通过易化扩散的方式进行传递的功能。因此,由通道进行的转运是被动的。离子通过离子通道扩散的速率在106个﹒S-1以上,甚至可高达108个﹒S-1。
通道蛋白往往是有“门(gate)”的。它有“开”和“关”两种构象。只有在“门”开的情况下离子才可以通过它。根据“门”开关的机制,可将离子通道分成两种类型:一类对跨膜电势梯度产生响应,另一类对外界刺激(如光照、激素等)产生响应。通道蛋白中还包括感受器(sensor)或感受蛋白(sensor protein),它可能通过改变其构象对适应刺激作出反应并引起“门”的开和关。但通道“门”开关的确切机制尚不清楚。
图2-3是一个离子通道的假想模型:跨膜的内部蛋白中央的孔道允许离子(K+)通过。在这里,K+顺电势梯度(由于质膜质子泵产生的细胞质侧过量的负电荷)逆其浓度梯度从通道左侧移向右侧。感受蛋白可对细胞内外由光照、激素或Ca2+引起的化学刺激作出反应。通道上的“门”可以通过某种方式对膜两侧的电势梯度或由环境刺激而产生的化学物质作出开或关的反应。
膜片钳技术(patch clamp technique)是目前研究离子通道的主要手段。离子的跨膜转移会产生(10-12A)级的电流,此电流可以用膜片钳技术进行检测。膜片钳技术是指用玻璃微电极测量通过膜的离子电流大小的技术。这一技术的应用极大地推动了人们对离子通道特性的研究。该技术的要点是:用酶解法去除细胞壁,或用激光去除部分细胞壁。用一个尖端被热抛光、直径约为1mm的玻璃微电极压向膜表面。在电极
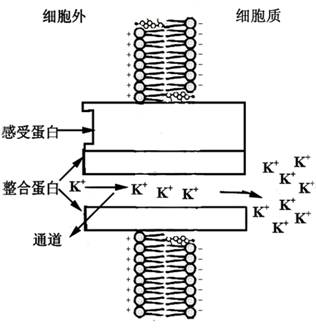
图2-3离子通道的假想模型
玻璃管内施加吸力使膜紧贴电极尖端。与电极尖端紧密接触的小块膜部分即所谓的“片(patch)”。电极抽出时可探截此“膜片”并可根据需要制成内向外(inside-out)或外向外(outside-out)的模型(图2-4)。电极玻璃管内可装入已知的盐浓度。将电极接到高分辨率的放大器上,并按照预先确定的值控制或“钳住(clamp)”跨膜电势差(电压),同时记录通过膜的电流,并以此分析离子通道开关的情况(图2-5)。在此技术中,电极尖端足够小(如直径1mm)时,所探截的膜可能含有单一的离子通道。由于离子通道在生命活动有广泛而深刻作用,因此发明膜片钳技术的E.Nehler和B.Sakmann荣获1991年诺贝尔医学生理奖。
应用膜片-钳位技术,现已了解到质膜上存在有K+、Cl-和Ca2+通道。从有机离子跨膜传递的事实看,质膜上也存在着供有机离子通过的通道。在液泡膜(tonoplast)上也有相应的离子通道。
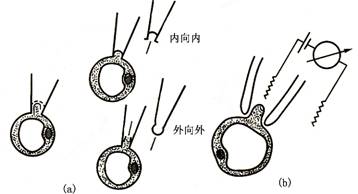
图2-4膜片钳位技术示意图
(a).膜的探截和制备;(b).接到电讯号放大仪上
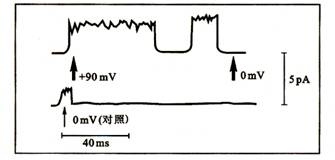
图2-5离子测定示意图
图示保卫细胞质膜上K+通道被90 mV脉冲电流所激活
注意:脉冲电流结束前通道有一短暂的关闭与开启。0 mV为对照
除了用膜片钳技术对离子通道进行电生理学研究外,随着分子生物学及分离纯化技术的发展,人们对某些离子通道蛋白(如K+通道)的基因调控、蛋白质氨基酸序列及活性调节机理等均有了一定了解,图2-6为植物内向整流K+通道蛋白(AKT)结构模型。靠近N末端有6个跨膜结构域(S1至S6),靠近C末端有核苷酸结合序列(NB)和类锚蛋白(ankyrin-like)结构域(ANK),S4为电压感受器,其特征是含有几个带正电荷的氨基酸残基。P-结构域或称H5为通道蛋白的进口在离子透过及选择性方面起关键作用。
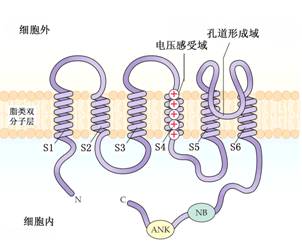
图2-6植物K+通道(AKT1)结构模型(依据Buchanan等,2000)
2.载体蛋白 载体蛋白又被称为载体(carrier)、传递体(transporter或porter),有时也称其为透过酶(permease或penetrase)或运输酶(transport enzyme)。由载体转运的离子与载体蛋白有专一的结合部位,因此载体能选择性地携带离子通过膜。载体蛋白对被转运物质的结合及释放,与酶促反应中酶与底物的结合及对产物的释放情况相似。载体对被转运物质的亲和力是会发生变化的。细胞内某溶质的浓度增大(或降低)时,载体与该溶质的亲和力会反馈性地减小(或增大),这可表现在Km值的增大(或减小)上。另外,载体的数量也会改变,这就使最大转运速率(Vmax)发生变化。通过这些机制,当外界溶质的浓度有较大波动时,细胞可以维持其内部溶质浓度的稳定。
由载体进行的转运可以是被动的(顺电化学势梯度进行,参与协助扩散),也可以是主动的(逆电化学势梯度进行,参与主动转运)。由于经载体进行的转运依赖于溶质与载体特殊部位的结合,而结合位的数量有限,所以有饱和效应(saturation)(图2-7)。载体对所转运物质具有相对专一性,因此还表达出竞争性抑制。饱和效应和竞争性抑制可作为载体参与离子转运的有利证据。载体蛋白转运离子的速率约为104~105个·S-1,比离子通道的转运速率低,但选择性一般比通道蛋白高。载体可分三种类型:单向转运体(uniporter),把所转运物质从膜一侧转运至另一侧,其特点是单一方向转运一种物质,(Fe2+、Zn2+、Mn2+和Cu2+等载体);同向转运体(symporter)或协同转运体(coporter),往往H+顺电化学梯度从膜的一侧转运至膜的另一侧的同时把另一物质转运到同一侧,其特点是同时向同一方向转运两种物质(如NO3-、NH4+、PO43-、SO42-和蔗糖等载体);逆向转运体(antiporter),一般是把某物质顺其电化学势梯度从膜一侧转运至另一侧的同时把另一种物质逆方向且逆电化学势梯度转运至膜的另一侧,如质膜上Na+/H+antiporter,利用质膜H+-ATPase建立的跨膜H+电化学势梯度把Na+从细胞质中逆电化学势梯度运至细胞外,这种逆浓度转运属于次级主动转运。三种类型载体运输总结于图2-8。
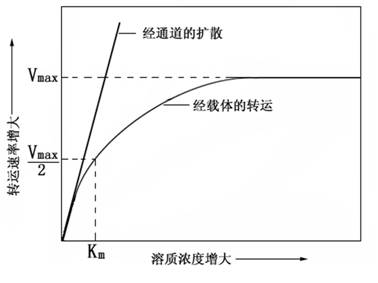
图2-7离子通过通道或载体转运的动力学分析
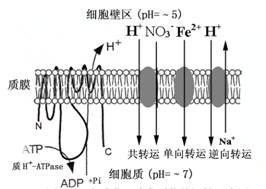
图2-8跨质膜三种类型载体运输示意图
主动吸收(active absorption)是指植物细胞利用代谢能量逆电化学势梯度吸收矿质的过程。主动吸收包括初级主动吸收和次级主动吸收两种形式。
初级主动吸收(primary active absorption)是指植物细胞直接消耗ATP或PPi(无机焦磷酸)逆浓度转运溶质的过程。初级主动吸收的膜转运蛋白又称泵(pump)。植物细胞膜上的泵主要有质子泵(proton pump)和离子泵(ion pump),为膜结合的ATP酶或焦磷酸(pyrophosphatase),功能是利用其水解ATP或PPi(焦磷酸)释放的能量用于H+或无机离子的逆浓度跨膜转运。由于ATP酶和焦磷酸酶逆电化学势梯度主动转运阳离子导致膜内外正负电荷分布不一致,进而形成跨膜电势差,所以这类泵又称电致泵(electrogenic pump)。这类电致泵主要有质膜H+-ATP酶、液泡膜H+-ATP、液泡膜H+-焦磷酸酶和膜结合的转运阳离子的ATP酶(Ca2+-ATP酶和Mg2+-ATP酶等)。
1.质膜H+-ATP酶 质膜H+-ATP酶是植物生命活动的主宰酶(master enzyme),对植物的许多生命活动起着重要的调控作用,其主要功能是在细胞质一侧水解ATP同时把细胞质中H+泵至细胞外,形成跨膜H+电化学势梯度,又称质子驱动力(pmf:proton motive force =ΔpH +ΔΨ)。pmf包括跨膜电势梯度(ΔΨ)(即细胞质膜内侧电位负值,外侧电位正值)和跨膜H+浓度梯度(质膜外浓度高,细胞质一侧质子浓度低)。跨质膜的pmf是植物细胞矿质元素等溶质进行跨膜次级主动转运的主要驱动力。因此,质膜H+-ATP酶对矿质元素的吸收、细胞质pH恒定的维持、细胞的生长和植物对环境因子的响应等有广泛而深刻的作用。质膜H+-ATP酶分子量约100 kDa单一多肽,其N末端和C末端均在细胞质侧,C末端为自抑制区末端,Fusicoccin(克梭孢菌素)和
2.液泡膜质子泵,液泡膜有两种类型质子泵:一是液泡膜H+-ATP酶(V-H+-ATP酶),二是液泡膜H+-焦磷酸酶(V-H+-pyrophosphatase),它们分别水解细胞质中的ATP和PPi把细胞质中H+的逆电化学势梯度泵入液泡中,建立跨液泡膜的质子驱动力(pmf),从而驱动溶质的跨液泡膜的次级主动转运。液泡膜H+-ATP酶为多亚基复合体,类似于线粒体和叶绿体的F-ATP酶,为头柄结构,分为细胞质一侧的V1部分和膜中的V0部分,约有8~10亚单位,分子量约为650 kDa(图2-9)。其底物为Mg2+-ATP,最适pH为7.5~8.0,Cl-、Br-和I-等阴离子对其活性有激活作用,其专一性抑制剂为Bafilomycin A1、concanamycin C和NO3-,每水解1分子ATP泵2~3 H+。液泡膜H+-焦磷酸酶为单一多肽,分子量约为69~80 kDa,K+为其激活剂,但受Na+抑制,每水解1分子PPi泵1个H+(图2-9)。应注意,在线粒体膜和类囊体膜中存在的H+-ATP酶,虽然结构与液泡膜H+-ATP酶相似,但功能正好相反,即利用光合电子传递和氧化电子传递过程中产生跨膜H+梯度合成ATP。此外,内质网和高尔基体膜中也存在H+-ATP酶。
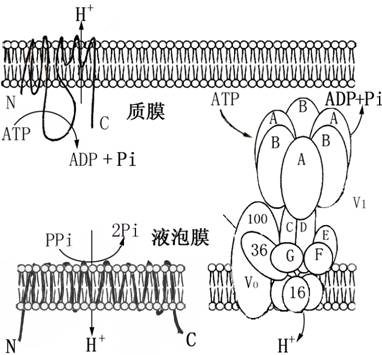
图2-9植物细胞质膜H+-ATP酶(上),液泡膜H+-焦磷酸酶(左下)
和液泡膜H+-ATP酶(右下)的结构示意图(引自H.Sze等,1999)
3.离子泵(ionic pump)植物细胞膜中转运阳离子的ATP酶主要有Ca2+-ATP酶、Mg2+-ATP酶。其中Ca2+-ATP酶有两种类型:ⅡA型Ca2+-ATP酶(内质网型)主要分布于内质网膜上,ⅡB型Ca2+-ATP酶(质膜型)主要分布于质膜上、液泡膜上。两者主要区别是ⅡA型Ca2+-ATP酶受钙调素(CaM)激活,而ⅡB型Ca2+-ATP酶则否。Ca2+-ATP酶分子量约为110 kDa,最适pH 7.0~7.5,其主要功能是水解ATP把细胞质中Ca2+逆浓度泵出细胞外或泵入液泡和内质网等Ca2+库,从而维持细胞质中Ca2+稳态(homeostasis:0.1μM~1μM),而Ca2+由胞外或Ca2+库进入细胞质是通过Ca2+通道顺电化学势梯度进行的。由于Ca2+是重要的信号物质,所以Ca2+-ATP酶在植物生命活动中的作用越来越受到人们的重视。
关于ATP酶转运阳离子的分子机制目前尚没有完全研究清楚。图2-10是ATP酶主动转运阳离子的可能机制,其主要点是通过ATP的结合与水解,改变酶的构象,利用ATP水解释放的能量主动转运阳离子。
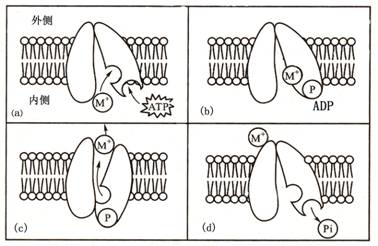
图2-10ATP酶逆电化学势梯度转运阳离子的示意图
a,b.酶与细胞内的离子结合并被磷酸化;c.磷酸化导致酶的构象
改变,将离子暴露于外侧并释放出去;d.释放Pi,恢复原构象
阴离子的跨膜转运既可以通过载体运输,也可以通过通道运输,各种溶质通过植物细胞质膜、液泡膜和叶绿体膜的转运总结于图2-11。
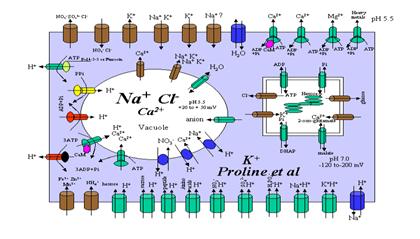
图2-11各种溶质通过质膜、液泡膜和叶绿体膜转运图解(王宝山,2002)
细胞可以通过质膜吸附物质并进一步通过膜的内陷、分离和溶解等步骤将物质转移到胞内,这种吸收物质方式称为胞饮作用(pinocytosis,简称为胞饮)。胞饮作用属于非选择性吸收方式,因此,包括各种盐类、大分子物质甚至病毒在内的多种物质都可能通过胞饮作用而被植物细胞吸收。这就为细胞吸收大分子物质提供了可能。胞饮作用不是植物吸收矿质元素的主要方式。
胞饮的过程是:物质被质膜吸附时质膜内陷,物质便进入凹陷处,随后,质膜内折,逐渐将物质围起来而形成小囊泡。小囊泡向细胞内部移动,囊泡本身慢慢溶解消失,物质便留在胞内,或者小囊泡一直向内移动至液泡膜,最后将物质送到液泡内。


