6. Plant growth substances
中文课件:
内容提要植物生长物质是指调节植物生长发育的物质,包括植物激素和植物生长调节剂。目前被公认的植物激素有五类:生长素类、赤霉素类、细胞分裂素类、乙烯和脱落酸。
生长素在高等植物中分布很广,并有极性运输的特点。它具有促进细胞的伸长和分裂,促进根系形成和生长,抑制器官脱落,保持植株顶端优势等作用。生长素的作用机理有酸生长学说和基因活化学说。
赤霉素现已发现有127种,最常见的是GA3。赤霉素具有加速细胞的伸长生长,促进细胞分裂,诱导水解酶合成,促进开花和控制性别等作用。赤霉素的作用机理是促进RNA和蛋白质的合成,降低细胞壁中的Ca2+水平,从而使细胞伸长。
细胞分裂素是促进细胞分裂的植物激素。根尖是它主要合成部位。细胞分裂素具有促进细胞分裂与扩大,促进芽的分化与发育,延缓衰老以及促进营养物质运输等作用。细胞分裂素的作用机理是促进RNA和蛋白质的合成。
乙烯是一种气态型的植物激素。它具有促进器官脱落,促进果实成熟、促进细胞扩大,促进菠萝等凤梨科植物开花,促进次生物质排放等作用。乙烯的作用机理是促进核酸和蛋白质的合成。
脱落酸是一种抑制生长发育的物质。它具有促进气孔关闭,促进休眠,促进器官脱落,提高抗逆性等作用。脱落酸的作用机理是抑制核酸和蛋白质的合成。
植物体内各种激素同时存在,它们的生理效应有相互促进,也有相互拮抗。通过激素间的这这种相互作用,共同对植物生长发育方向起调节调控作用。
植物生长物质(plant growth substances)是指一些能调节植物生长发育的微量化学物质,它包括植物激素和植物生长调节剂。植物激素(plant hormones,或phytohormones)是指一些在植物体内合成,并从合成部位运往作用部位,对生长发育产生显著调节作用的微量(1μmol/L以下)有机物质。植物生长调节剂(plant growth regulators)通常是指人工合成的具有类似植物激素生理活性的化合物。
植物激素研究始于20世纪30年代的生长素(auxin)分离,50年代确定了赤霉素(gibberellins, GAs)和细胞分裂素(cytokinins, CTKs),60年代后又发现了脱落酸(abscisic acid, ABA)和乙烯(ethylene)。目前公认的植物激素有5大类,即生长素类、赤霉素类、细胞分裂素类、乙烯和脱落酸。近年来,人们在植物体内陆续又发现了一些能对植物生长发育起调节作用的物质,如油菜素内酯(brassinolide, BR)、多胺(polyamines, PAs)、茉莉酸(jasmonic acid, JA)、水扬酸(salicylic acid, SA)等。
随着植物激素研究的深入和农林业生产的需要,人们合成并筛选出了多种植物生长调节剂。一类为分子结构和生理效应与植物激素类似,如吲哚丙酸、吲哚丁酸等;另一类为结构与植物激素完全不同,但具有植物激素类似生理效应的有机物,如奈乙酸(NAA)、矮壮素(CCC)、三碘苯甲酸(TIBA)、乙烯利(ethrel)、多效唑(paclobutrazol, PP333或MET)等。植物生长调节剂能在低浓度下对植物生长发育表现出明显的促进或抑制作用,它们已被广泛应用在促进种子萌发、促进生根、促进开花、控制性别、促进结实、疏花疏果、延缓衰老和防止脱落等方面。
6.1生长素类
生长素是最早被发现的植物激素。生长素的发现是通过对禾本科植物胚芽鞘生长的研究开始的。英国著名科学家Charles Darwin(1880)和他的儿子Francis Darwin从金丝雀虉草(Phalaris canariensis)胚芽鞘向光性试验中发现:如果在单方向光照射下,胚芽鞘向光弯曲;如果切去胚芽鞘的尖端或在尖端套以不透光的锡箔小帽,单侧光照不会使胚芽鞘向光弯曲;如果单侧光只照射胚芽鞘尖端而不照射胚芽鞘下部,胚芽鞘仍会向光弯曲(图6—1a)。因此,他们认为胚芽鞘产生向光弯曲是由于幼苗在单侧光照射下产生某种
 图6-1生长素发现的一些关键性试验(引自曾广文等,2000)
图6-1生长素发现的一些关键性试验(引自曾广文等,2000)
影响,并将这种影响从上部传到下部,造成背光面和向光面生长速度不同。 丹麦的Boysen- Jensen(1913)分别在燕麦胚芽鞘迎光面或背光面,在芽鞘尖端和以下部分间横向插入深度为横断面一半的云母片,结果发现只有当云母片从背光面插入时,胚芽鞘才丧失向光性。如果将胚芽鞘尖端切下,在胚芽鞘切口上放一明胶薄片后再将切下的胚芽鞘尖端重新放上,其向光性仍能发生(图6—1b)。匈牙利的Paal(1918)发现,将燕麦胚芽鞘尖端切下后再将它放在芽鞘切口的一侧,即便在黑暗下也会使胚芽鞘弯曲(图6—1c)。以上两组试验证实了Darwin所谓的影响是某些物质的传递,即胚芽鞘向光弯曲现象可能是植物体内产生的可以通过明胶片的微量化学物质引起的。
荷兰的F. W. Went(1928)第一次成功地从燕麦胚芽鞘中分离到这种物质。他把燕麦胚芽鞘尖端切下,放在琼脂薄片上,约1h后,移去芽鞘尖端,将琼脂切成小块,再把这些琼脂块放在去顶的胚芽鞘一侧,置于暗中,胚芽鞘就会向放琼脂块的对侧弯曲,但放纯琼脂块,则不会弯曲(图6—1d)。这证明了琼脂块中有自芽鞘尖端扩散下来的某种促进生长的物质,因此琼脂块能与芽鞘尖端具有同样的作用。Went称该物质为生长素(auxin)。根据这一原理,他创立了生长素生物鉴定法——燕麦试法(Avena test),即用低浓度的生长素处理燕麦芽鞘的一侧,引起这一侧的生长速度加快,从而使芽鞘向另一侧弯曲,其弯曲度与所用的生长素浓度在一定范围内成正比。此法可定量测定生长素含量,这推动了对生长素在植物体内的分布和含量的检测,以及筛选植物生长调节剂的研究。1934年荷兰的F. Kögl等从人尿中提取并分离到了这种物质,经鉴定为吲哚乙酸(indole-3- acetic acid,IAA),其分子式为C10H9O2N,分子量为175.19。1942年Haagen-Smit等才从碱性水解的玉米粉和未成熟的玉米籽粒中分别提取到了IAA。因IAA是高等植物中最早发现并普遍存在的一种重要的生长素,习惯上常把生长素与IAA两个名词混用,即IAA成了生长素的代名词。
6.1.2生长素的种类及其化学结构
现已证明,植物体内生长素类物质以IAA最为普遍,它存在于细菌、真菌、藻类、蕨类和种子植物中。除IAA外,植物体内还有其他生长素类物质。如4-氯-3-吲哚乙酸(4-chloroindole-3- acetic acid,4-Cl-IAA)存在于豌豆、山黧豆等豆类未成熟的种子中;苯乙酸(phenylacetic acid, PAA)存在于蕃茄、烟草等一些作物中,其生理活性比IAA低的多,但在植物中也广泛分布,含量比IAA更丰富;吲哚丁酸(indole butyric acid,IBA)最初被认为只是一种人工合成的物质,但近年来已从玉米和其他植物的种子和叶片中被提取出来,因此它也很可能广泛分布在植物界(图6—2)。
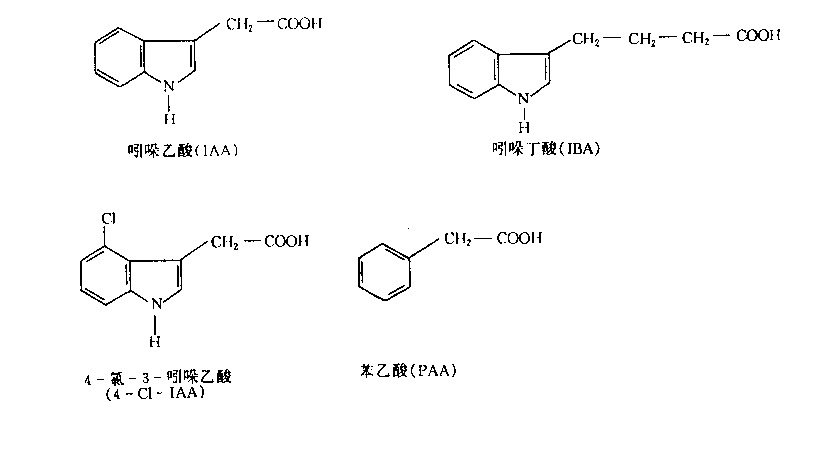
图6-2几种内源生长素
利用生长素的生物鉴定法,不仅可以研究植物体内各部分生长素的分布和含量,同时还可以从人工合成的一些有机物中筛选出与生长素有类似生理效应,甚至有的活性还比生长素大几百倍的植物生长调节剂。最早被发现的是吲哚丙酸(indole propionic acid, IPA)和吲哚丁酸(indole butyric acid, IBA),它们和吲哚乙酸一样都具有吲哚环,只是侧链的长度有所不同。以后又发现了没有吲哚环而有萘环的一些化合物,如α-萘乙酸(α-naphthalene acetic acid, NAA),萘氧乙酸(naphthoxyacetic acid,NOA)等,和再一类具有苯环的化合物,如2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D),2,4,5-三氯苯氧乙酸(2,4,5-trichlorophenoxyacetic acid,2,4,5-T),2-甲基-4-氯苯氧乙酸(2-methyl-4-chlorophenoxy acetic acid,MCPA)等也都有与吲哚乙酸类似的生理效应(图6—3)。此外,还有一类合成的生长素衍生物,如α-(对氯苯氧基)异丁酸[α-(p-chlorophenoxy)isobutyric acid,PCIB],它本身没有或有很低的生长素活性,但在植物体内与生长素竞争受体,对生长素有专一的抑制效应,故称为抗生长素(antiauxin)。
一些人工合成的生长素类化合物,如NAA,2,4—D等原料来源丰富,生产过程简单,可在工厂大量生产,现已被广泛地应用在农林业生产中。
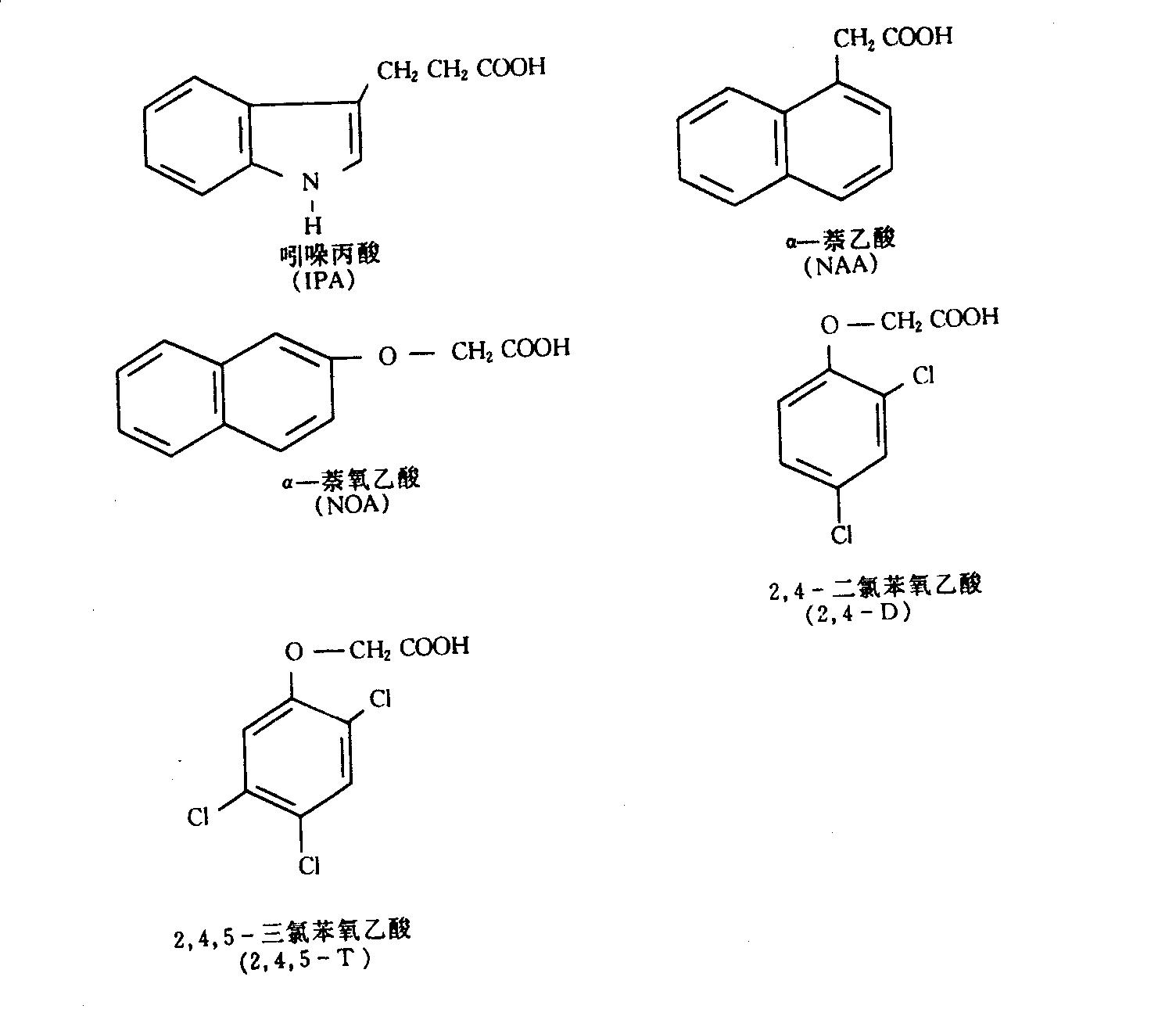
图6-3几种人工合成的生长素类化合物
生长素在植物体内分布很广,存在于植株的根、茎、叶、花、果实、种子及胚芽鞘中。其含量一般约为每克鲜重植物材料含10~100 ng生长素。生长素大多集中在生长旺盛的部位,如胚芽鞘、芽和根的分生组织、形成层、授精后的子房、正在展开的幼叶及幼嫩种子等,而在趋向衰老的组织和器官中含量很少。IAA含量还与植物种类、器官和生长发育阶段有关。在不同植物体内IAA含量差异显著,如大豆种子中IAA为4μg/kg,而在水稻种子中是1700μg/kg。在玉米的营养器官内的IAA只有24μg/kg,但在种子中却高达1000μg/kg。通常,未成熟的种子中IAA含量很高,随着成熟进度而逐渐降低。
植物激素一般以两种状态存在于植物体内,一种是游离态,另一种是结合态,两者区别在于是否有共价键结合的分子。没有与其他分子共价键结合的生长素称为游离态生长素(free auxin);而与其他小分子或大分子有机物相结合的生长素称为结合态生长素(bound auxin)。如与小分子共价结合的有IAA与天冬氨酸结合为吲哚乙酰天门冬氨酸(indole acetyl aspartic acid),与肌醇结合为吲哚乙酰肌醇(indole acetyl inositol),与葡萄糖结合为吲哚乙酰葡萄糖(indole acetyl glucose)等(图6—4);与大分子共价结合的有IAA-葡聚糖和IAA-糖蛋白。游离态生长素具有生物活性,而结合态生长素不具生物活性。结合态生长素通过酶解、水解或自溶作用可释放出游离态生长素,因此结合态生长素和游离态生长素之间可以相互转换。

图6-4几种结合态生长素
结合态生长素在植物体内的作用可能有以下几个方面:(1)作为储藏形式。结合态生长素约占植物组织中生长素总量的50 %~90 %,一般种子成熟时积累结合态生长素,在种子萌发时水解释放出IAA,如吲哚乙酰葡萄糖大多存在于种子和储藏器官中,当种子萌发时IAA乙酰葡萄糖可分解释放出IAA。(2)作为运输形式。玉米籽粒中吲哚乙酰肌醇的运输速度比IAA高1000倍。所以在植物生长活跃时期它作为IAA的重要运输形式将其运至作用部位,再经分解释放出IAA供生长发育所需。(3)解毒作用。游离态生长素积累过多时,不但对植物生长起抑制作用,而且还对植物产生毒害作用,结合态生长素的形成可起到解毒作用,其中吲哚乙酰天门冬氨酸解毒作用最明显,因它使IAA永久地失去活性。(4)防止氧化。游离态生长素易被氧化,如易被IAA氧化酶氧化,而结合态生长素较稳定,不易被氧化。(5)调节游离态生长素含量水平。根据植物体对游离态生长素的需要程度,结合态生长素与结合物分离和结合,使植物体内游离态生长素含量调节到一个适合植物生长发育的水平。
近年来研究表明,高等植物中至少存在两个生长素运输系统:一是经由维管束鞘薄壁组织细胞的单方向极性运输;二是经由维管系统中的非极性运输。
1、极性运输生长素的极性运输(polar transport)是指生长素只能从植物形态学上端向形态学下端运输,而不能倒过来运输。如图6—5所示,把含有生长素的琼脂块放在一段切头去尾的燕麦胚芽鞘的形态学上端,把另一块不含生长素的琼脂块置于形态学的下端,经一段时间后,胚芽鞘下端的琼脂块中也会含有生长素。但是,如果把这一段胚芽鞘颠倒过来,使形态学的下端朝上作同样的试验,生长素却不向下朝形态学上端运输,因而在下置的形态学上端的琼脂块中无生长素出现。这种生长素的极性运输只存在于胚芽鞘、幼茎及幼根的薄壁细胞之间,在茎中表现为向基端(形态学下端)运输;而在根中则相反,表现为向根尖(形态学上端)运输。生长素的极性运输距离短,运输速率仅约5~20 mm/h。IAA(包括一些人工合成的化合物如NAA、2,4,5-T等)是唯一具有极性运输特点的植物激素,极性运输产生了IAA的梯度分布,这种IAA梯度至少部分说明了一些极性发育现象,如向性、顶端优势和不定根形成等。
极性运输是生长素所特有的一类从细胞到细胞的主动运输,如在双子叶植物的茎中极性运输主要是通过围绕维管束的已伸长的薄壁细胞进行。它需要消耗能量,并且可以维持生长素的逆浓度梯度运输。生长素极性运输方向由运输蛋白的分布所决定,其运输速度虽比微管系统中的运输速度慢得多,但比简单扩散速度还快10倍左右。影响呼吸代谢的因子均影响极性运输的速度,如ATP合成抑制剂DNP(二硝基酚)或缺O2。还有其他一些化合物如TIBA(三碘苯甲酸)和NPA(萘基邻氨甲酰苯甲酸)等也能抑制生长素的极性运输,称为生长素极性运输的抑制剂。
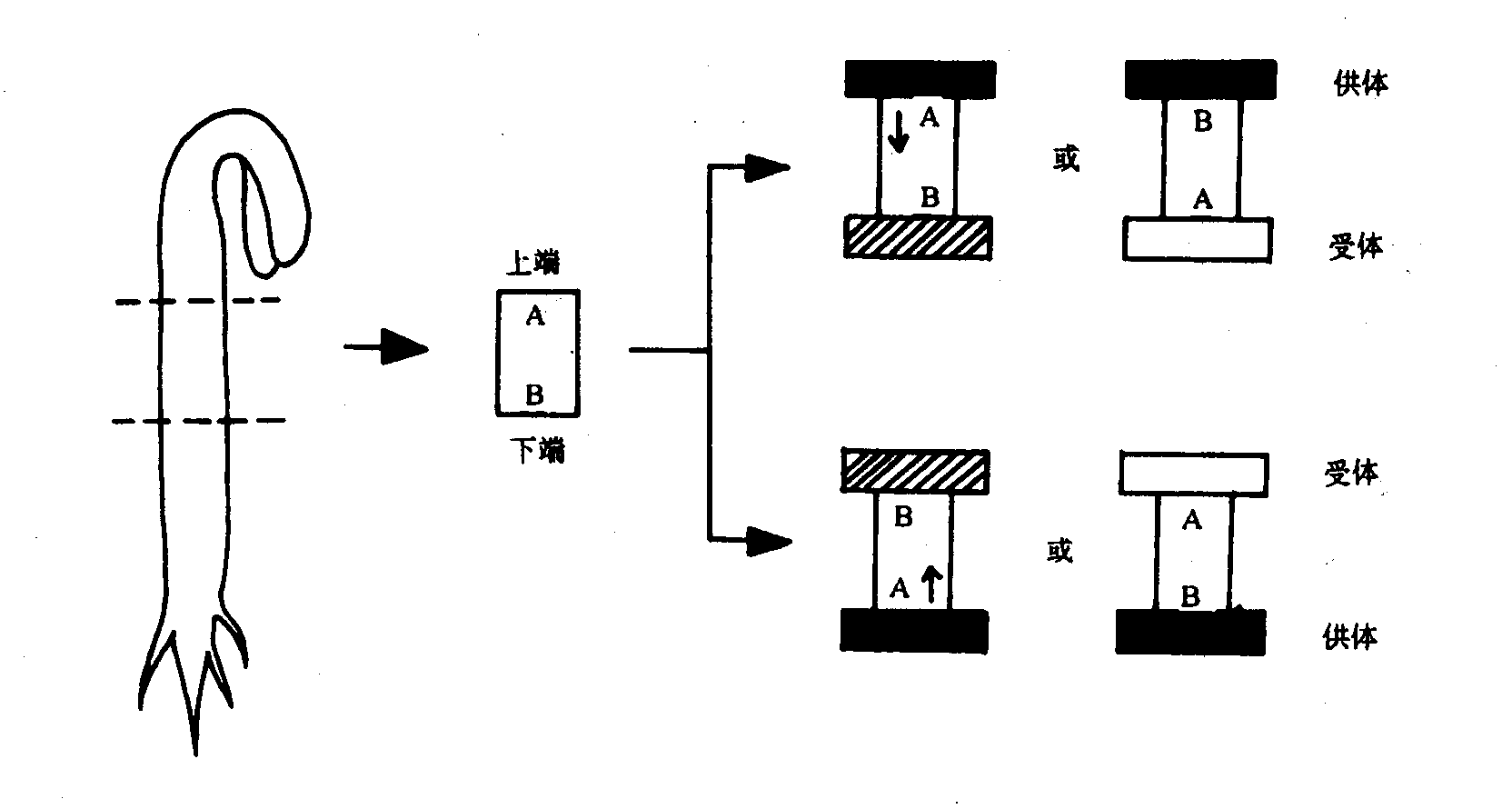
图6-5生长素的极性运输(引自李宗霆等,1996)
生长素极性运输是由某些载体介导的主动运输过程,因此以细胞质膜选择透性为重点,开展了生长素极性运输机理的研究。1977年Goldsmith提出的化学渗透极性扩散假说(chemiosmotic polar diffusion hypothesis),其主要内容如图6—6所示:质膜上的质子泵将ATP水解并释放出能量,同时把H+从细胞质释出到细胞壁,引起细胞壁pH下降(pH 5.0)。生长素的pKa是4.75,在此酸性环境中细胞壁中的生长素的结构较稳定,其羧基不易解离,主要呈较亲脂的非解离型(IAAH)。IAAH被动地扩散通过质膜由细胞壁进入细胞质;同时可能还以2H+/ IAA-协同运输的方式进入细胞质。通过上述两种方式进入胞质的IAA,在中性(pH 7.0)的细胞质环境中,大部分的IAAH将解离形成生长素的阴离子(IAA-)。IAA-比IAAH较难透过质膜,这就需要有其它的条件来帮助它透过质膜。豌豆茎细胞实验指出,在细胞端部的质膜上存在有专一的生长素输出载体(auxin efflux carrier),它们在细胞端部的极性定位使IAA-由细胞质外运到细胞壁,继而进入相邻的下一个细胞,最终将生长素由形态学上端运输到形态学下端。
某些化合物能够专一性地抑制生长素的极性运输,如N-1-萘基邻氨甲酰苯甲酸(N-1-naphthylphthalamic acid, NPA)和TIBA等。实验表明抑制剂的结合并不影响生长素的结合。说明生长素极性运输抑制剂的作用位点与生长素的结合位点不同。这意味着输出载体复合物至少包含两种组成部分:一是负责运输的,另一是调节活性的。由于生长素输出载体复合物由各自独立的运输蛋白和NPA结合蛋白所组成,所以NPA可通过抑制输出载体的活性而抑制生长素的极性运输,从而阻止IAA-从胞内流向胞外。
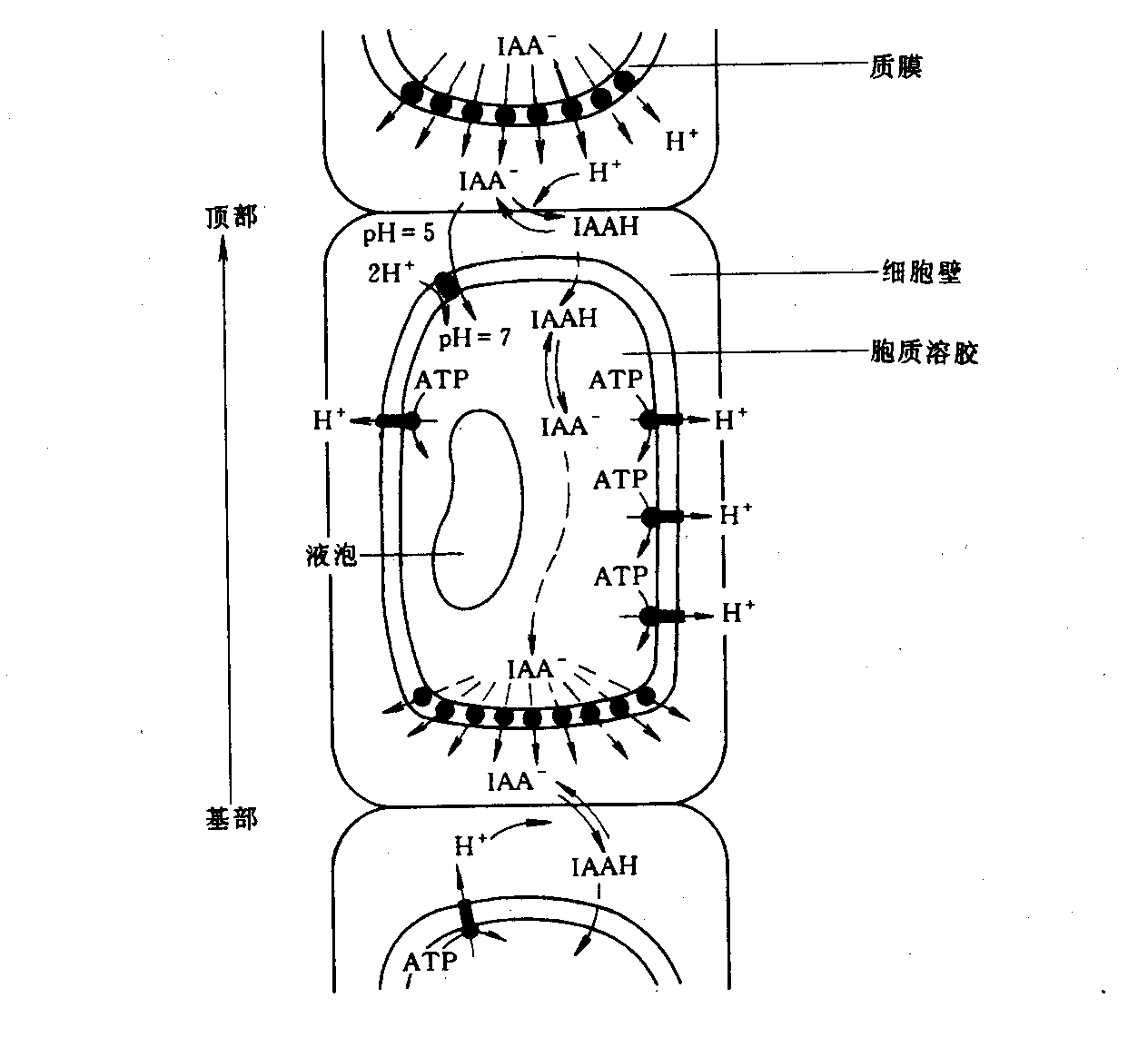 图6-6生长素的化学渗透极性扩散假说(引自潘瑞炽,2001)
图6-6生长素的化学渗透极性扩散假说(引自潘瑞炽,2001)
2、非极性运输除了极性运输外,IAA还有非极性的远距离运输。如对成熟叶片外源供给的生长素可以像光合产物一样通过韧皮部运输。此外,研究表明生长素还可以通过木质部的蒸腾流向上运输。在这些维管系统中,生长素的运输与其他营养物质的运输并没有区别。因此在根的不同组织中存在着两种截然不同的运输方式:在中柱细胞中由根基向根尖的向顶式非极性运输和表皮细胞中由根尖向根基的向基式极性运输。非极性运输速度比极性运输高得多,一般为1~2.4 cm/h,运输方向取决于输导系统两端有机物浓度差等因素。
一般认为,生长素在植物体内的合成部位主要是茎尖分生组织、嫩叶及发育中的种子。在成熟叶片和根尖中也能产生生长素,但数量很微。
目前认为生长素生物合成有色氨酸和非色氨酸两条途径,并且色氨酸和非色氨酸途径可能并存于植物体内。色氨酸途径是植物体内生长素主要的生物合成途径,其生物合成前体色氨酸(tryptophan)。色氨酸转变为生长素时,其侧链要经过转氨作用、脱羧作用和两个氧化步骤。色氨酸途径包括以下4条支路(图6—7)。
1、吲哚丙酮酸途径:色氨酸通过转氨作用,形成吲哚丙酮酸(indole pyruvic acid ),再脱羧形成吲哚乙醛(indole acetaldehyde),后者经过脱氢变成吲哚乙酸。许多高等植物组织和组织匀浆提取物中都发现有上述各步骤的酶。本途径在高等植物中占优势,对一些植物来说是唯一的生长素合成途径。
2、色胺途径:色氨酸脱羧形成色胺(tryptamine),再氧化转氨形成吲哚乙醛,最后形成吲哚乙酸。本途径在植物中占少数。在大麦、燕麦、烟草和番茄枝条中同时存在吲哚丙酮酸途径和色胺途径。
上述两条途径中形成的中间产物吲哚乙醛还可逆转为吲哚乙醇(indole ethanol),当需要IAA时又可脱氢再形成吲哚乙醛。如吲哚乙醇在茎切段的生物试法中表现出活性,这可能是它在组织中逐步转化为IAA的缘故。
3、吲哚乙腈途径:许多植物,特别是一些十字花科植物中存在着吲哚乙腈(indole acetonitrile),在体内腈水解酶作用下,将吲哚乙腈转化为吲哚乙酸。

图6-7吲哚乙酸生物合成途径(引自王忠,2000)
4、吲哚乙酰胺途径:色氨酸由色氨酸单氧酶催化下形成吲哚乙酰胺,然后经吲哚乙酰胺水解酶作用生成IAA,此途径主要存在于形成根瘤和冠缨瘤的植物组织中。
另外,锌(Zn)与生长素的形成有关。Zn是色氨酸合成酶的辅酶,缺Zn会阻碍吲哚和丝氨酸结合形成色氨酸的过程,使色氨酸含量下降,从而影响IAA的合成。崔徵(1954)证实了缺Zn植物的色氨酸含量显著下降,而供植物Zn后几十小时内生长素和色氨酸含量就很快地增加。生长素合成过程中除需要Zn外,还需要适当的光照。如蚕豆和烟草等植物只有预先照光才能形成IAA,如放在暗处体内原有的IAA不久就会消失,但只要给予短时间的光照,IAA又会生成。但过强的光照会活化IAA氧化酶导致IAA解体。
现在研究表明,IAA生物合成途径具有多样性,IAA的合成并不一定要经过色氨酸。用拟南芥(Arabidopsis thaliana)的营养缺陷型进行的试验表明,IAA可以由吲哚(indole)直接转化而来。此外,IAA在玉米组织内可由邻氨基苯甲酸(ortho-aminobenzoic acid)经中间产物吲哚甘油磷酸(indole-3- glycerol phosphate)而合成,这说明非吲哚前体也能合成IAA。
生长素的降解主要有两个方面:酶氧化降解和光氧化降解。
1、酶氧化降解:生长素的酶氧化降解是IAA的主要降解过程,催化降解的酶是IAA氧化酶(IAA oxidase)或过氧化物酶(peroxidase,POD)。IAA氧化酶是汤玉玮和J. Bonner(1947)首先从豌豆茎的提取液中发现的,其后又发现过氧化物酶及其多种同工酶都具有氧化IAA的活性。现已知IAA氧化酶是一种含Fe的血红蛋白,以Mn2+和酚(一元酚)为辅助因子,将IAA分解为CO2和其他产物,如3-亚甲基氧吲哚(3-methyleneoxindole)、吲哚醛(indole-3- aldehyde)等。IAA氧化酶普遍存在于高等植物组织中,它的活性与植物组织器官生长速度呈负相关,如随植物组织的衰老,IAA氧化酶的活性增强,生长素含量下降,因此生长速度减慢的矮生植物体内的IAA氧化酶活性较高,因而抑制了茎和根的伸长生长。
2、光氧化降解:体外的IAA在核黄素存在时,可被酸、电离辐射、紫外光和可见光等因子所氧化分解,光氧化产物与酶氧化产物相同。
在田间对植物施用IAA时,上述两种降解过程能同时发生。而人工合成的生长素类物质,如NAA、2,4-D等则不受IAA氧化酶降解作用,能在植物体内保留较长的时间,比外用IAA有较大的稳定性。所以,在大田中一般不用IAA而施用人工合成的生长素类调节剂。
在植物生长发育的不同阶段 ,不同的植物组织和器官中,生长素对植物生长和形态建成都有着广泛的影响。研究生长素的生理作用为生长素类物质在生产实践中的应用提供了理论依据。
生长素具有十分广泛的生理作用。从细胞水平看,它可以影响细胞的伸长、分裂和分化;从器官水平看,它可以影响营养器官和生殖器官的生长、成熟和衰老。在这些生理作用中,生长素最主要的生理作用有:
生长素能促进植物的生长,如促进幼茎和胚芽鞘的生长。促进生长的主要作用是促进这些器官中细胞的伸长生长。但需注意的是:生长素对细胞伸长的促进作用,与生长素浓度、细胞年龄、植物器官种类有关。一般生长素在低浓度时可促进生长,浓度较高时会抑制生长,浓度更高时则会使植物受伤死亡。一般来说,幼年细胞对生长素反应敏感,老年细胞则比较迟钝。不同器官对生长素的反应的敏感程度也不一样,根最敏感,其最适浓度约为10-10mol/L;茎最不敏感,最适浓度约为10-5mol/L;芽居中,最适浓度约为10-8mol/L(图6-8) 。所以,能促进主茎生长的生长素浓度往往对侧芽和根生长有抑制作用。
生长素影响生长的研究多以离体的植物组织为材料,因生长素对离体器官的生长有明显的促进作用,而对整株植物往往效果较不明显。这可能是在体内有较高的内源生长素类,足以维持最快的伸长生长反应。这也是应用离体材料研究结果于整体植株时应该予以注意的。
 图6-8不同营养器官对不同浓度IAA的反应
图6-8不同营养器官对不同浓度IAA的反应
生长素不仅能影响根的伸长,还能影响根的形成。实验表明,除去作为IAA源的幼叶或芽,往往会减少侧根的数量,但再用生长素处理时植物根形成能力又得到恢复,这说明侧根的发生通常受到来自幼叶或芽的IAA的调控。
生长素还能促进茎、叶等器官上不定根的发生。特别是生长素能促进一些不易生根的植物插枝顺利生根。用生长素处理插枝基部后,其切口处的薄壁细胞首先脱分化,恢复分裂功能,产生愈伤组织,然后长出大量的不定根。目前,在组织培养和生产上常用人工合成的生长素2,4-D、IBA和NAA等来促进生根,其中IBA的作用最强烈,诱发的根多而长,NAA诱发的根少但较粗壮,所以有时两者可同时结合使用。
生长素还广泛地参与其他生理过程的调控。如促进维管系统的分化;促进光合产物的运输;保持植物的顶端优势;促进菠萝开花和瓜类植物雌花的形成;促进果实发育与单性结实等。此外,生长素还可抑制花朵脱落和叶片老化等。
生长素最明显的生理效应是促进细胞的伸长生长。生长素作用于细胞时,首先与受体结合,经过一系列过程,使细胞壁松弛并合成新的细胞质和细胞壁结果物质,最终表现出细胞长大。因此,受体的研究是植物激素作用机理研究的第一步。
6.1.6.1 激素受体
激素受体(hormone receptor)是指那些能特异地识别激素并与之专一结合,进一步引起一系列生理、生化变化的蛋白质。然而,能与激素结合的蛋白质并非都是激素受体,只可称其为植物激素结合蛋白(plant hormone-binding proteins),是受体研究的首选对象,被视为潜在的受体。激素受体的一个重要特性是激素与受体结合后能激活一系列胞内信号传导过程,从而使细胞作出相应的生理生化反应。不同种类激素各有其专门受体,生长素受体(auxin receptor)只是激素受体的一种。激素受体在器官、组织和细胞中的分布定位研究表明:不同种类激素受体的分布很不相同,即使是同一激素受体也可能分布在细胞的不同区域。如内质网上存在大量的生长素受体,胞质中存在赤霉素结合蛋白,细胞质膜上存在ABA结合蛋白。目前对植物激素受体的研究已取得一定的成就,其中生长素受体的研究较为详尽。
大多数生长素受体是位于膜上(内质网膜、质膜和液泡膜)的生长素结合蛋白(auxin-binding protein, ABP),目前已经发现不少于四种,其中ABP1(位于内质网膜上)是研究最为深入的生长素受体。ABP研究主要以玉米胚芽鞘为材料,发现该类蛋白主要分布在内质网上,可由内质网分泌至质膜表面和细胞壁区域。ABP在质膜外表面或细胞壁内空间与生长素相结合后,增加并促进了质子泵的数量与活性,结果将膜内的H+泵到膜外,引起质膜的过极化,使细胞壁松弛。如用NAA诱导烟草原生质体质膜过极化的实验,NAA处理能使质膜电势变得更负,加入ABP1处理原生质体,可降低获得同样效应所需要的NAA的浓度,这说明经ABP1处理后,提高了原生质体对NAA的敏感性,提示生长素受体是植物对生长素敏感性(sensitivity)的限制因子。但用ABP1的抗体处理原生质体,由于抗体专一结合膜上的ABP1,从而减少了ABP1对NAA的识别,因此会显著地降低质膜对NAA的敏感性。这一实验也证实了ABP1是生长素受体。
另外研究还表明少数生长素受体是位于细胞液或细胞核中的可溶性生长素结合蛋白质(soluble auxin–binding protein),它能与生长素相结合,促进mRNA的合成,并且生长素对转录的促进程度与IAA特异性结合蛋白的量呈正相关。目前人们正在利用拟男芥等模式植物的突变体进行激素受体基因的克隆、表达及生理生化的研究,相信不久会取得突破进展。
生长素促进细胞伸长生长的机理研究,到了20世纪60年代末70年代初形成了两派学说,即酸生长学说和基因活化学说。
Ray等通过试验证明植物细胞在酸性环境中伸长速度加快。他将1cm长的燕麦胚芽鞘切段,放在一个密闭的小室中,一端固定在柠檬酸缓冲液(pH 3)中,让液体流过小室,在显微镜下观察,1 min内就可测出胚芽鞘的伸长。若将胚芽鞘放入一定浓度的生长素溶液中,可发现10-15 min后切段开始迅速伸长,两种处理表现出相似的生长反应,只是生长反应的迟滞期长短不同(图6-9)。酸所促进植物组织伸长生长反应被称为“酸生长效应”,此效应在南瓜下胚轴、豌豆茎切段试验中也得到了证实。
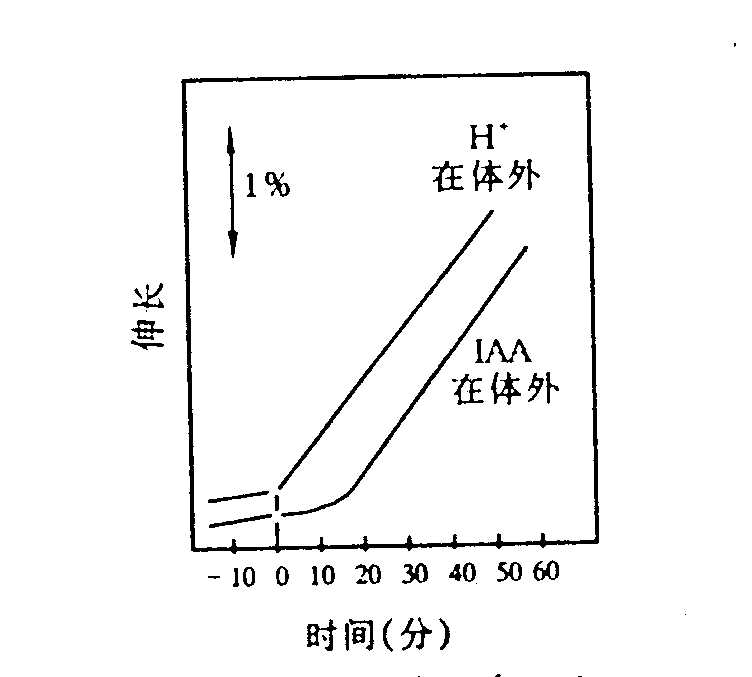
图6-9 10-5mol/L IAA(pH 6)和10 mmol/L柠檬酸
缓冲液(pH 3)对燕麦胚芽鞘伸长的影响
1970年Royle和Cleland根据已获得实验结果,提出了生长素作用机理的酸生长学说(acid growth theory)。其要点是:生长素与其受体结合,进一步通过信号转导,提高质膜上质子泵(H+-ATPase)的数量并同时活化它们,促进H+向细胞外输出,使细胞壁酸化。1997年Macdonald提出了生长素信号传导模型,认为生长素和ABP1结合后,使钝化的对接蛋白(inactive dockingprotein)转化为活性状态,并进一步激活质膜上的H+-ATPase,使细胞壁酸化。在酸性环境中,一方面细胞壁中的一些水解酶的活性增加,如水解果胶质的β-半乳糖苷酶和β-1,4-葡聚糖酶活性都显著增加,使细胞壁内不溶性的多糖转化为可溶性糖;另一方面对酸不稳定的键(如氢键)易断裂,如连接胞壁物质木糖葡聚糖聚合体(xyloglucan polymer)和纤维素微纤丝(cellulose microfibrils)之间的氢键断裂,结果使胞壁多糖分子间结构交结点破裂,联系松弛,细胞壁可塑性增加,细胞壁松弛。细胞壁松弛后,细胞的压力势下降,使细胞的水势下降,细胞吸水,体积增大而发生不可逆增长(图6-10)。生长素诱导的细胞伸长生长是一个需能过程,如果呼吸代谢受抑制,生长素诱导的这种效应就受阻。
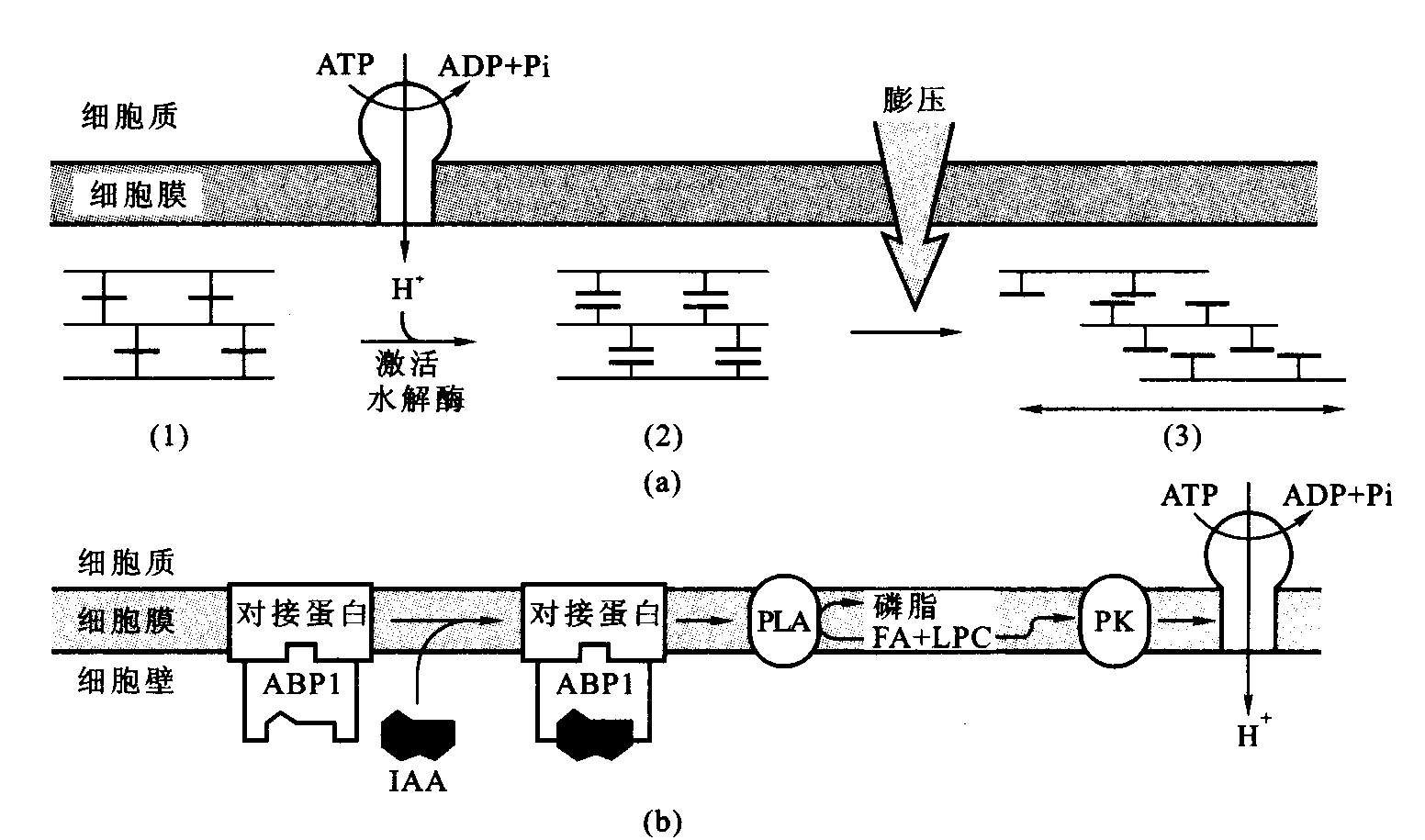
图6-10细胞伸长的酸生长学说(引自李合生,2002)
a.细胞壁酸化后使细胞壁可塑性增加; b.ABP1和生长素的信号传导
生长素的酸生长学说虽能解释生长素所引起的快速反应,如生长素处理燕麦胚芽鞘后10-15 min,其生长速度就明显增加。但生长素促进生长可以稳定地持续几个小时,这就暗示了生长素除促进H+分泌外,必定还刺激其他代谢过程。
20世纪60年代以来的许多研究表明,生长素通过促进核酸、蛋白质的合成来影响细胞的持续生长。如用生长素处理豌豆上胚轴3天后,顶端1 cm处的DNA、RNA和蛋白质含量比对照组都有明显的增加。如用RNA合成抑制剂放线菌素D(actinomycin D)和蛋白质合成抑制剂环己酰亚胺(cycloheximide)处理时,发现RNA和蛋白质合成量下降的百分率和生长素诱导细胞伸长生长受到抑制的百分率是平行的(图6-11)。而且用5-氟尿嘧啶(除mRNA外,其他RNA的合成抑制剂)试验证明,新合成的是mRNA。后来试验还证明了生长素与质膜上的受体结合,引起一系列的信号转导,主要是通过IP3来增加细胞质中Ca2+水平。由于蛋白质磷酸化作用,使不活化的蛋白质因子活化,在质膜上与生长素结合,形成蛋白质—生长素复合物,进入细胞核,合成特殊的mRNA,最后合成蛋白质。形成新的酶和新的细胞壁成分,不断补充插入细胞壁的骨架中,保持细胞在生长过程中细胞壁的厚度基本不变。
以上结果说明生长素的长时间效应是通过在转录和翻译水平上促进核酸和蛋白质的合成而影响生长的。由此提出了生长素的基因活化学说,其要点是生长素可以使细胞伸长所需的一些基因脱阻遏,从而使其得到表达,促进RNA和蛋白质合成。
 图6-11生长素诱导的生长受放线菌素D(A)和环己酰亚胺(B)的抑制
图6-11生长素诱导的生长受放线菌素D(A)和环己酰亚胺(B)的抑制
上述两种学说虽有不同,但两种观点却存在着互补性。1975年Van der Hoff和Stahl用IAA处理胚芽鞘切段,发现其生长速度的变化可分为两个阶段:在IAA处理后12 min开始出现第一阶段的快速生长反应,若不加IAA只降低pH值也能出现类似的单蜂生长曲线。生长素处理后约40 min开始出现第二阶段的持续生长反应,其效应可被加入的环己酰亚胺所消除。这说明了IAA既可使细胞壁酸化,增加可塑性,使细胞体积增大;又可促进RNA和蛋白质的合成,为原生质体和细胞壁的合成提供原料,保持持久性生长(图6-12)。
 图6-12生长素对细胞伸展的影响(引自潘瑞炽,2001)
图6-12生长素对细胞伸展的影响(引自潘瑞炽,2001)


