5. 植物细胞的信号转导
课件:5.plant signal transduction.ppt(下载附件 2.58 MB)
中文课件:
提要: 植物个体的生长发育主要受遗传信息及环境变化信息的调节控制,遗传基因决定个体发育的基本模式,而环境信息对这一过程具有广泛而深刻的调节控制作用,这就是目前称之为“细胞信号转导”(signal transduction)研究的主要内容。本章主要探讨外界环境因子及胞间通讯分子(如激素等)与细胞膜受体识别、识别后如何跨膜传递形成细胞内第二信使以及其后信息分子级联传递、诱导基因表达和引起生理反应的过程。
5.1信号的概念及类型
5.1.1信号
信号与信息是两个密切相关而又有区别的概念。信息一般要通过一定的物理量(信号)体现出来,因此,信号是信息的物质体现形式及物理过程。信号的主要功能是在细胞间和细胞内传递信息并引发相应的生理生化变化。信号既非营养物质,又不是能源物质,也不是细胞的结构组分。
5.1.2信号的类型
根据信号存在的部位,可以把信号分为胞间信号(intercellularsignal)和胞内信号(intracellular signal)。而根据信号的性质则可以把信号分为化学信号(chemical signal)和物理信号(physical signal)。这种分类只是为了研究和学习的方便,而实际上胞间信号既可能是化学信号,也可能是物理信号;同样,化学信号既可能存在于胞间,也可能存在于胞内。
5.1.2.1 胞间信号
当环境刺激的作用位点与效应位点处在植物体的不同部位时,就必然有胞间信号传递信息。例如土壤干旱或盐冲击处理时,引起植物地上部分叶片气孔关闭,表明根接受环境刺激产生某种信号传递到地上部分叶片。含羞草的地上部分某一部位受到较强刺激(震动、烧灼、骤冷等),除了这一部位的小叶成对的合拢外,邻近的小叶甚至整个复叶的小叶均成对合拢,并引起复叶叶柄下垂,这也表明发生了胞间信号传递。这种胞间信号既可能是化学信号,如干旱等引起根产生ABA通过木质部导管运到地上部分叶片导致气孔关闭;也可能是物理信号,如含羞草感震运动中的动作电位等。
5.1.2. 2 胞内信号
胞间信号与质膜受体结合后,经跨膜转换诱发产生第二信号,通过第二信号的进一步传递和放大,最终引起细胞中相应的生理生化反应。这些第二信号通常也就是胞内信号。有关胞内信号近年来取得了很大进展。动物细胞内的胞内信号分子有cAMP、cGMP信号传递系统、钙信号系统和磷酸肌醇信号系统。在植物细胞内是否存在cAMP尚无足够证据,但上述其他几种胞内信号证明也是植物细胞内重要胞内信号分子。几种细胞内信号分子的分子结构示如图5-1。目前还有一些物质被认为在植物细胞中具有第二信号作用,如:H+、ABA、乙酰胆碱和乙烯等。
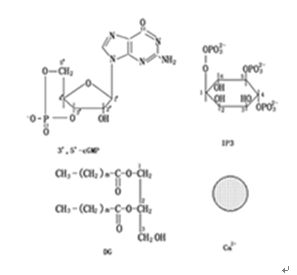
图5-1 某些胞内信号分子的分子结构
5.1.2.3 化学信号
化学信号(chemical signal)是指细胞感受环境刺激后形成的并能传递信息引起细胞反应的化学物质。如:植物激素(ABA、生长素和乙烯等)、植物生长活性物质(多胺类化合物、茉莉酸和水杨酸等)和Ca2+等。
植物激素在植物一定的发育阶段和一定组织器官中产生,也可以在一定环境刺激下合成,这些激素可以直接调控基因的表达。当然植物激素也可以作为胞间信号在胞间传递,由靶细胞质膜上专一性受体识别并接受,通过转导产生胞内信号,从而影响代谢活动,产生相应的细胞反应,调节植物生长发育过程。ABA作为逆境信号了解的比较清楚。这方面英国科学家Davies和我国科学家张建华教授均做了大量工作。大量实验表明植物根尖在干旱等逆境胁迫下合成ABA,然后通过木质部导管向地上部分运输,因此,干旱植物木质部液中ABA浓度比对照高25~30倍,最后到达叶片的保卫细胞,通过其质膜上的信号转导,引起保卫细胞质中的Ca2+增加,使质膜去极化,激活K+外流通道引起K+外流,同时苹果酸含量也下降,保卫细胞失水气孔关闭。
5.1.2.4 物理信号
物理信号(physical signal) 是指细胞感受环境刺激后产生的具有传递信息并引起细胞反应的物理因子。如电波和水力学信号等。植物细胞是否普遍具有胞间通信作用的电信号一直是一个具有争议的问题。在低等植物藻类和某些敏感性高等植物如含羞草中具有动作电位是无疑的。娄成后院士通过大量研究明确提出了“电波的信息传递在高等植物中是普遍存在的”观点,近年来他对这一观点做了进一步阐述:(1)植物为了对环境变化作出反应,既需要专一的化学信号传递,也需要快速的电波传递。(2)植物的电波传递有多种形式:对高敏感性植物,外界刺激无需达到伤害程度即可产生动作电波(AP);中等敏感的植物在伤害刺激条件下产生变异电位(VP);最不敏感的植物只引起不可传递的局部电位变化;而且植物都有经逆境或剧烈刺激激活的潜在兴奋性。(3)与动物相似,植物电波也是质膜极化及透性变化的结果,而且伴随有化学信号的产生(如乙酰胆碱)。(4)植物电波长途传递途径是维管束,短途传递则是通过共质体和质外体。(5)各种电波传递都可以产生生理效应。植物细胞电信号产生、传递及生理效应的详细机制有待进一步研究。
5.2信号的跨膜转换
环境刺激与细胞反应之间要完成信息的传递,必然有一个外界环境信号接受与引起细胞内信号放大之间的中介过程,这个中介过程涉及到外界信号接受所必需的受体以及把外界信号转换成胞内信号的转换系统。
5.2.1.受体
受体(receptor)是指位于细胞质膜或亚细胞组分中的天然分子,可特异地识别并结合化学信号物质¾配体(ligand),并在细胞内放大、传递信号并启动一系列生理生化反应,最终导致特定的细胞反应。受体具有特异性、高亲和性和可逆性等特征。到目前为止发现的受体多为蛋白质。
根据受体在细胞中存在的部位,可将受体分为细胞表面受体和细胞内受体。前者位于细胞质膜上,后者则位于细胞内的亚细胞组分上。细胞表面受体包括:(1)G蛋白联接受体(G protein-linked receptor),受体蛋白的氨基端位于细胞的外侧,羧基端位于细胞内侧,一条单肽链形成几个(多为7个)跨膜a螺旋结构。羧基端具有与G蛋白相互作用的区域,受体活化后直接将G蛋白激活,进行跨膜信号转换(图5-2A)。(2)酶联受体(enzyme-linked receptor),受体本身是一种酶蛋白,当胞外侧区域与配体(如信号二聚体)结合时,可激活酶,通过胞内侧酶的反应传递信号(图5-2B)。(3)离子通道连接受体(ion-channel-linked receptor),即除了含有与配体特异结合的部位外,这种受体本身就是离子通道,受体接受信号后立即引起离子的跨膜转移(图5-2C)。
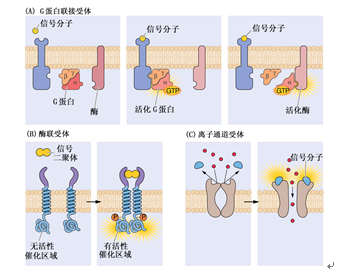
图5-2 质膜上三类受体示意图(引自Buchanan等,2000)
位于亚细胞组分上的受体与配体结合后往往直接调控细胞反应。某些信号,如疏水性小分子甾醇类物质可以通过简单扩散进入细胞与细胞内受体结合。另一方面,胞外受体与配体结合后,通过信号转换系统产生第二信使,如cGMP、IP3(三磷酸肌醇:inositol-1,4,5-triphosphate)和DG(二酯酰甘油:diacylglycerol),这些第二信使亦可以与胞内受体结合,调节一系列生理生化反应。
目前对受体研究较多的是光受体和激素受体。植物细胞内有三类光受体,即对红光和远红光敏感的光敏色素(phytochrome),对蓝光和紫外光A敏感的隐花色素(cryptochrome)和对紫外光B敏感的紫外光B区光受体。光敏色素作为植物光受体之一,由于它参与植物开花、种子萌发等许多生长发育过程,人们对光敏色素的了解已远远超过激素受体。光敏感色素已被纯化,某些基因也被克隆。近年来其分子结构的研究结果表明,光敏色素由二聚体组成,两个单体在C端区域相连。其包含1100个氨基酸残基的序列包括生色团结合位点,生色团裂合酶结构区域及决定完整光敏素吸收光谱的结构区域在N端区;与二聚体形成及Pfr降解有关的结构在C端区;与光敏色素生物学活性有关的结构在N端区及C端区的两头。从藓类Certodom rurpureus中克隆了一个新的光敏色素基因,并证实该光敏色素N端(生色团所在)作为光受体,而C端在光刺激后产生蛋白激酶活性,能使光敏色素自身磷酸化。因此,可以认为光敏色素是一个光依赖的蛋白激酶。有关光敏色素的详细内容参考第7章有关章节。
有关植物激素受体的研究也取得了重要进展,利用拟南芥突变体已鉴定、克隆了乙烯受体及其调控因子。人们根据双子叶植物黄化幼苗对乙烯的特殊反应即三重反应(抑制伸长生长、促进横向生长和偏上生长)筛选了拟南芥的不同突变体。对乙烯几乎完全不敏感的突变体etr(ethylene-resistant),对乙烯不敏感的突变体ein(ethylene-insensitive)和eti(ethylene-insensitive)以及对乙烯持续表现三重反应的突变体ctr(constitutive triple response)。
现已从etr1突变株中克隆出对抗乙烯作用负责的ETR1基因。该基因编码乙烯受体蛋白ETR1,该蛋白是由738个氨基酸组成的多肽,其N端为一疏水结构,含乙烯受体活性区域;而C端为含有一组氨酸激酶活性区域和调节因子区域(图5-3 A)。乙烯受体蛋白的这一结构模式类似于细菌中的双组分信号系统。在细菌中,其双组分信号系统包括感受器(sensor)和反应调节器(response regulator)两部分。感受器区域通常定位于膜上并与一具有组氨酸激酶活性的区域相邻,当信号分子与N端的感受器结合时,组氨酸激酶被激活并进行自身磷酸化,然后磷酸基团从组氨酸转移到反应调节器区域的天门冬氨酸残基上,而反应调节器的磷酸化状态决定其调节活性的高低。现已证明,在etr1突变株中,ETR1基因发生突变,乙烯信号不能被接受,因而表现为对乙烯不敏感。从ctr1突变体中分离克隆出CTR1基因,该基因编码CTR1蛋白,该蛋白在乙烯的信号转导过程中起负调节作用。在ctr1植株中,CTR1基因发生突变,CTR1负调节因子缺失,故形成持续表现乙烯生理效应的表型(图5-3 B)。CTR1的N端为调节活性区域,而C端为具有丝氨酸/苏氨酸蛋白激酶的特征区域。CTR1蛋白质氨基酸序列分析表明,CTR1为丝氨酸/苏氨酸蛋白激酶,其作用类似于动物细胞中分裂素原激活的蛋白激酶激酶激酶(MAPKKK:mitogen-activated protein kinase kinase kinase),故认为植物细胞中乙烯的信号转导过程可能也涉及蛋白质一系列磷酸化反应。从拟南芥ein突变株中已克隆出对乙烯敏感性负责的基因EIN2。该基因突变导致突变株对乙烯的不敏感性。利用双基因突变进行的研究表明,在ETR1,CTR1和EIN2这三个参与乙烯信号转导的因子之间,ETR1作为乙烯受体位于上游,EIN2则位于下游,而CTR1作为负调节因子位于两者之间(图5-3 C)。
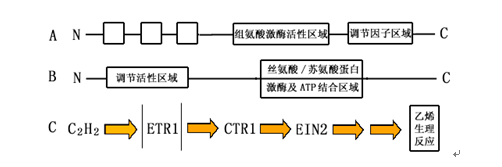
图 5-3 乙烯受体ETR1及其调节因子CTR1结构及乙烯信号转导机制模式(引自武维华,1998)
A:乙烯受体蛋白ETR1结构示意图 B:乙烯信号传递负调节因子CTR1结构示意图 C:乙烯信号转导机制模式图
在其他激素受体研究方面,目前还停留在激素结合蛋白阶段,而对这些激素的真正受体尚不太明了。
一般情况下,信号分子与细胞表面受体特异性结合,经过跨膜信号转换,将胞外信号在胞内通过第二信使放大并传递。
5.2.2. G蛋白与跨膜信号转导
在受体接受胞外信号与产生胞内信号之间,往往要通过质膜上的信号转换。这种转换是通过G蛋白偶联起来的。G蛋白又称GTP结合调节蛋白(GTP binding regulatory protein),由于其作用是把胞外信号转化成胞内信号,故又把G蛋白称为信号转换蛋白或偶联蛋白。G蛋白的发现是生物学研究的又一重大成就,Gilman和Rodbell1由此获得1994年诺贝尔医学生理学奖。20世纪90年代以来利用生理学、分子生物学技术,不仅证明了G蛋白在高等植物中普遍存在,而且初步证明了G蛋白在光、激素等因子对气孔运动、细胞跨膜离子运输等细胞信号转导中有重要作用。
G蛋白一般分为两大类。一类为大G蛋白,由三种不同亚基(abg)构成的三聚体G蛋白(heterotrimericG-protein),其a亚基含有与GTP结合的活性位点,并具有GTP酶活性,其相对分子量为31 kDa~46kDa。b和g亚基的相对分子量分别为约36 kDa和7 kDa~8 kDa,b和g亚基一般呈稳定的复合状态。另一类是含有一个亚基的单聚体G蛋白,又称为小G蛋白(small G-protein)。小G蛋白的结构与功能类似于大G蛋白中的a亚基,相对分子量为20 kDa~30 kDa之间,有GTP结合的活性位点并具有GTP酶活性。小G蛋白又分为ras,rho和rab/ypt三个亚类,它们分别参与细胞生长与分化、细胞运动、膜囊泡与蛋白质运输等的调节过程。亚基上氨基酸残基的酯化修饰作用将G蛋白结合在细胞膜面向胞质的一侧。
G蛋白参与跨膜信号转换是靠自身的活化与非活化状态循环来完成的,这种活化与非活化状态又与GTP的结合与水解联系在一起。在动物细胞中,处于非活化状态的G蛋白的a亚基结合着GDP。当细胞受到刺激后,胞外信号与受体结合,受体构象发生变化,与G蛋白结合形成受体—G蛋白复合体,使G蛋白a亚基构象发生变化,释放GDP结合GTP而被活化。尔后,a亚基与b及g亚基分离并向其下游产生第二信使的组分(如腺苷酸环化酶:adenylyte cyclase)靠近并结合,活化环化酶并通过水解ATP产生第二信使cAMP分子。同时,GTP水解为GDP,并引起a亚基与腺苷酸环化酶的分离,回到原位与b和g亚基重新结合,完成了信号转换(图 5-4)。
G蛋白不仅把胞外信号转换为胞内信号,而且起信号放大作用,即每个与配体结合的受体同时可以激活多个G蛋白分子,每个G蛋白分子激活一个腺苷酸环化酶,后者又可催化产生大量cAMP。cAMP又可作为第二信使通过以后的信号的转导途径进一步传递并放大信号。
植物细胞中是否普遍存在cAMP及cAMP是否为植物细胞第二信使目前尚有争议。但是,植物细胞中普遍存在其它第二信使,其中研究较清楚的有Ca2+、IP3和DG。
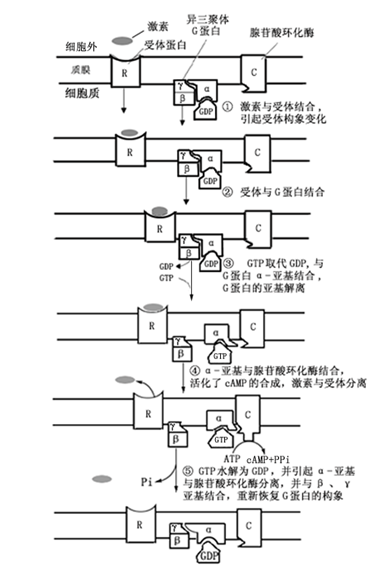
图 5-4 G蛋白参与的跨膜信号转换(依据潘瑞帜,2002)
5.3胞内信号和第二信使系统
由胞外刺激信号激活或抑制的、具有生理调节活性的细胞内因子称为第二信使(secondmessenger)。到目前为止在植物细胞中的第二信使系统主要是环苷酸信号系统、钙信号系统和磷脂酰肌醇信号系统。
5.3.1.环核苷酸信号系统
环核苷酸主要是指cAMP和cGMP。cAMP作为重要的第二信使物质在动物细胞中早已定论。当某些胞外刺激作用于动物细胞时,激活细胞质膜上的特异性受体,然后通过G蛋白介导促进或抑制膜内侧的腺苷酸环化酶,从而调节胞质的cAMP水平,cAMP作为第二信使调节细胞的生理生化反应。然而,植物细胞中的cAMP是否普遍存在以及是否也具有象动物细胞类似的第二信使作用,尚无定论。目前已在某些植物中测到cAMP的存在,但其浓度远低于动物细胞中的有效生理浓度。另一方面,有报道证明外加cAMP可以引起植物细胞的生理反应。说明cAMP作为植物细胞的第二信使是可能的。关于植物细胞是否存在cAMP合成和降解酶(腺苷酸环化酶和环核苷酸磷酸二酯酶)也还没有最终从蛋白质和基因水平得到确切证据。其次植物细胞内是否存在cAMP的靶蛋白也缺乏确切证据。总之,cAMP是否作为植物细胞内第二信使尚无定论。在动物细胞中,cGMP信号的产生与cAMP类似,是由鸟苷酸环化酶催化的,而cGMP降解则由环核苷酸磷酸二酯酶完成,cGMP作为第二信使的作用方式与cAMP类似。近年来,cGMP作为第二信使在植物细胞中的作用也有了一定进展,如蔡南海实验室证实了叶绿体光诱导花色素合成过程中,cGMP参与了受体、G蛋白之后的下游信号转导过程。
5.3.2.钙信号系统
胞质中游离Ca2+作为植物细胞重要的第二信使已得到证实。植物细胞胞质中静息态的Ca2+浓度在10-7~10-6 mol L-1,细胞壁等质外体中Ca2+浓度在10-4~10-3molL-1,细胞内的液泡、内质网中的Ca2+浓度也比胞质Ca2+浓度高得多。因此,人们又把质外体称为胞外Ca2+库,而把液泡和内质网称为胞内Ca2+库。胞内、外Ca2+库与胞质中Ca2+存在很大的浓度差,由于胞质仅占液泡、内质网和质外体的很小一部分,因此,某中刺激引起胞内、外Ca2+库向胞质内释放少量Ca2+时,胞质内Ca2+浓度就会立即大幅度上升,达到一定阈值后,继而通过钙调节蛋白等引发相应的生理生化反应,从而完成传递胞外信号的作用。等完成信号传递后,Ca2+又被迅速泵出胞外或泵入胞内Ca2+库,胞质中游离Ca2+浓度又回落到静息态水平,同时Ca2+也与受体蛋白分离。大量研究表明,植物细胞受到不同胞外信号刺激(光照、盐处理、激素等)后,胞质游离Ca2+浓度都会有一个短暂的、明显的升高,或者引起Ca2+在细胞内的梯度分布或分布区域化发生变化,其变化的幅度和频率都不相同。不同刺激信号的特异性可能是靠Ca2+浓度变化的不同形式而体现的。
胞质中Ca2+的稳态(calcium homeostasis)主要是靠质膜、液泡膜和内质网膜等Ca2+转运蛋白(Ca2+ translocating proteins)来维持的,某些有机酸等钙螯合物对胞质游离Ca2+浓度也有一定的调节作用。Ca2+转运蛋白主要有Ca2+-ATP酶,Ca2+通道和Ca2+/nH+逆向转运体。植物细胞膜上Ca2+-ATP酶主要有两种类型:ⅡA型和ⅡB型,不同类型的Ca2+-ATP酶具有不同的同工酶,而且分别定位于不同细胞膜上,但它们的功能均是水解ATP的同时把胞质中Ca2+泵入Ca2+库。Ca2+通道负责Ca2+由Ca2+库被动进入胞质。Ca2+/nH+逆向转运体则依赖于跨膜质子梯度把Ca2+运入Ca2+库,质膜H+-ATP酶负责跨质膜H+梯度建立,而液泡膜H+-ATP酶和焦磷酸酶负责跨液泡膜H+梯度的建立。因此,质膜和液泡膜质子泵对胞质Ca2+稳态具有重要作用。植物细胞中Ca2+运输系统示于图5-5。
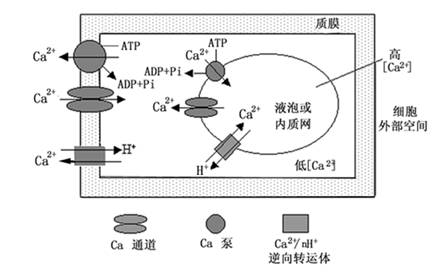
图 5-5 植物细胞钙离子运输系统
胞内Ca2+信号也可通过钙受体蛋白转导信号调节细胞生理反应。植物细胞中的钙受体蛋白主要有钙调素(calmodulin, CaM)和钙依赖型蛋白激酶(calcium-dependent protein kinase , CDPK;见5.3.4)。CaM是植物细胞中分布最广,了解最多的一种钙受体蛋白。CaM是一种耐热、酸性小分子可溶性球蛋白,等电点4.0,相对分子量约为16.7kDa,由148个氨基酸组成的单链多肽。
每个CaM分子有4个Ca2+结合位点,它必须与Ca2+结合后发生构象变化才具有生理活性。CaM的作用方式有两种:一是直接与靶酶结合,诱导靶酶的活性构象,从而调节靶酶的活性,如Ca2+-ATP酶和NAD激酶等;二是与Ca2+结合,形成活化态的Ca2+×CaM复合体,后者与靶酶结合激活靶酶,如H+-ATP酶和磷酸化酶等,这种方式在钙信号传递中起主要作用。
CaM 与Ca2+有很高的亲和力,1个CaM分子最多可与4个Ca2+结合。
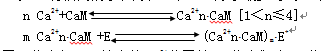
这里n代表与CaM结合的Ca2+分子数,E代表靶酶,m代表活化靶酶所需的Ca2+n•CaM 复合物数,*代表靶酶的活化态。
近年来在CaM基因结构、基因表达以及空间结构等方面取得了许多进展。CaM的三维空间结构呈哑铃形,长为6.5 nm(图5-6A)。每个哑铃球上有2个Ca2+结合位点,长的螺旋形成哑铃柄,长约2 nm,无Ca2+结合时,两端球部沿中心螺旋折叠。与Ca2+结合形成复合物后,结合到靶酶上(图5-6B)。Ca2+•CaM复合物的形成使CaM与许多靶酶的亲和力大大提高,导致靶酶的活性全酶浓度增加,这就是所谓的调幅机制(amplitude modulation)。而调敏机制(sensitivemodulation)是指在细胞内Ca2+浓度保持不变的情况下,通过调节CaM或靶酶对Ca2+的敏感程度,增加活性全酶。现已发现许多Ca2+•CaM复合体的靶酶,如质膜上的Ca2+-ATP酶、Ca2+通道、NAD激酶和多种蛋白激酶等。这些靶酶被活化后参与细胞分裂、生长和分化等过程,最终调节细胞的生长发育。
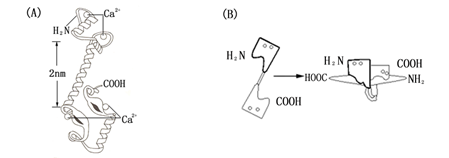
图 5-6 CaM的三维结构(A)和Ca2+·CaM复合体结合到靶酶上(B)(引自潘瑞帜,2002)
5.3.3.磷脂酰肌醇信号系统
生物膜的基本组成成分是蛋白质和磷脂,由于膜蛋白是细胞与环境之间物质交换和能量及信号转换的主要执行者,所以过去膜研究领域注意力主要集中在膜蛋白质方面,而对膜脂研究则主要集中在膜脂中脂肪酸的种类、比例与膜流动性及其与环境之间关系方面,而没有人考虑到膜磷脂及其代谢产物还能作为细胞信号传递物质。1953年Hokin等人发现,外界刺激可以加速膜脂的代谢活动,他们注意到乙酰胆碱等一些促分泌物质在促进胰脏分泌淀粉酶的同时,还伴随磷脂代谢周转率的加快。后来用放射性32P标记研究发现只有膜脂中磷脂酰肌醇及其代谢产物在动物激素反应中起作用。但是直到70年代才真正把磷脂酰肌醇及其代谢产物作为细胞信号传递物质进行研究。到目前为止,动物细胞中已建立了比较完整的磷脂酰肌醇信号系统的概念。在植物细胞中磷脂酰肌醇信号系统在某些植物也已得到确认,但信号转导的具体途径还不象动物细胞那样清楚。
磷脂酰肌醇(phosphatidylinositol, PI)主要分布在细胞质膜内侧,其总量仅占膜磷脂的很少一部分。现已确定的磷脂酰肌醇主要有三种:磷脂酰肌醇(phosphatidylinositol , PI),磷脂酰肌醇-4,5-二磷酸(phosphatidylinositol-4,5-bisphosphate , PIP2)和磷脂酰肌醇-4-磷酸(phosphatidylinositol-4-phosphate , PIP),PIP和PIP2是由PI和PIP分别在PI激酶和PIP激酶催化下磷酸化而形成的,其基本结构及其相应磷脂酶(phospholipase)作用位点如图5-7。
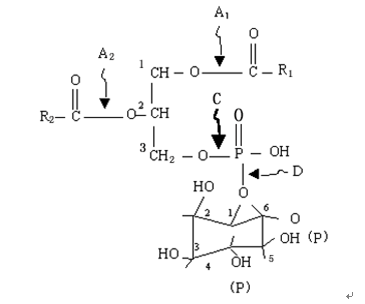
图 5-7 PIP2的分子结构及其相应磷脂酶作用位点
图中箭头所示位置为相应磷脂酶作用位点,这些磷脂酶分别称为磷脂酶A1 ,A2 ,C和D。其中质膜中的磷脂酶C(phospholipase C , PLC)最为重要,它催化PIP2水解形成肌醇三磷酸(inositol-1,4,5-triphosphate , IP3)和二酯酰甘油(diacylglycerol , DG)两种信号分子参与之后细胞信号转导过程,所以,又称双信号系统(图5-8)。PLC可被较低的胞质Ca2+浓度(<1 mmol L-1) 激活,被较高的胞质Ca2+浓度(10 mmol L-1)抑制,从而又和Ca2+信号系统相偶联。
实际上,IP3作为信号分子是通过调节胞质Ca2+浓度而传递信息的。IP3的作用位点是细胞内的钙库,如液泡和内质网等。IP3与钙库膜上的受体结合后,激活钙库膜上的Ca2+通道,使Ca2+从液泡和内质网等钙库中释放出来,引起胞质Ca2+浓度增加,从而启动胞内Ca2+信号系统,称为IP3/Ca2+信号转导途径。已有证据表明,IP3/Ca2+系统在干旱ABA引起的气孔启闭过程中起重要调节作用,如ABA使胞外Ca2+通过质膜通道进入蚕豆保卫细胞,并可引起气孔关闭;在鸭趾草保卫细胞中,ABA处理使保卫细胞胞质Ca2+浓度增加,也是通过IP3作用于钙库释放Ca2+,从而导致气孔关闭;另一方面,IP3通过调节蚕豆细胞K+通道使胞质内K+浓度降低等。
DG作为信号分子是通过激活蛋白激酶C(protein kinase C, PKC)传递信息的。PKC是一种依赖于Ca2+和磷脂的蛋白激酶,当有Ca2+和磷脂存在时,DG、Ca2+、磷脂和PKC结合为复合物,使PKC激活,从而对某些底物蛋白或酶类进行磷酸化,实现信号转导,称为DG/PKC信号转导途径(图5-8)。目前,植物细胞中PKC的确认存在争论,所以,DG/PKC途径在植物细胞中是否存在尚待进一步验证。
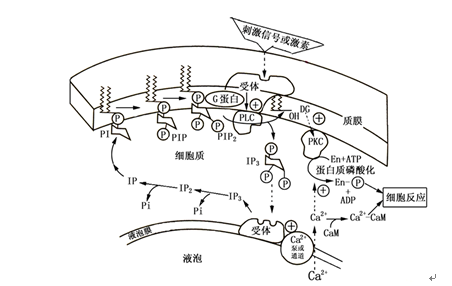
图 5-8 肌醇磷酸代谢循环过程(印自李合生等,2002)
5.4蛋白质的可逆磷酸化
蛋白质的可逆磷酸化是生物体内一种普遍的翻译后修饰方式。蛋白质磷酸化与脱磷酸化分别由蛋白激酶(protein kinase , PK)和蛋白磷酸酶(proteinphosphatase , PP)催化完成。PK催化ATP或GTP g位的磷酸基因转移到底物蛋白质的氨基残基上,而PP则催化去掉磷酸化蛋白质的磷酸基因。
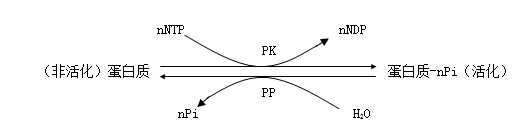
上式中的NTP代表ATP或GTP等核苷酸三磷酸,Pi代表无机磷酸。底物蛋白质被PK磷酸化后发生构象和电荷变化,从而被活化。而PP催化的脱磷酸化则逆转磷酸化的效应。细胞内第二信使(如Ca2+、DAG等)往往通过调节细胞内多种蛋白激酶和蛋白磷酸酶的活性,从而调节蛋白质的磷酸化和脱磷酸化过程,进一步传递信号。蛋白质的磷酸化和脱磷酸化在细胞信号转导过程中具有级联放大信号的作用。胞外即使有很微弱的信号也可以通过一系列连锁反应得到充分放大。如动物细胞中糖原分解代谢中磷酸化酶活性就是通过受体激活一系列的蛋白激酶,导致蛋白质磷酸化的级联(cascade)反应,在一系列的反应中,前一反应的产物是后一反应的催化剂,每次修饰就产生一次放大作用,这种放大作用可以高达成千上万倍。近年来,植物细胞中也发现了参与这种级联反应的蛋白质激酶。蛋白质的磷酸化与脱磷酸化共价修饰调节除了具有显著的级联反应特点外,还有调控细胞内已存在酶的“活性酶量”(磷酸化酶有活性,脱磷酸化酶没有活性),使应答反应更有效;功能上具有多样性,即蛋白质磷酸化与脱磷酸化几乎涉及所有的生理过程;蛋白质磷酸化与脱磷酸化在信号引起的细胞效应中具有持久性,如细胞的分裂和分化等过程;蛋白质磷酸化与脱磷酸化在胞内介导胞外信号时具有专一应答特点。
5.4.1.蛋白激酶
蛋白激酶是一个大家族,植物中约有2%~3%的基因编码蛋白激酶。其共同特点是:表现出一定的底物专一性,但很少具有绝对专一性;具有自身的磷酸化作用(autophosphorylation),即某种蛋白激酶可以利用它本身作为底物,这种作用可以发生在两个酶分子之间相互磷酸化,也可以发生在同一分子之内,即一个酶分子的催化部位可磷酸化同一分子的其他部位;底物蛋白质被磷酸化的氨基酸残基主要是丝氨酸、苏氨酸和酪氨酸等少数几个氨基酸。因此,根据磷酸化靶蛋白的氨基酸残基的种类不同,蛋白激酶分为丝氨酸/苏氨酸激酶、酪氨酸激酶和组氨酸激酶。但有的蛋白激酶具有双重底物特异性,既可使丝氨酸或苏氨酸残基磷酸化,又可使酪氨酸残基磷酸化。另一种分类方法是根据它们是否有调节物来分:信使依赖性蛋白激酶(messenger-dependantprotein kinase)和非信使依赖性蛋白激酶(messenger-independantprotein kinase)或称“独立的”蛋白激酶(independant protein kinase)。
5.4.1.1.钙依赖型蛋白激酶
钙依赖型蛋白激酶(calcium-dependant protein kinase, CDPK)是植物细胞中的一个蛋白激酶家族,1962年Roberts等最早从大豆中得到了钙依赖型蛋白激酶。CDPK有钙结合位点,但不依赖CaM。CDPK具有共同的结构特征,在N端有一个激酶活性域,在C端有一个类似CaM的结构域,两者之间有一个抑制域(图5-9)。当位于CDPK上类似CaM的结构域的钙离子结合位点与Ca2+结合后,抑制被解除,酶就被活化。现已从拟南芥中克隆出10多种CDPK基因,胁迫、机械刺激和激素等均可以引起CDPK基因的表达。现已发现,CDPK的靶蛋白有质膜ATP酶、离子通道和细胞骨架成分等重要生命物质。

图5-9 钙依赖型蛋白激酶的结构示意图
5.4.1.2.类受体蛋白激酶
20世纪80年代从动物细胞中发现了多种类型的酪氨酸蛋白激酶(protein tyrosinekinase,PTK)。与一般的PK相比,PTK具有很高的特异性,只能磷酸化蛋白质中酪氨酸残基。不同PTK之间在氨基酸顺序上表现出很大的同源性。在目前已发现的PTK中,对具有受体功能的酪氨酸蛋白激酶(receptor proteintyrosine kinase,RPTK)的结构与功能研究的较为深入。RPTK结构的共同点是整个分子可分为三个结构域,细胞外的配体结合区,细胞质侧的具有酪氨酸蛋白激酶活性的区域及连接这两个区域的跨膜结构(图5-10)。
RPTK具有多功能性,即它能把信号的接受、膜上的转换以及向细胞内部的传递、转导及引起一定的生理效应等功能集于一身,并具有自身调节功能,也就是说由RPTK介导的信号跨膜传递转换方式比其他信号系统更为直接和简单。由RPTK信号途径介导的生理效应是多方面的,如DNA的合成,离子跨膜转运及多胺合成等等。
目前利用分子生物学方法已从植物细胞中鉴定到多个与动物细胞RPTK同源的基因,由于这些基因产物在植物细胞中还没能证实它们也具有受体功能,也没有发现这类蛋白的天然配基,所以把这类蛋白称之为类受体蛋白激酶(receptor-like proteinkinase , RLPK)。从植物中已克隆RLPK基因推知的蛋白质氨基酸序列结构分析,RLPKs属于丝氨酸/苏氨酸蛋白
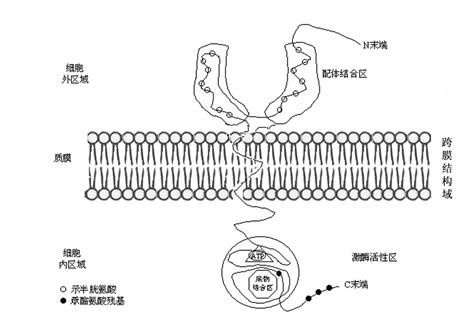
图 5-10 RPTK结构示意图(据Yarden 等,1988)
激酶类。植物细胞的RLPKs具有动物细胞RLPKs类似的三部分结构:即胞外结构域(extra cellular domain)、跨膜螺旋区(transmembrane a helix)和胞内蛋白激酶催化结构域(intracellular protein kinase catalytic domain)。不同RLPKs之间主要区别在于胞外结构域氨基酸序列差别很大。因此,依据胞外结构域的不同,将RLPKs分为三类:第一类为S受体激酶,其胞外结构域与调节油菜自交不亲和的S-糖蛋白的氨基酸序列同源。多数RLPKs属于此类型。第二类是富含亮氨酸受体激酶,其特点是胞外结构域中有重复出现的亮氨酸,油菜素内酯受体属于此类型。第三类为类表皮生长因子受体激酶,其主要特征为胞外结构域具有类似动物细胞表皮生长因子的结构,从拟南芥叶绿体分离到的Pro25属于此类型。虽然利用基因克隆技术已从植物中鉴定出数种RLPK,但其生理功能和分子调控的机制还有待深入研究。
5.4.2.蛋白磷酸酶
蛋白磷酸酶(protein phosphotase ,PP)的主要功能是逆转蛋白磷酸化作用,是一个终止信号或逆向调节的过程,在生命活动的代谢调节中与蛋白质激酶具有同等重要的意义。蛋白磷酸酶与蛋白激酶相对应,分为丝氨酸/苏氨酸型蛋白磷酸酶和酪氨酸型蛋白磷酸酶两类。但是,有些蛋白磷酸酶具有双重底物特异性。关于植物中蛋白磷酸酶结构、功能及其调控的资料很少。最近Luan等报道在豌豆保卫细胞中存在一种Ca2+依赖的蛋白磷酸酶,并证明可能与气孔启闭有关。
关于光受体与光信号转导的分子机制将在第七章(植物的光形态建成)相应内容中讨论,而植物激素与信号转导的分子机制将在第6章(植物生长物质)相应部分讨论。
关键词
信号(signal)信使(messenger)胞间信号(intercellular signal)胞内信号(intracellularsignal)化学信号(chemical signal)信号转导(signal transduction)受体(receptor)配体(ligand)G蛋白(GTPbinding regulatory protein)钙离子稳态(calcium homeostasis)钙调素(calmodulin , CaM)调幅机制(amplitude modulation)调敏机制(sensitive modulation)磷脂酰肌醇信号系统(phosphatidylinositolsignal system)磷脂酶C(phospholipaseC , PLC)肌醇三磷酸(inositol-1,4,5-triphosphate , IP3)二酯酰甘油(diacylglycerol , DG)蛋白激酶(protein kinase , PK)蛋白磷酸酶(protein phosphatase , PP)自身磷酸化作用(autophosphorylation)信使依赖型蛋白激酶(messenger-dependant proteinkinase)非信使依赖型蛋白激酶(messenger-independent protein kinase)钙依赖型蛋白激酶(calcium-dependant protein kinase , CDPK)酪氨酸蛋白激酶(protein tyrosine kinase , PTK)类受体蛋白激酶(receptor-like proteinkinase , RLPK)级联(cascade)
思考题
1.什么叫细胞信号转导?受体和G蛋白与信号转导有何关系?
2.Ca是植物必需的大量元素,而Ca2+作为第二信使必须维持胞质中Ca2+浓度在10-7~10-6 mol L-1,即Ca2+稳态,植物细胞是如何维持胞质Ca2+稳态的?
3.植物细胞的主要钙受体蛋白是什么?CaM有何特点?举例说明胞外信号如何通过钙受体蛋白引起相应生理反应。
4.磷脂酰肌醇信号系统与钙信号系统有何区别和联系?
5. Ca往往提高植物抗逆性(如抗旱性和抗盐性等),你认为Ca是如何起作用的?
6.植物细胞中有那些信号分子?其主要功能是什么?
主要参考文献
1.Buchanan B B. Gruissem W. and R L. Jones. 2000. Biochemistry & Molecular Biology of Plants. The American Society of Plant Physiologists, RockvilleMaryland.
2.Yarden Y. Ulrich A. 1988.Growth factor receptor tyrosine kinases.Ann Rev Biochem, 57:443-478
4.孙大业等编。细胞信号转导,北京:中国农业科技出版社,2000
5.潘瑞炽、董愚得.植物生理学(第四版).北京:科学出版社,2000。
6.李合生主编.现代植物生理学.北京:高等教育出版社,2002
7.王忠主编.植物生理学.北京:中国农业科技出版社,2000
8.李承森主编.植物科学研究进展(第三卷)。北京:高等教育出版社,2000


