第三节 酶促反应动力学(1.5h)
酶促反应动力学是研究酶促反应速率以及各种因素对酶促反应速率影响机制的科学。
酶促反应的速率是单位时间中底物消耗或产物生成的量。底物浓度直接影响反应速度。在特定反应体系中随着底物的消耗,反应速度逐渐下降。测酶促反应的初速度应测初速度。一般为底物消耗5%以下时的速度。
酶促反应的速度受到多种因素的影响,酶浓度、底物浓度、环境因素(温度、pH和抑制剂与激活剂)
一、底物浓度对酶促反应速度的影响
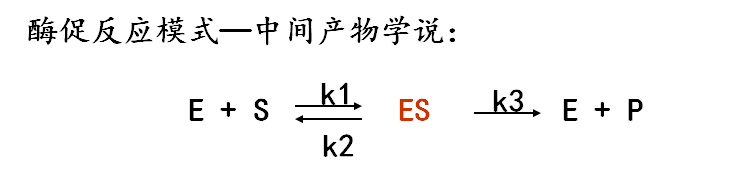
1.米-曼氏方程:早在 1913 年,由 Michaelis 和 Menten 提出的酶促反应动力学方程,又称米氏方程或米曼氏方程,Km 为米氏常数(Michaelis constant)
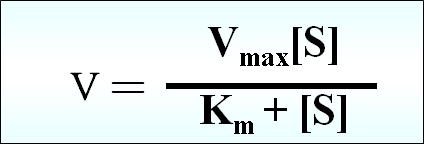
反应速度与底物浓度呈双曲线关系,底物浓度很低时 ( [S] 远小于 Km ),反应速度正比于底物浓度,当底物浓度很高时( [S] 远大于 Km ), 反应速度达到最大值而不再上升。
2.Km 与Vm的意义
(1)Km 的意义:根据米氏方程,当 V=Vmax/2 时,Km=[S],即 Km 是反应速度达到 Vmax 一半时的底物浓度
Km 近似于 ES 复合物的解离常数,可表示酶与底物亲和力的高低,1/Km 与亲和力成正比
Km 是酶的特征性常数,与酶和底物的浓度无关,但受到环境条件的影响
同一种酶对不同的底物具有不同的 Km 值,在酶作用于多底物时,每一底物均有其 Km 值。当一种酶作用于多种底物时,Km 值最小的底物是最适底物,最适底物往往就是天然底物。
(2)Vm 的意义:
Vmax 是酶完全被底物饱和时的反应速度。Vmax=k3[E]
Vmax 与酶浓度成正比,受到环境条件的影响。在一种酶具有多种底物时,对于不同底物有不同的 Vmax。
k3 称转换数,酶被底物饱和后单位时间内每个酶分子催化底物转化为产物的分子数,转换数也是酶的特征性常数。
3.Km值 与Vm值的测定:双倒数方程

二、酶浓度对酶促反应速度的影响
当酶被底物饱和时,反应速度与酶的浓度成正比关系
三、温度对反应速度的影响:在特定温度下,酶促反应速度达到最大值,称酶的最适温度。最适温度不是酶的特征性常数。
四、pH对反应速度的影响:酶活力易受环境 pH 的影响。在一定 pH 时酶表现最高活性,称酶的最适pH。最适 pH 不是酶的特征性常数。
五、抑制剂对反应速度的影响:在不引起酶蛋白变性的情况下导致酶活力的降低或丧失,称为抑制作用(inhibition)。引起抑制作用的物质称为抑制剂(inhibitor)。抑制作用有可逆抑制与不可逆抑制之分。
1.不可逆抑制作用(irreversible inhibition):抑制剂以共价键与酶的必需基团结合导致的酶活性丧失。 不能用超滤、透析等方法去除抑制作用。例如有机磷农药中毒。
2.可逆抑制作用(reversible inhibition):抑制剂与酶非共价结合,引起酶活性降低或丧失,可以通过透析等方法去除。可逆抑制作用可分为:·竞争性抑制作用(competitive inhibition)、非竞争性抑制作用(non-competitive inhibition)、反竞争性抑制作用(uncompetitive inhibition)
(1)竞争性抑制:抑制剂与底物结构相似,与底物竞争结合酶的活性中心
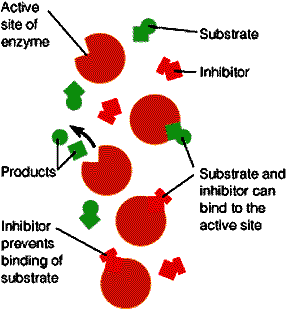
在相同的底物浓度下,抑制剂存在时反应速度较无抑制剂时降低,提高底物浓度可以克服抑制作用。 Vmax 不变, Km 升高。
举例:
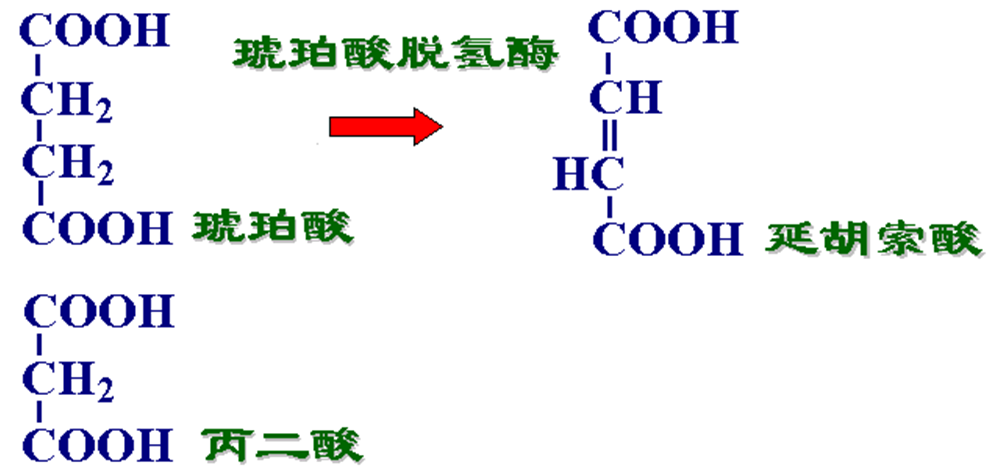
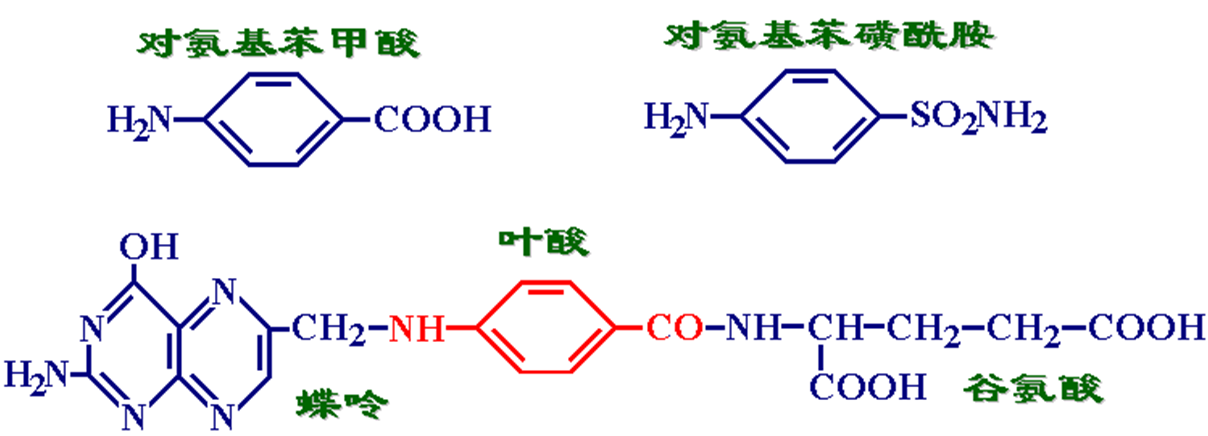
●丙二酸是琥珀酸脱氢酶的竞争性抑制剂
●磺胺类药物(sulfonamides)是对氨基苯甲酸的类似物,可竞争性抑制细菌的二氢叶酸合成酶。
(2)非竞争性抑制:抑制剂与酶活性中心以外的基团结合,干扰酶底物转变为产物。抑制剂与底物间不存在竞争关系,I 可结合 ES,S 也可结合 EI
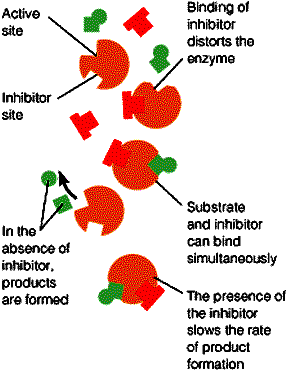
在抑制剂影响下,酶底物复合物分解形成产物的速度下降。抑制作用取决于抑制剂与酶的结合能力,增加底物浓度无法解除抑制。 Vmax 下降;Km 不变。
(3)反竞争性抑制:抑制剂不直接与酶结合,而是倾向与酶底物复合物结合,干扰产物的生成。EIS 不能分解为 E 和 S,抑制剂对 ES 生成有促进作用,Km降低;抑制剂干扰产物生成,Vmax 降低。
六、激活剂对反应速度的影响
激活剂有必需与非必需之分:必需激活剂:在无激活剂存在时酶没有活性,Mg2+ 是多数激酶的必需激活剂,也是酶的金属辅因子;非必需激活剂:无激活剂存在时活性较低,Cl- 是唾液淀粉酶的非必需激活剂
重点内容:影响酶促反应速度的因素:底物浓度、酶浓度、温度、pH值、激活剂和抑制剂,米氏方程及应用,Km的意义,竞争性抑制的特点和应用。
难点内容:米氏方程的推导;抑制剂的作用机制。


