学习点拨
———视频选自中国大学MOOC 山东大学《生物化学》
学习精读
一、蛋白质的紫外吸收
•波长:280nm
•引起紫外吸收的因素:主要是酪氨酸和色氨酸(Tyr,Trp)的共轭双键。
•可用于蛋白质的定量分析。
二、蛋白质的两性解离与等电点
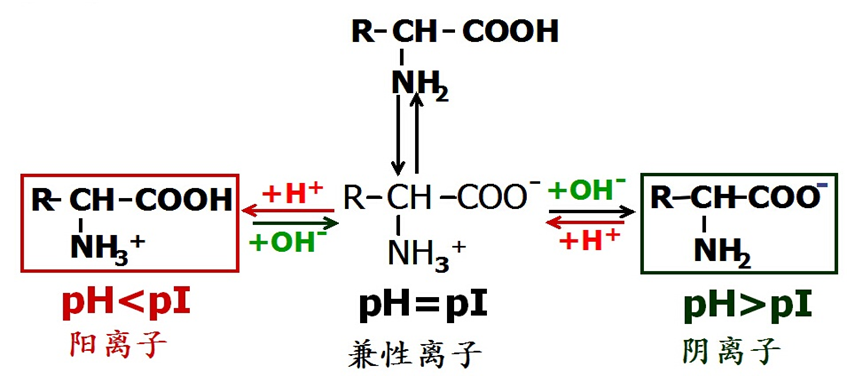
蛋白质的等电点(pI):当蛋白质处于某一pH时,蛋白质解离成正、负离子趋势相等,成为兼性离子,静电荷为零。此时的溶液pH值称为蛋白质的等电点。
pH>pI:带负电荷(成为阴离子)
pH<pI:带正电荷(成为阳离子)
pH=pI时:不带电(兼性离子)
三、蛋白质的胶体性质
蛋白质属于生物大分子,分子量多在1万~10万,分子直径在1~100nm,属于胶体颗粒。
蛋白质胶体溶液稳定的两个因素:水化膜和颗粒表面电荷
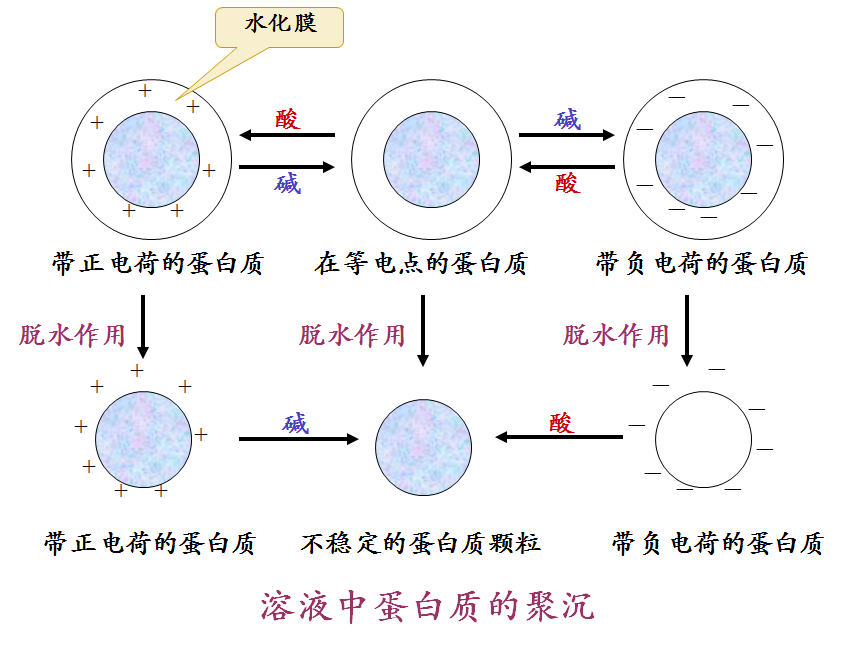
蛋白质溶液具有胶体溶液性质:如不能透过半透膜,高速离心时有沉降现象。
四、蛋白质变性与复性
蛋白质变性:在某些物理和化学因素作用下,蛋白质的特定的空间构象被破坏,从而导致其理化性质改变和生物活性的丧失。
蛋白质变性本质:破坏次级键,不改变蛋白质的一级结构。造成变性的因素:如加热、乙醇等有机溶剂、强酸、强碱、重金属离子及生物碱试剂等 。
蛋白质复性:若蛋白质变性程度较轻,去除变性因素后,蛋白质仍可恢复或部分恢复其原有的构象和功能,称为复性。
五、蛋白质沉淀与凝固
1、盐析(初步分离蛋白质):
在蛋白质溶液中加入高浓度中性盐,使蛋白质从溶液中析出的现象称为盐析。(不引起蛋白质变性)、
原理:破坏水化膜,中和蛋白质所带电荷。
2. 有机溶液沉淀
有机溶剂如乙醇、甲醇等,破坏蛋白质的水化膜,使蛋白质沉淀析出。
3、重金属离子沉淀
重金属离子如Ag+、Cu+、Hg+等,与蛋白质阴离子结合成不溶性的蛋白盐而沉淀
4、生物碱试剂沉淀
生物碱试剂能与蛋白质阳离子结合成不溶性的蛋白盐而沉淀。


