学习精读
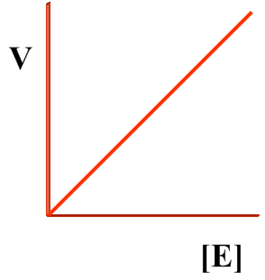
一、酶浓度
当[S]>>[E],酶可被底物饱和的情况下,反应速度与酶浓度成正比。
二、底物浓度

1.[S]很低时,酶促反应速度与[S]呈正比。
2.[S]较高时,反应速度虽然也随S的增加而加快,但不呈正比关系。
3.[S]增高到一定程度时,反应速度趋于恒定,不再随S的增加而加快,达到最大反应速度。
米-曼氏方程
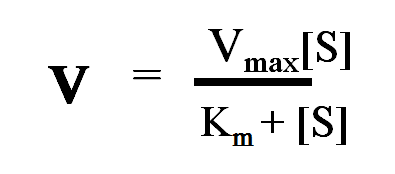
[S]:底物浓度
v:不同[S]时的反应速度
Vmax:最大反应速度(maximum velocity)
Km:米氏常数(Michaelis constant)
Km的意义:
1.Km值等于酶促反应速度为最大速度一半时的底物浓度
2.Km值是酶的特征性常数
3.Km值与酶和底物的亲和力大小成反比
三、pH
1.pH通过影响酶和底物的解离及活性中心的空间构象而影响酶和底物的结合
2.最适pH:酶促反应速度最大时的环境pH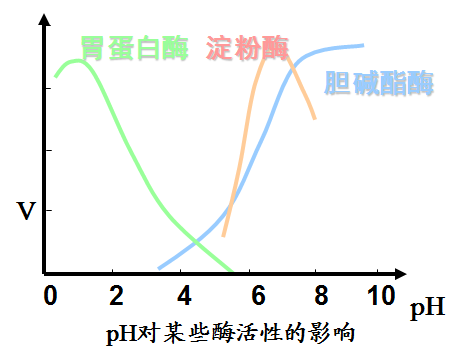
3.动物体内大多数酶的最适pH接近中性
四、温度
1.温度升高加快酶促反应速度
2.温度升高增加酶变性机会
3.最适温度:酶促反应速度最快时的环境温度称为酶促反应的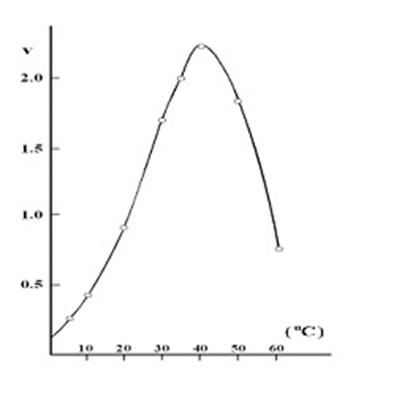
4.一般温血动物组织中酶的最适温度在35~40℃之间
五、激活剂
1.激活剂:使酶从无活性变为有活性或使酶活性增加的物质
2.两类:必需激活剂和非必需激活剂
3.常见激活剂:金属离子、小分子有机化合物
六、抑制剂
抑制剂是指能使酶的催化活性下降而不会引起酶蛋白变性的物质
(一)不可逆性抑制
抑制剂通常以共价键与酶活性中心的必需基团相结合,使酶失活;抑制剂不可用透析、超滤等方法去除。
举例:有机磷中毒
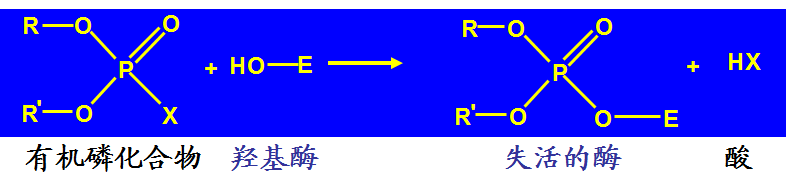
(二)可逆性抑制
抑制剂通常以非共价键与酶或酶-底物复合物以非共价键结合,使酶的活性降低或丧失;抑制剂可用透析、超滤等方法除去。
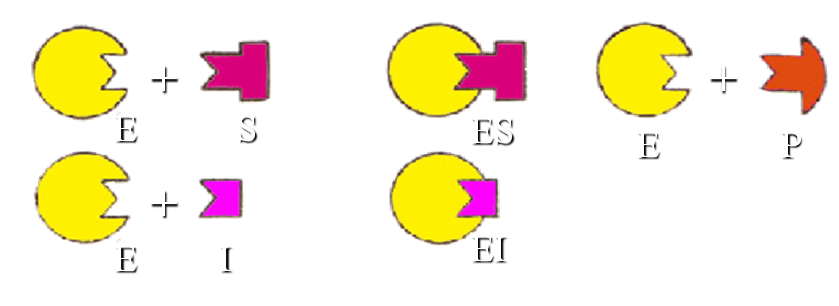
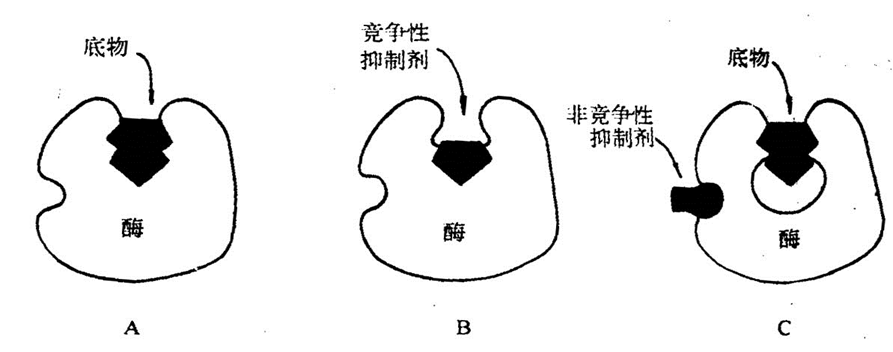
竞争性抑制作用
抑制剂与底物的结构相似,能与底物竞争酶的活性中心,从而阻碍酶底物复合物的形成,使酶的活性降低。这种抑制作用称为竞争性抑制作用。
抑制程度取决于抑制剂与酶的相对亲和力大小,以及抑制剂与底物浓度的相对比例
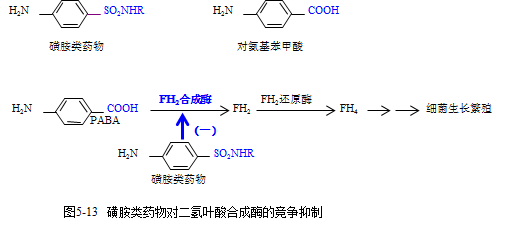
案例分析:磺胺类药物的抑菌机制
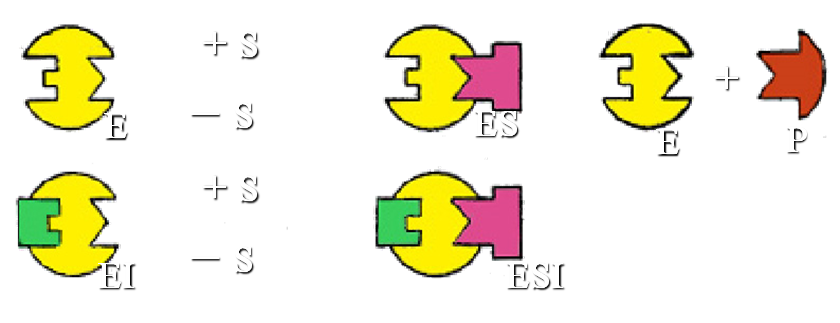
2. 非竞争性抑制作用
抑制剂与酶活性中心以外的必需集团结合,抑制剂与底物之间无竞争关系,但酶-底物-抑制剂复合物(EIS)不能进一步释放产物。
案例分析
磺胺类药物为人工合成的抗菌药,用于临床已近50年,它具有抗菌谱较广、性质稳定、使用简便等优点。磺胺类药对许多革兰氏阳性菌和一些革兰氏阴性菌、诺卡氏菌属、衣原体属和某些原虫(如疟原虫和阿米巴原虫)均有抑制作用。请阐述:1.磺胺药抑菌机制;2.服用磺胺药需要首剂加倍的原因;3.人体细胞是否会被磺胺药抑制,为何?


