-
1 讲稿
-
2 课件与视频
-
3 知识点扩展
-
4 作业
-
5 参考资料
新一代大规模测序技术
2006年随着人类基因组1号染色体基因测序结果的公布,人类利用Sanger测序法完成了整个人类基因组的测序,并发现了人类基因组上与个体健康等各个方面可能密切相关的上百万个SNP。SNP分型鉴定对个体化治疗有着重要意义,传统的SNP分型方法无法同时对大量的SNP进行分型,因而通过个体全基因组测序鉴别SNP拥有重要的意义。Sanger测序法虽然在全基因组测序中做出了重大贡献,但是由于其操作过程复杂而且成本高昂,因此很难在人类个体基因组再测序中得到推广。在市场对低廉简便个体全基因组测序技术的需求和其它学科不断进步的推动作用下,自2005年Roche 454 测序技术诞生以来,相继有6至7种新一代个体全基因组测序技术出现。
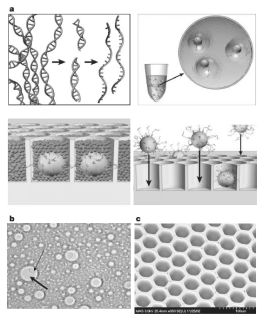
Roche 454测序技术主要包括样品制备和大规模平行焦磷酸测序两大部分。传统测序方法的样品制备过程比较漫长,以高通量鸟枪法为例,其大致包括如下过程:基因组DNA片段化;片段化的DNA与质粒连接;连接产物转化至大肠杆菌;通过培养大肠杆菌得到质粒,质粒待测序。转化大肠杆菌、挑选阳性克隆以及培养大肠杆菌等步骤操作繁琐、资源耗费大,限制了Sanger测序法平行测序的规模。2003年美国约翰霍普金斯医学院的Bert Vogelstein教授在《美国科学院院报》发表了一篇利用emulsion PCR数字化扩增技术检测基因突变的文章[64],此后的2005年,454公司Rothberg研究员利用该技术实现了待测序DNA片段体外大规模平行扩增,从而大大提高了样品制备的效率,为大规模平行测序提供了条件。其样品制备过程如图1所示。
图1a. 基因组DNA经过提取分离得到后,被打碎成小片段,再在片段两端连接接头,并把双链解开成单链(左上)。片段化的单链DNA与磁珠和乳液按照一定的比例混合,经过搅拌形成体积为皮升级油包水的小乳滴,理想状态下乳滴中将只含有一个DNA分子和一个磁珠。油包水的反应体系经过PCR扩增和破乳并制单链后,得到表面连接有数百个DNA分子的磁珠(右上)。将磁珠放于光导纤维蚀刻板的孔洞中(右下),加入焦磷酸测序反应液开始测序(左下)。b.油包水乳滴在显微镜下拍照得到的图片显示,部分乳滴中含有一个磁珠,另一部分没有包含磁珠。c.光导纤维蚀刻板的电子扫描显微镜扫描结果。
Roche 454测序技术样品准备原理