-
1 讲稿
-
2 课件与视频
-
3 知识点扩展
-
4 作业
-
5 参考资料

嘌呤类药物的个体化给药临床实践
儿童急性淋巴细胞白血病(ALL)占儿童肿瘤的78%,在英国的发病率是百万分之30-35,而且呈现0.7%的年增长率。巯嘌呤是ALL的有效治疗药物,6巯嘌呤(6-MP)于1953年在美国上市,然后迅速在欧洲应用。该药是通过阻断鸟嘌呤产生来抑制DNA的合成,从而达到抗肿瘤效果。然而随后发现,该药在某些患者治疗时可引起严重的造血系统毒副反应,又称为继发性白血病或放射性肿瘤。同样的不良反应也发生在另一个嘌呤类药物硫唑嘌呤。在上世纪90年代,研究发现巯嘌呤类药物的毒性反应与巯嘌呤甲基转移酶(TPMT)的活性缺失相关,TPMT基因多态性导致了TPMT酶活的个体间差异。TPMT有二十多种等位基因,其中*2、*3A和*3C等位基因可引起酶活显著下降,当TPMT由两种低酶活等位基因组成纯合子时,TPMT酶活极低,该基因型在高加索人中占0.3%;当TPMT由一种低酶活等位基因和一种高酶活等位基因组成杂合子时,TPMT酶的活性居中,该杂合子基因型在高加索人中占10%。因此在服用6-MP之前,必须通过基因型的分析获知患者的TPMT酶活,对酶活极低和中等的患者来说,要显著降低剂量或改用其他药物。
6-巯嘌呤的代谢路径如图1所示。药物6-MP服用后,首先被三种酶代谢,一种是TPMT酶,将6-MP代谢为无活性的甲基硫嘌呤;另一种是HGPRT酶,将6-MP代谢为6-TIMP,该代谢物进一步被TPMT酶代谢为仅具有普通肝毒性的6-MMP,同时还被IMPD/GMPS代谢为6-TGNs(硫鸟嘌呤核苷酸),6-TGNs通过影响DNA复制和RNA表达达到抑制肿瘤的效果。6-TGNs兼具骨髓毒性,如果浓度过大就产生严重不良反应,引起继发性白血病。因此,控制6-TGNs的浓度至关重要。如果TPMT酶活降低,经TPMT代谢6-MT的通路就被抑制,体内会产生大量的6-TGNs,从而引发严重的毒副反应。服用同样剂量的6-M后,含有突变型TPMT患者的副作用发生率近50%,而野生型TPMT患者的副作用发生率仅有10%。因此在服药前应先检测患者TPMT的基因型,如果发现是杂合型就减半给药,突变纯合型就给予二十分之一的剂量,或换药使用。
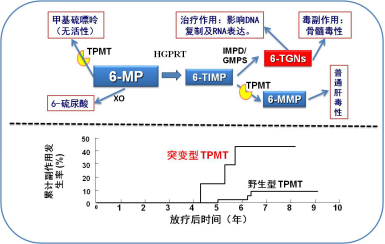
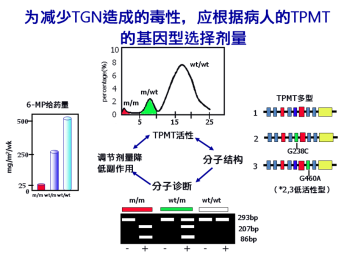
图1、巯嘌呤(6-MP) 的代谢路径及不同基因型患者造血系统毒性发生率





