-
1 讲稿
-
2 课件与视频
-
3 知识扩展图
-
4 作业
-
5 参考资料
溶出度测定
溶出度(dissolution)系指在规定条件下药物从片剂等制剂中溶出的速率和程度。固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透,因此,药物的体内溶出和溶解对吸收具有重要影响。
体外溶出度试验常用于指导药物制剂的研发,评价制剂批间、批内质量的一致性,以及评价药品处方工艺变更前后质量和疗效的一致性等。通常采用多条溶出曲线测定药物的溶出行为,相对体内试验具有更高的灵敏度和更强的区分能力,可更好地反映制剂质量的特点。凡规定检查溶出度的制剂,不再检查崩解时限。
一、溶出度测定法
1、第一法(篮法) 测定前,应对仪器装置进行调试,使转篮底部距溶出杯内底部25mm±2mm。分别量取经脱气处理的溶出介质,置各溶出杯内,实际量取的体积与规定体积的差异应不超过±1%,待溶出介质温度恒定在37℃±0.5℃后,取供试品6片,分别投入6个干燥的转篮内,将转篮降入溶出杯中,注意供试品表面应无气泡,按各品种项下规定的转速启动仪器,计时;至规定的取样时间(实际取样时间与规定时间的差异不超过±2%),吸取溶出液适量(取样位置应在转篮顶端至液面的中点,距溶出杯内壁不小于10mm处;须多次取样时,所量取溶出液的体积之和应在溶出液的1%之内,如超过总体积的1%时,应及时补充相同体积的温度为37℃±0.5℃的溶出介质,或在计算时加以校正),立即用适当的微孔滤膜滤过,自取样至滤过应在30秒钟内完成。取澄清滤液,照该品种项下规定的方法测定,计算每片的溶出量。
结果判定:符合下述条件之一者,可判为符合规定。①6片中,每片的溶出量按标示量计算,均不低于规定限度Q;②6片中,如有1~2片低于Q,但不低于Q-10%,且其平均溶出量不低于Q;③6片中,有1~2片低于Q,其中仅有1片低于Q-10%,但不低于Q-20%,且其平均溶出量不低于Q时,应另取6片复试;初、复试的12片中有1~3片低于Q,其中仅有1片低于Q-10%,但不低于Q-20%,且其平均溶出量不低于Q。以上结果判定中所示的10%、20%是指相对于标示量的百分率(%)。
2、第二法(桨法) 除将转篮换成搅拌桨外(当各品种项下规定需要使用沉降篮或其他沉降装置时,可将片剂等先装入规定的沉降篮内),其他装置和要求与第一法相同。
二、溶出试验方法的建立
普通口服固体制剂仿制药质量一致性评价主要采用比较体外多条溶出曲线相似性这一技术手段进行。尽管仿制制剂和参比制剂的溶出曲线相似并不意味着两者一定具有生物等效,但该法可降低两者出现临床差异的风险。
比较仿制制剂与参比制剂溶出曲线时,应建立能客观反映制剂特点、具有适度的灵敏度和区分力的方法。可参考有关文献,并充分考虑药物的pH-溶解度曲线及pKa 等理化特性,考察溶出装置、溶出介质、搅拌速率和取样间隔期等溶出试验条件,确定适宜的试验条件。
1、溶出仪
溶出度试验推荐使用篮法、桨法,必要时可对其进行适当改装。一般篮法选择50~100 转/分钟,桨法选择50~75 转/分钟。在溶出度试验方法建立的过程中,转速的选择应由低到高。若转速超出上述规定应提供充分说明。所使用仪器需经过校准,改装后仪器需充分评价其必要性和可行性。
2、溶出介质
溶出度试验应尽可能根据药物的性质,并充分考虑胃肠环境的特性,采用能更好地反映药物体内溶出环境的多种溶出介质进行研究,必要时可考虑加入适量表面活性剂、酶等添加物。
1)溶出介质的选择 应考察药物在不同pH 值溶出介质中的溶解度,一般应绘制1.0~7.5 范围内的pH 值-溶解度曲线(例如:在37±0.5℃条件下,药物pKa 在3~5 范围内,选取pH 值1.0、pKa、pKa±1.0、7.5 等多个点测定溶解度)。同时,需考察在37±0.5℃条件下药物主成分在溶出介质中的稳定性,从而满足整个溶出试验过程中测定的要求。对光敏感的药物,还应进行光稳定性考察,确定适当的避光操作条件。
在确定药物主成分稳定的前提下,至少应选择3 种pH 值的溶出介质进行溶出曲线考察,如选择pH 值1.2、4.5 和6.8 的介质进行考察,对于溶解度受pH 值影响大的药物,可能需在更多种pH 值的溶出介质中进行考察,必要时pH 值可细分至0.5。肠溶制剂推荐选择pH值1.2、4.5、6.0 和6.8 的介质。推荐使用的各种pH 值溶出介质的制备方法见附件1。当采用pH7.5 以上溶出介质进行试验时,应提供充分的试验依据。水可作为溶出介质,但使用时应考察其pH 值和表面张力等因素对药物及辅料的影响。
2)溶出介质体积的选择 一般应选择500ml、900ml 或1000ml。
3、溶出曲线的测定
1)溶出曲线测定时间点的选择 取样时间点可为5 和/或10、15 和/或20、30、45、60、90、120分钟,此后每隔1 小时进行测定。
2)溶出曲线试验截止时间点的选择 以下任何一个条件均可作为考察截止时间点选择的依据。a. 连续两点溶出量均达85%以上,且差值在5%以内。b. 一般在酸性溶出介质(pH 值1.0~3.0)中考察时间不超过2 小时。肠溶制剂也可选择pH 值4.5 的溶出介质替代酸性溶出介质进行考察。c. 在其它各pH 值溶出介质中考察时间不超过6 小时。
4、溶出条件的优化
在截止时间内,药物在所有溶出介质中平均溶出量均达不到85%时,可优化溶出条件,直至出现一种溶出介质可达85%以上。优化顺序为提高转速、加入适量的表面活性剂、酶等添加物。表面活性剂浓度应从0.01%~1.0%(W/V)依次递增。当某些特殊药品的溶出介质需要高度模拟人体生物环境时,可使用人工胃液和人工肠液。
附件:溶出介质制备方法
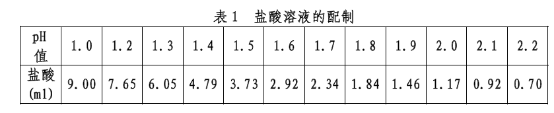
1、盐酸溶液
取下表中规定量的盐酸,加水稀释至1000ml,摇匀,即得,见表1。
2、醋酸盐缓冲液
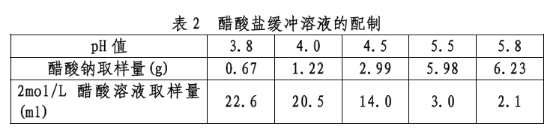
2mol/L 醋酸溶液:取120.0g(114ml)冰醋酸用水稀释至1000ml,即得。取下表中规定物质的取样量,加水溶解并稀释至1000ml,摇匀,即得,见表2。
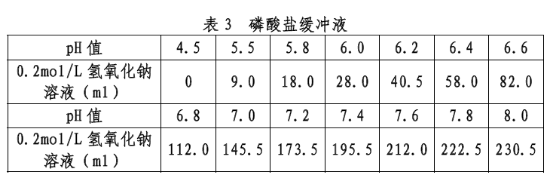
3、磷酸盐缓冲液
0.2mol/L 磷酸二氢钾溶液:取27.22g 磷酸二氢钾,用水溶解并稀释至1000ml。
0.2mol/L 氢氧化钠溶液:取8.00g 氢氧化钠,用水溶解并稀释至1000ml。取250ml 0.2mol/L 磷酸二氢钾溶液与下表中规定量的0.2mol/L氢氧化钠溶液混合后,再加水稀释至1000ml,摇匀,即得,见表3。
以上为推荐采用的溶出介质配制方法,如有必要时,研究者也可根据研究结果采用其他的溶出介质以及相应的配制方法。