-
1 讲稿
-
2 课件与视频
-
3 知识点扩展
-
4 作业
-
5 参考资料

抗凝药物氯吡格雷的个体化给药临床实践
氯吡格雷是目前广泛应用于临床的一种抗血小板药,已作为心肌梗死、缺血性卒中和周围血管病的二级预防用药,也常用血管支架术的抗凝药。由于药效明确、毒副作用小,很快就获得市场的好评,销量节节攀升。然而氯吡格雷的抗血小板聚集效果存在显著的个体差异。很大一部分患者存在抵抗现象,氯吡格雷抵抗的机制尚不完全清楚,基因多态性是氯吡格雷抵抗的重要原因。
氯吡格雷为无活性的前体药物,其吸收代谢过程如图1所示。口服后,首先在小肠的吸收受到ABCB1(ATP-binding cassette subfamily B member1)基因编码的质子泵P糖蛋白调控。经小肠吸收的氯吡格雷药物前体经血液运送至肝脏。进入肝脏的氯吡格雷药物前体经历两种代谢途径:85%的药物前体通过酯酶(CES1)代谢为无活性物质,这些无活性代谢物经尿液和粪便排出。少数(约15%)通过肝脏微粒体内细胞色素P450的催化作用下转化为有活性的代谢产物,然后可选择性不可逆地与血小板膜表面的ADP受体结合, 减少ADP结合位点,阻断ADP对腺苷酸环化酶的抑制作用,抑制纤维蛋白原参与的血小板聚集。研究发现,虽然参与氯吡格雷代谢的细胞色素P450亚家族有多种,但只有CYP2C19基因发生遗传变异后,可导致氯吡格雷活性产物浓度显著减少,从而影响氯吡格雷抗血小板的效果,产生氯吡格雷抵抗,发生心血管事件。
2010年3月12日,美国食品药品监督管理局(FDA)在氯吡格雷的药物说明书中增加了应对代谢不良者进行基因检测的“黑框警告”:氯吡格雷代谢不良者,其在体内不能有效地转化为发挥药物作用的活性形式,药物疗效因而显著降低,提醒临床医生应对编码细胞色素P450的CYP2C19基因进行检测,再根据此项检查来判断患者CYP2C19的功能,如属于氯吡格雷代谢不良者,医生应考虑增加氯吡格雷的剂量或改用其他抗血小板药物。在JAMA上有一篇里程碑式的研究表明(如图2所示),对野生型CYP2C19的患者来说,服用75 mg的氯吡格雷就可以达到有效的药物浓度;而对于杂合型的患者来说,服用225 mg的氯吡格雷才可以达到有效的药物浓度;但对于纯突变型的患者来说,即使服用300 mg的氯吡格雷也达不到有效的治疗效果。
CYP2C19基因多态性存在人种差异,白种人CYP2C19突变型约2%,黑种人约4%,但中国人高达14%,所以中国人服用氯吡格雷时更应该检测患者的基因型。美国FDA早就发现波立维对华裔无效率高达14%。
附:美国FDA对氯吡格雷用药的黑框警告
(1)使用氯吡格雷前需要检测病人CYP2C19基因多态性,主要检测CYP2C19*2和*3位点。
(2)CYP2C19*2与*3基因型人群为慢代谢人群,氯吡格雷前体药物转化速率慢,应增加用药剂量,从300 mg/d可以增加到600 mg/d。
(3)在使用氯吡格雷时要避免使用CYP2C19抑制性药物,如奥美拉唑。
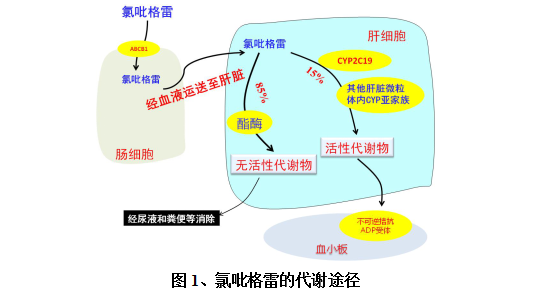
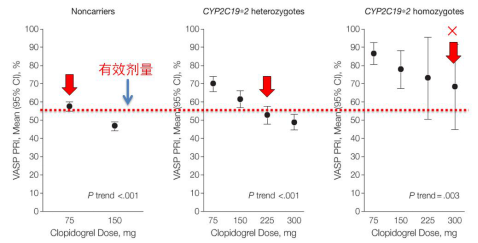
图2、提高氯吡格雷维持剂量对改善携带CYP2C19突变型等位基因患者的治疗效果
如图23所示,氯吡格雷在体内需要经过肠内的吸收和肝脏的代谢才能发挥其抗血小板作用。ABCB1基因在氯吡格雷的肠内吸收中发挥重要的作用。ABCB1是编码P-糖蛋白外排功能的基因,其基因多态性可能会影响P-糖蛋白的活性和功能,从而影响药物在体内的处置。在已发现的50个SNPs中,外显子26的C3435T基因多态性具有重要的生物学意义。
ABCB1 基因位于人类7 号染色体q21.1,其cDNA 全长4669 bp,由28 个外显子组成,转录可得到4.5 kb 的mRNA,编码一个170 kDa 的跨膜糖蛋白-糖蛋白。P 糖蛋白是一种重要的转运蛋白,氯吡格雷是P 糖蛋白的作用底物之一,抑制P 糖蛋白可以影响氯吡格雷的生物学活性。研究发现在高加索人群中,ABCB1基因3435C→T 多态性与冠心病患者PCI术后的死亡、心肌梗死、卒中等心血管事件相关。如图3所示,携带ABCB1基因3435 TT 型的个体发生死亡、心肌梗死、卒中的风险为12.9%,而携带CT和CC 型个体死亡、心肌梗死、卒中发生的风险分别为8.2%和7.7%。所以,ABCB1基因3435 TT 型是氯吡格雷抵抗的高风险基因型。
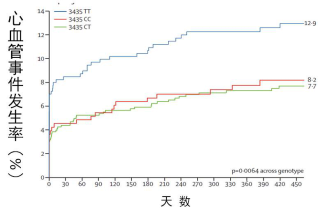
图3、ABCB1基因多态性与氯吡格雷抵抗的关系
由于氯吡格雷在体内需要经过肠内的吸收和肝脏的代谢才能发挥其抗血小板作用,应该将氯吡格雷的肠吸收和肝代谢酶的多态性综合考虑。如图4所示,当CYP2C19基因为突变型和ABCB1基因为3435 TT时,心血管不良事件发生率为13.6%;当CYP2C19基因为野生型、ABCB1基因为3435 TT(酶活下降)时,心血管不良事件发生率下降到12.6%;当CYP2C19基因为突变型、ABCB1基因为3435 CC(酶活正常)时,心血管不良事件发生率下降到11.5%;而当CYP2C19基因为野生型、ABCB1基因为3435 CC(酶活正常)时,心血管不良事件发生率仅有6.3%。
有关基因变异与氯吡格雷敏感度的关系一直受到关注,虽然有很多结果表明CYP2C19和ABCBl(C3435T)与氯吡格雷敏感度有关,但有研究表明,这些基因变异与氯吡格雷敏感度的相关性仍存在较多分歧,说明还有别的遗传因素与氯吡格雷抵抗有关
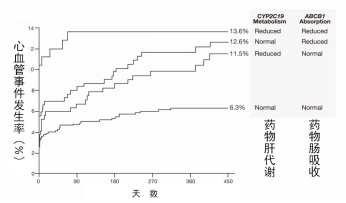
图4、联合CYP2C19和ABCB1基因多态性与氯吡格雷抵抗的关系





