-
1 讲稿
-
2 课件与视频
-
3 知识点扩展
-
4 作业
-
5 参考资料

实时荧光定量PCR技术
常规PCR扩增产物是通过琼脂糖凝胶电泳、溴化乙锭染色、紫外光观察结果,或者通过聚丙烯酰胺凝胶电泳、银染检测,这不仅需要多种仪器设备,而且费时费力,所使用的染色剂溴化乙锭和丙烯酰胺等物质对人体又有害;这些繁杂的实验过程还给污染和假阳性提供了机会。如果能在PCR扩增结束后不打开反应管盖即可实现扩增产物的检测,就可以克服常规PCR扩增的这些缺点。在此基础上,美国Perkin Elmer公司于1995 年开发了实时荧光定量PCR技术。该技术是一种核酸定量技术,通过对荧光信号的检测,实现了对PCR过程中产物量的实时监测,并可以精确计算出PCR的初始模板量。因此,被广泛应用于生物病原体检测、突变检测和多态性分析。实时荧光定量PCR只须在加样时打开一次盖子,其后的过程完全是闭管操作,无需PCR后处理,无须对样品进行电泳,直接对反应管内的扩增产物进行检测;具有操作简单、速度快等优点。近年来,基于这一检测原理,通过设计各种形式的探针,发展了多种检测SNP的技术,如TaqMan探针技术、分子信标技术和高分辨率溶解曲线检测技术等。
TaqMan探针技术[1]是由美国Perkin Elmer公司于1995年开发的一种核酸定量技术,也是最早发展的一种实时荧光定量PCR技术。探针的5′-末端和3′-末端分别标记荧光基团和淬灭基团,两者能发生荧光共振能量转移而不产生荧光。在PCR反应过程中,Taq酶的5′-核酸外切酶活性将与DNA模板结合的探针降解,使得荧光基团与淬灭基团分离而发出荧光。因此,可以通过检测PCR过程中或PCR之后产生的荧光信号来实现DNA模板的定量。目前,该技术已被广泛用于SNP的检测。
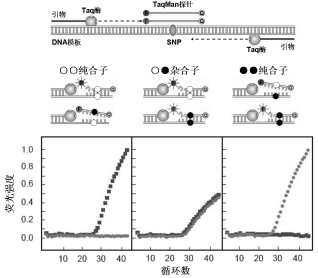
TaqMan探针技术测定SNP的原理
分子信标技术(Molecular beacons)是Tyagi等在1996 年根据荧光共振能量转移现象首次成功设计的,由于这种技术在单碱基变异检测中显示出了非常高的特异性,两年之后,他们将这种技术应用到了SNP检测中。分子信标探针技术具有PCR 技术的高效核酸扩增特性、核酸探针杂交的高特异性,以及荧光技术的高灵敏性和可计量性。目前,分子信标法已被广泛应用于基因变异研究、病原微生物的检测和肿瘤研究等多个领域。随着对分子信标特性研究的深入及新型分子信标的出现,人们发现分子信标作为一种核酸探针,不仅适用于体外核酸分析,而且也适用于活体分析。此外,该技术还可以用于蛋白质等能与核酸发生相互作用的物质分析,是一种极好的研究蛋白质与核酸的工具。
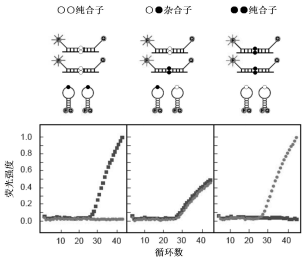
分子信标技术检测SNP的原理
高分辨率熔解曲线(High Resolution Melting, HRM)技术是在熔解曲线法的基础上发展起来的一种可用于检测SNP的新技术。该技术不需要标记探针就可以快速准确地对SNP进行分型;还可用于短片段重复序列的分析、序列匹配、突变扫描、甲基化和RNA编辑等方面的研究。该技术既可用于未知SNP的分析,也可用于已知SNP的检测。高分辨率熔解曲线分析技术筛查未知SNP的原理如图13-3所示,即通过实时监测升温过程中双链DNA荧光染料与PCR扩增产物的结合情况来实现。在PCR 反应时引入饱和荧光染料,荧光染料在PCR 扩增的过程中嵌入到DNA双链中。当嵌有染料的DNA 分子解链的时候,仪器对荧光信号进行采集,绘制出DNA分子的熔解曲线。如果存在SNP 位点,则会产生SNP 位点不匹配的异源双链DNA,该双链DNA在升温过程中会先解开,荧光染料从局部解链的DNA分子上释放,呈现出不同的熔解曲线形状及熔解温度(Tm值),通过专业的分析软件可以快速确定是否存在SNP。
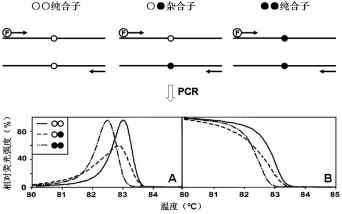
高分辨率熔解曲线分析技术筛查未知SNP的原理
A:原始熔解曲线,B:归一化后的熔解曲线。





