第二节 消化管各段的消化功能
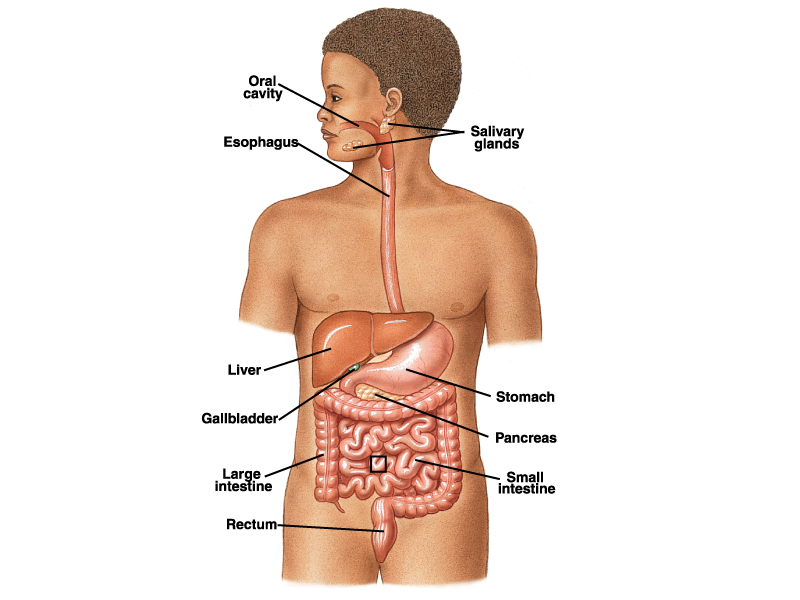
一、口腔内消化
消化从口腔开始。食物在口腔内经过咀嚼被磨碎,与唾液混合形成食团。唾液中的消化酶对食物有较弱的化学性消化作用。
1、唾液的成分及作用
唾液是由唾液腺分泌的无色无味,弱酸性(pH接近7.0)的液体。每天分泌量约为1~1.5L,其中约99%是水,其余为无机盐、黏蛋白、唾液淀粉酶、溶菌酶等。
唾液的作用有:①清洁和保护口腔;②溶解食物,引起味觉;③溶菌酶等具有抗菌作用;④唾液淀粉酶可使食物中的淀粉分解为麦芽糖;⑤其它作用:唾液腺可排泄铅和汞等重金属元素。
2、咀嚼与吞咽
咀嚼是一种反射活动,其主要作用是切割并磨碎食物,使食物与唾液充分混合,有利于淀粉的化学性消化。吞咽是由一系列动作组成的复杂的反射活动,其主要作用是使食团从口腔进入胃内。
二、 胃内消化
胃具有暂时储存食物和消化的功能。食物在胃内经过化学性消化和机械性消化,形成食糜,被逐次排入十二指肠。
(一)胃液成分和作用
胃液是无色酸性液体,pH为0.9~1.5,正常成人每日分泌量为1.5~2.5L。胃液的主要成分有水、盐酸、胃蛋白酶原、黏液和内因子等。
1.盐酸 又称胃酸,由壁细胞分泌。
胃酸的主要作用有:①杀灭随食物入胃的微生物;②使食物中的蛋白质变性,易于消化;③激活胃蛋白酶原,使之转变成有活性的胃蛋白酶,并为胃蛋白酶提供适宜的酸性环境;④与钙和铁结合,促进其吸收;⑤进入小肠后,可促进胰液、胆汁和小肠液的分泌。
2.胃蛋白酶原 由主细胞分泌,无活性。在酸性条件下被激活为胃蛋白酶,后者可激活更多的胃蛋白酶原。胃蛋白酶能使蛋白质水解为胨和少量多肽。
3.黏液 主要由胃黏液细胞分泌,在胃黏膜表面形成黏液凝胶保护层,防止胃黏膜免受坚硬食物的机械性损伤。还能与胃内HCO-3联合作形成黏液-碳酸氢盐屏障,可有效阻挡胃黏膜表面的H+向胃壁扩散,保护胃黏膜免受H+的侵蚀。
4.内因子 由壁细胞分泌,能与食物中的维生素B12结合,使其易于被回肠吸收。
(二)胃的运动
1、胃的运动形式
(1)容受性舒张 当咀嚼和吞咽时,食物对咽、食管等处感受器的刺激可反射性地引起胃壁平滑肌舒张,使胃腔容量增大,可容纳大量食物而保持胃内压相对稳定。
(2)紧张性收缩 胃壁平滑肌经常处于一定程度的持续收缩状态,有利于维持胃的正常位置和形态。
(3)蠕动 胃蠕动出现于食物入胃后5分钟左右,起始于胃的中部,约每分钟3次。胃蠕动有利于食糜的搅拌和磨碎,并与胃液充分混合,有利于化学性消化,并将食糜推送入十二指肠。
2、胃的排空
胃排空是指食糜由胃排入十二指肠的过程。食物在进入胃腔后数分钟即有部分食糜被排入十二指肠。食糜的理化性状影响排空速度,糖类排空最快,蛋白质次之,脂肪最慢;稀的流体食物比稠的固体食物排空快;小颗粒物质比大颗粒物质排空快;等渗溶液比高渗溶液排空快。混合性食物由胃完全排空的时间约为4~6h。
3、呕吐
呕吐是将胃和肠内容物从口腔驱出体外的一种反射活动。呕吐中枢位于延髓。来自身体许多部位的感受器的传入冲动都可到达呕吐中枢,发动呕吐反射。呕吐能排出摄入胃内的有害物质,因此具有保护意义;但过度呕吐会丢失大量消化液,导致机体失水和电解质平衡的紊乱。
三、小肠内消化
小肠内消化是整个消化过程中最重要的阶段。食糜在小肠内受到胰液、胆汁和小肠液的化学性消化以及小肠运动的机械性消化后,消化过程基本完成。
(一)胰液的成分和作用
胰液是由胰腺外分泌部分泌的无色碱性液体,pH约为8.0,每日分泌约1.5L,胰液的主要成分为水、碳酸氢盐及多种消化酶。
1.碳酸氢盐 主要作用是中和进入十二指肠的胃酸,保护肠黏膜免受强酸的侵蚀;同时,也为小肠内多种消化酶提供适宜的碱性环境。
2.胰淀粉酶 将淀粉分解为麦芽糖。
3.胰脂肪酶 将脂肪分解为脂肪酸、甘油一酯和甘油。
4.蛋白水解酶 主要有胰蛋白酶、糜蛋白酶等,它们都是以无活性的酶原形式存在于胰液中。小肠液中的肠激酶可以激活胰蛋白酶原,胰蛋白酶本身也能将其激活。糜蛋白酶原被胰蛋白酶活化。胰蛋白酶和糜蛋白酶均能分解蛋白质为胨。两者共同作用时,可将蛋白质为解为多肽和氨基酸。
胰液含有的消化酶种类多,作用全面,因而胰液是最重要的消化液。
(二)胆汁的成分和作用
胆汁由肝细胞分泌,其主要成分为水、无机盐、胆盐、胆色素、胆固醇和卵磷脂等,不含消化酶。其中胆盐是胆汁中参与消化、吸收的主要成分。胆盐的主要作用:
1.使脂肪乳化成为脂肪微滴,增加了脂肪与胰脂肪酶的作用面积,利于脂肪的消化。
2.可形成微胶粒,使脂肪分解产物如脂肪酸、甘油一酯等均可掺入其中,有利于脂肪消化产物的吸收。
3.促进脂溶性维生素(维生素A、D、E、K)的吸收。
(三)小肠液
小肠液由十二指肠腺和小肠腺分泌。十二指肠腺主要分泌黏稠的碱性液体,能保护十二指肠粘膜免受胃酸侵蚀。小肠腺分泌液中主要是水和无机盐,还有肠激酶和黏蛋白等,是小肠液的主要部分。肠激酶是一种消化酶,它能激活胰蛋白酶原。黏蛋白具有润滑作用,并防止黏膜受到机械损伤。大量的小肠液可稀释消化产物,使其渗透压下降,有利于吸收。
(四)小肠的运动
1.紧张性收缩 小肠平滑肌的紧张性收缩,有利于肠内容物的混合和推进。
2.分节运动 是一种以环行肌为主的节律性舒缩运动。食糜所在的一段肠管,一定间隔的环行肌同时收缩,把食糜分割成许多节段;随后,原收缩处舒张,而原舒张处收缩,使原来的节段分为两半,而相邻的两半则合拢形成一个新的节段(图6-1 )。如此反复进行,使食糜与消化液充分混和,并使其与肠壁紧密接触,有利于消化和吸收。
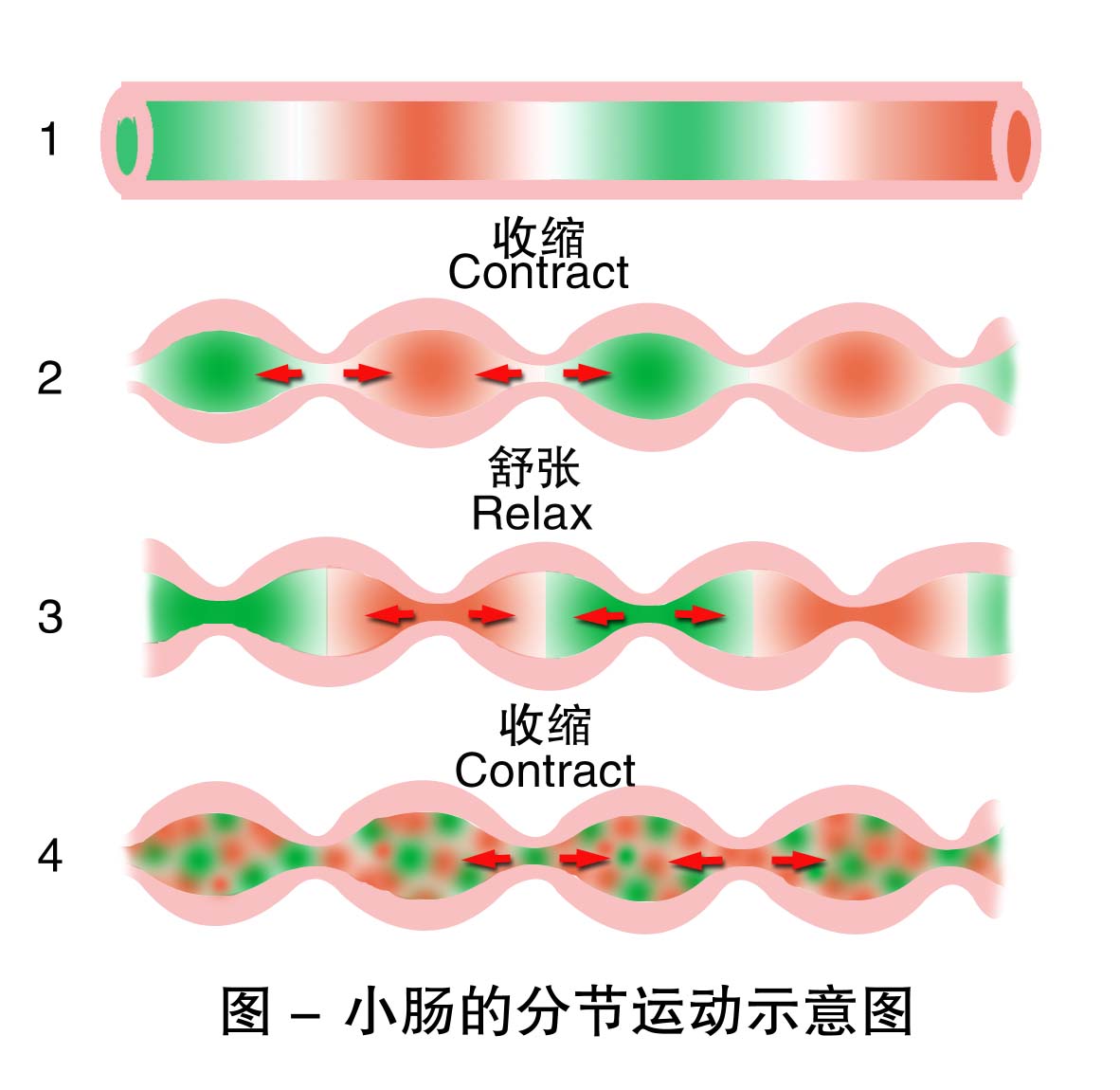
3.蠕动 小肠蠕动的速度较慢,由蠕动推动食糜在小肠内移动的速度也很慢,具有辅助分节运动的作用。小肠还有一种进行速度快、传播较远的蠕动,称为蠕动冲。它可将食糜从小肠的始端一直推送到末端或直达结肠。
四、大肠的功能
人类的大肠没有重要的消化作用,其主要功能有:①吸收肠内容物中的水分和无机盐,参与机体对水、电解质平衡的调节;②吸收由结肠内微生物合成的B族维生素和维生素K;③完成对食物残渣的加工,形成并暂时储存粪便,以及将粪便排出体外。
幽门螺杆菌的发现
消化性溃疡,包括胃溃疡和十二指肠溃疡,是一种常见的遍布世界的慢性消化系统疾病。 它们的发生一向被认为是攻击因子如胃酸和胃蛋白酶与胃黏膜保护机制之间的不平衡所致。 Sehwarz的名言“无酸则无溃疡”,成为将近一个世纪以来西方医学界制服溃疡的指导思想 和治疗原则。在日常生活中,应激、食物、吸烟、饮料以及其他因素引起的胃酸分泌增加, 被认为是引起大多数溃疡的原因。无论是内科用药还是外科手术(包括胃大部切除术和胃迷 走神经切断术),都以止酸治疗为主。在溃疡研究的道路上,也是以发现能够抑制胃酸分泌 的药物为目标。这种努力曾经取得重大成就,特别是近年来发现的一系列组胺H2受体阻断 剂,如西咪替丁(cimetidine)、雷尼替丁(ranitidine)等,已用于治疗 90%的溃疡病;但 这些药物并不理想,它们能使溃疡愈合,但不能根治。停药后溃疡的复发率很高,例如,8 周后有 80%复发,2 年内的复发率可高达 100%。说明根治溃疡病的问题还远未解决。 1982 年 4 月,西澳大利亚皇家医院的年轻住院医师马歇尔(Barry J. Marshall)和病理 学家瓦伦(J. Robin Warren)偶然从一位慢性活动性胃炎患者的胃窦黏膜切片中发现了一种 螺旋形细菌新种。后来又从 100 位同类患者的胃黏膜切片中发现 58 位有这种细菌。他们试 图培养这种细菌,虽多次失败,但最后还是繁殖成功。他们观察到,这种细菌存在于几乎全 部患有慢性活动性胃炎和消化性溃疡病人的胃壁中。这种新发现的细菌原先命名为幽门弯曲 菌( campylobacter pylori),以后根据其形态、生化等特点,正式更名为幽门螺杆菌(helicobacter pylori)。 关于细菌产生溃疡的观点,其实早有报道。早在 1892 年就有人提出胃内存在有螺旋形 细菌,但在用胃组织进行细菌培养的尝试中都失败了,曾认为螺旋形细菌是活组织在检查时 被污染所致。通常认为,由于胃内的酸度、黏液层以及其他因素的作用,胃内不适合细菌生 长。所以,马歇尔等人的上述工作,一开始就遇到很大的阻力。他们提交的论文,权威的《英 国医学杂志》没有接收。1983 年 9 月在比利时召开的微生物学学术会议中,大多数与会者 都不相信他们的发现。这使马歇尔受到很大打击。他决心在自己身上做试验。他将幽门螺杆 菌混在肉汤中喝进自己肚里,72 小时后,他感到胃痛、呕吐、睡不着觉。他终于体验到急 性胃病患者的痛苦心情。几天后,他将铋剂(文献上早有报道用铋制剂来治疗胃溃疡)和抗 生素合用,治好自己的胃痛。这一病例经胃窦组织活检,被确定为胃炎。 马歇尔等的工作得到一些临床专家的认可,例如美国休斯顿就有几家医学机构进行这项 研究。他们将雷尼替丁、四环素和灭滴灵(metronidazole)以及铋制剂合并应用 2 周,发现 十二指肠溃疡患者的复发率仅为 12%,而胃溃疡患者的复发率仅为 13%。对比之下,单用 雷尼替丁治疗的十二指肠溃疡患者的复发率高达 95%,而胃溃疡患者的复发率也高达 74%。
近年来,幽门螺杆菌的研究已成为国际上医药卫生界的一个热门课题,已出版专著数册, 国际专题会议数次,每年发表的论文千余篇。美国国立卫生研究院(NIH)还于 1994 年 2 月召开了专家小组会议,高度评价了马歇尔等的重要发现,对幽门螺杆菌在消化性溃疡中的 作用,形成了一致意见,明确了幽门螺杆菌的感染与消化性溃疡密切相关,并与胃癌也有关 联,从而把治疗溃疡疾病的战略由制酸转变为根除幽门螺杆菌的感染。现在已有人提出:“无 幽门螺杆菌感染则无溃疡”。这真是一次革命性变化。马歇尔的星星之火,已形成了燎原之势!有鉴于此,马歇尔和瓦伦两位科学家荣获了 2005 年诺贝尔生理学和医学奖。 目前人们对于幽门螺杆菌的流行病学、微生物学研究以及与慢性胃炎、胃十二指肠溃疡、 胃癌的关系等都有了许多的了解。 幽门螺杆菌的流行很广泛,遍布于全世界,成为人类最普遍的细菌感染之一。全球有过 半数 40 岁以上的人都感染有此菌。且一个人一旦感染了它,几乎一生都保持感染。在发达 国家中,年龄在 20~60 岁的人群,感染率为 40%~50%;而在发展中国家的成年人,感染 率竟达 60%~80%。而且,此菌的流行随年龄的增长而增长。在发展中国家,10 岁健康儿 童的感染率约为 10%,但常在 10 岁前即发生;这比发达国家儿童的感染要早约 10 年。幽 门螺杆菌存在于唾液、胃液、胃黏膜以及粪便中。此菌的传播途径最可能的是粪便和口腔的 接触,呼吸和说话时飞沫的传播可能也是重要的传染途径之一。按中国习惯用筷子夹食餐桌 上共享的菜肴,其幽门螺杆菌流行率也高于相对不用筷子的分食者。 幽门螺杆菌是一种具有 S 形或螺旋形体态的革兰氏阴性杆菌,有 4~6 条单极鞭毛,能 作螺丝锥状的弯曲运行。它在氧中或长时间培养液中能形成球形,这种形式被认为是处于一 种蛰伏状态,能帮助它在不利条件下生存下来。此种菌在 30 ℃ 和 42 ℃时生长极差,它的最 适 pH 是中性,在 pH3.0 的培养液中迅速死亡。它主要栖居在胃窦部,也见于十二指肠部和 胃体部。 由于幽门螺杆菌具有鞭毛和弯曲结构,能使它在高度黏稠的液体中运行,从而很快地通 过胃腔的酸性环境,自由地穿透胃黏膜表面的黏液层而黏附并栖居于胃上皮表面的中性环境 中。此菌可能通过菌体上存在几种黏附素(adhesin)分子的介导,与黏液分泌细胞结合。此 外,在胃黏膜上皮细胞上可能存在对此种螺杆菌有高度亲和力的受体。 研究资料表明,幽门螺杆菌是所有胃和十二指肠疾病的祸首,它的感染是造成胃炎、胃 溃疡、十二指肠溃疡、功能性消化不良以及胃癌的病因。 产生胃炎的正常志愿者以及用此菌造成的动物模型实验发现,在慢性非特殊性胃炎患 者,其炎症主要在胃窦部,此菌的感染率为 70%~100%。萎缩性胃炎的病人 44%~97%有 此菌感染。现有证据表明,螺杆菌感染与胃炎之间存在强烈的因果关系。 已有很强的证据提示,幽门螺杆菌与消化性溃疡的发生有密切关系。幽门螺杆菌是十二 指肠溃疡形成与复发的产生原因,在十二指肠溃疡患者的胃中几乎 100%可检出此菌。如上 所述,此菌与慢性胃窦胃炎的关系极为密切,而十二指肠溃疡患者也常伴有慢性胃炎,且后 者被普遍认为是十二指肠溃疡的危险因素。临床观察到,根除此菌后可使十二指肠溃疡的愈 合率增加以及复发率明显降低;幽门螺杆菌的感染在胃溃疡的形成中也有重要作用,但不如 此菌与十二指肠溃疡那样密切。在成年胃溃疡患者中,大约平均有 70%有此菌感染,根除 此菌能加速胃溃疡愈合并降低其复发率。 目前只有中等的流行病学证据认为,幽门螺杆菌与胃癌有关。由于此菌可在胃内形成的 菌落短则几年,甚至几十年,长期存在的慢性炎症可使发生胃癌的危险性增加 3~12 倍。因 此设想,幽门螺杆菌可能是产生胃癌的病因之一,此外,如环境、饮食、遗传等因素都参与 慢性胃炎的发展和胃癌的形成。临床上也发现,胃癌可发生在无幽门螺杆菌的病人,相反, 大量幽门螺杆菌感染者并不一定发展为胃癌,说明胃癌的产生机制与幽门螺杆菌的关系尚不 明确。 关于幽门螺杆菌的致病机制已有许多研究。一些学者设想,此菌对胃、十二指肠的损伤是由于减弱了黏膜局部的防御机制所致。幽门螺杆菌感染明显地改变并损害黏液层、上皮细 胞、胃血流以及胃泌素细胞和生长抑素细胞的功能。这些变化被认为是细菌产生的多种酶, 如尿素酶、蛋白酶、脂肪酶和磷脂酶,以及细胞毒素A,加之胃肠黏膜长期的慢性炎症,这 些因素均可破坏胃肠黏膜的结构和生理的完整性,从而导致H+向黏膜反流,引起组织损伤。 目前,已公认幽门螺杆菌是引起胃黏膜炎症和降低其细胞保护作用的主要因素。 幽门螺杆菌感染的治疗:自幽门螺杆菌发现至今二十余年来的经验证明,许多消化性溃 疡是此菌感染的结果,是传染病,用抗菌药治疗是可以根除的。不过目前还没有形成理想的 根治幽门螺杆菌的方案。单一抗生素虽在离体实验中对此菌敏感,但在体内应用,常因其很 快从胃中排出,不能在胃表面黏液层内达到有效浓度,故效果不佳,且很快出现耐药性,是 不可行的。现时在临床应用的多是铋制剂(胶体次枸橼酸铋和胶体次水杨酸铋)和抗生素合 用。铋剂既能在胃中与黏液结合,还有细胞保护和杀菌作用。目前国际上推崇三联疗法。此 种疗法是将铋剂与羟氨苄青霉素(amoxicillin)及灭滴灵(metronidazole)合用,效果很好, 也有人用四环素代替上述三联中的羟氨苄青霉素,对此菌的根除率接近 90%。二联疗法也 有人应用,如用奥美拉唑(omeprazole)和羟氨苄青霉素治疗,根除率可大于 80%。
胃肠激素
胃肠激素(gastrointestinal hormone)既是内分泌学创立之初最先发现的激素,也是近数 十年来研究十分活跃和取得迅猛发展的热门领域。众所周知,促胰液素(secretin)是人类 发现的第一个内分泌激素。这是由英国生理学家 Bayliss 和他的学生 Starling 于 1902 年在对 小肠局部运动反射的研究中发现的,从而冲破了当时神经主导论思想的束缚,开创了内分泌 学(endocrinology)的新领域。他们大胆设想并首先提出:除神经系统外,体内可能还存在 通过某些无管腺产生的特殊化学物质,经 血液循环到达并调节远处靶器官活动的新方式,即 体液调节(humoral regulation)。 这一历史性事件详见本章另篇和内分泌章的网络增殖服务。
迄今已发现的胃肠激素有 40 余种。主要 有促胰液素、促胃液素(gastrin)、抑胃肽(gastric inhibitory polypeptide, GIP)、缩胆囊素(cholestokinin, CCK)、胃动素(motilin)、生长抑 素(somatostatin,SST)、血管活性肠肽(vasoactive intestinal peptide,VIP)和 P 物质( substance P,SP)等。近年来还发现,胃黏膜可生成一种称为生长激素释放素(ghrekin)的多肽,它 除能促进生长激素释放外,还能增进食欲,调节能量代谢。此外,胃黏膜还能少量合成与能 量平衡和脂肪储存有关的瘦素(leptin)。 胃肠激素是科学史上一个辉煌的名字,正是由于促胰液素的发现,激素(hormone)这 个词才被创造出来。但现在看来,胃肠激素这一名词并不十分准确。随着研究的进展,人们 发现,从其分布、作用和作用方式来看,胃肠激素均已超出原来的概念范畴。因而近年来有 人提出,应对胃肠激素予以重新认识和理解:一是胃肠激素的分布极为广泛,它们不仅分布 于胃肠道,也可见于体内其它器官;胃肠激素不仅可由内分泌细胞合成,神经细胞等非内分 泌细胞也能合成;二是胃肠激素不仅可通过血液循环到达靶细胞,还可通过旁分泌、神经分 泌、外分泌和自分泌等多种方式发挥作用;三是胃肠激素不仅对消化系统的功能活动起重要 调节作用,对机体许多其他整合性的功能,如对体温调节、精神和行为等方面也有重要调节 作用。由于已发现的胃肠激素均为肽类,故有人建议用“肽”来取代“激素”之称;又由于 胃肠激素都起信使作用,调节靶细胞的功能,故有人建议将它们称为胃肠调节肽(regulatory peptide of gut)。 现已公认胃肠道不仅是个消化器官,也是体内最大最复杂的内分泌器官,在胃肠黏膜和 胰腺组织内存在数十种内分泌细胞。国际上曾先后多次对胃、肠、胰内分泌细胞的超微结构 的特点、分泌颗粒的形态、大小和所含激素的不同种类及生理功能等,进行分类和命名的讨 论。目前对内分泌细胞种类用英文字母命名,这些名称有些来自传统名称,有些来自所含肽 类激素的英文字头或缩写(表 1)。 上个世纪 60 年代,英国学者 Perase 首先提出 APUD(amine precursor uptake and decarboxylation)的概念:凡具有摄取胺前体物质,并使其脱羧而转变为胺类或肽类产物能 力的细胞,统称为 APUD 细胞。分泌胃肠激素的胃肠黏膜和胰腺内分泌细胞就属于 APUD 细胞。此后发现,神经系统内许多神经元也能合成和分泌与 APUD 细胞相同的胺类和肽类 激素,因此提出弥漫神经内分泌系统(diffuse neuroendocrine system, DNES)的概念。目前 已知,下丘脑的神经内分泌细胞、腺垂体细胞、松果体细胞、甲状腺滤泡旁细胞(即 C 细胞)、甲状旁腺主细胞、肾上腺髓质细胞、肾小球球旁细胞等都可归属于 DNES,甚至有人 将心房肌(因能合成和分泌心房钠尿肽)和血管内皮细胞(因能合成和分泌多种肽类物质) 也都列入此例。这些新概念对阐述神经和内分泌之间的统一关系,以及肽类和胺类物质在调 节机体功能活动中的作用等方面提供了重要的理论基础
胃黏液层对抗胃酸和胃蛋白酶的作用
由胃表面上皮细胞、泌酸腺中的颈黏液细胞、贲门腺和幽门腺共同分泌的黏液覆盖于 胃腔内表面,形成一层厚约 0.5mm的凝胶层,凝胶层具有较高的黏滞性和水不溶性,它与 黏膜上皮细胞分泌的HCO3−一起构成黏液-碳酸氢盐屏障(mucus-bicarbonate barrier)。 胃黏液含有糖蛋白、电解质、肽类、脂类和水,其中水约占 95%。黏液中所含的糖蛋白 多聚体互相重叠、相互穿插,形成一层连续的稳定的黏稠的不溶于水的黏液凝胶层,贴附 于胃黏膜表面。黏液层的厚度是表面上皮厚度的 10~20 倍,为胃腺厚度的 1/4~1/2,从而能 够形成稳定的非流动层,增强黏液层对胃黏膜的保护作用。另外,凝胶层呈网状结构,可 容纳大量水,截留脂类、血浆蛋白、酶和离子等。研究表明,黏液层的连续性比黏液层的 厚度更重要,只有这样,才能保证较厚的黏液层能连续性地覆盖,更有效地提供一个稳定 的非流动层来中和胃酸、抵御胃蛋白酶侵袭的环境。 在生理情况下,胃黏液凝胶层经常处于分泌和降解的动态平衡中。分泌黏液的细胞具 有强大的修复和更新能力,平均 3~5 天更新一次,损伤后可在数小时内修复,提示黏液和 黏液分泌细胞的更新在胃黏膜的保护中发挥重要作用。 胃黏膜黏液层的生理作用主要有:①机械润滑作用。这一作用使胃内食物在机械性消化 过程中,能防止各种机械性刺激对黏膜上皮细胞的磨损,保护胃黏膜的完整性。②拮抗胃蛋 白酶的活性,防止自体消化。黏液凝胶层的分子结构和其表面以共价键结合的脂肪酸链构成 一道有效的机械性屏障,可阻止胃酸、胃蛋白酶通过,避免胃黏膜受胃酸和胃蛋白酶的消化 性损伤;同时,胃黏膜上皮表面的pH呈中性或弱碱性(因HCO3−的作用),可防御H+的逆向 弥散,防止H+和消化酶渗透进入黏膜上皮,可降低胃液的酸度,维持细胞内pH和离子组分 比例的恒定,减弱胃蛋白酶的活性,从而防止自体被消化。③阻断损伤因子的损害,参与损 伤后的修复。研究表明,黏液胶质层能抵御各种损伤因子(如消炎痛、乙醇和胆酸等)损害。 在短期内,即使其下面的黏膜细胞已受损,它仍可抵御胃酸和胃蛋白酶的损害,阻止其反渗 入胃黏膜,延迟上皮层的进一步受损,并参与损伤后的修复。 碳酸氢盐主要由胃黏膜内的非泌酸细胞分泌的,仅有少量是从组织间液渗入胃内。基础 状态下,其分泌速率仅为H+分泌速率的 5%,进食时,分泌速率增加。单独的黏液或碳酸氢 盐分泌都不能有效地保护胃黏膜免受胃腔内盐酸或胃蛋白酶的损伤,但两者联合作用则可形 成一个有效抵抗胃酸和胃蛋白酶侵袭的黏液-碳酸氢盐屏障。 胃和十二指肠上皮细胞分泌HCO3−是防止胃酸分泌失控的重要保护机制之一。尽管胃腔 内胃液的pH为 2~3,但胃黏膜上皮细胞不断分泌HCO3−,并逐渐从底层向黏液层表面扩散, 于是在非流动的黏液凝胶层中便形成一个明显的pH梯度,即在黏液层上皮细胞侧pH接近中 性。胃酸分泌期间pH梯度的维持具有抵抗胃酸的胃损伤作用。在壁细胞内,HCO3−的生成 与H+的分泌同时进行,HCO3−通过壁细胞基底侧膜中的Cl−-HCO3−交换体被运出细胞。因而 认为,上皮细胞分泌HCO3−增加而中和胃酸反向弥散,这是黏液-碳酸氢盐屏障保护胃黏膜 最重要的机制;而且,胃液中的H+在通过黏液层向黏膜上皮细胞扩散的速度极慢,可被 HCO3−逐渐中和,从而减轻H+对黏膜上皮细胞的侵蚀,由于接近上皮处的pH接近中性,胃 蛋白酶的活动大大降低,因而也能有效防止胃蛋白酶对胃黏膜的消化作用。这也是胃黏膜在高酸及高蛋白酶的环境中不被消化的原因之一。此外,还存在其他保护机制。当上皮细 胞内H+和HCO3−发生中和,碳酸酐酶可将其分解为CO2,也可通过Na+-H+交换排H+而防止 细胞内pH降低;在结构上,上皮细胞顶端膜对H+的通透性较低以及细胞间的细胞旁途径渗 漏性低,也形成胃黏膜的保护机制。




