4.2 差式扫描量热分析
1、差式扫描量热分析工作原理
按照国际热分析协会(ICTA)的定义,差式扫描量热分析(Differential Scanning Calorimetry,简称DSC)是指在程序温度控制下,测量输给被测物质和参比物的能量差与温度或时间之间关系的一种技术。DSC的原理由Watson等在1964年首次提出,随后发展起来的一种热分析技术。

1)功率补偿型DSC (内加热式DSC )
装样品和参比物的支持器是各自独立的元件,如左下图所示,在样品和参比的底部各有一个加热用的铂热电阻和一个测温用的铂传感器。它是采用动态零位平衡原理,即要求样品与参比物温度,不论样品吸热还是放热时都要维持动态零位平衡状态,即ΔT→0。
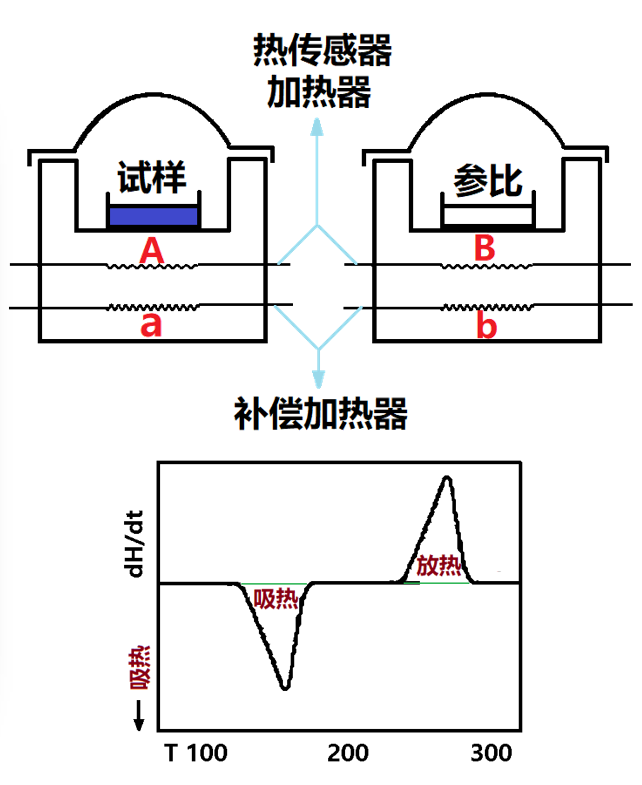
因此,当试样吸收热效应时,补偿加热器增加热量平衡,使试样和参比物之间保持相同的温度;当试样放出热量时,则减少热量。然后,将测试过程中补偿功率纪录,所补偿的功率等于试样吸收或放出的热量,也即维持样品和参比物处于相同温度所需要的能量差(Δw=dH/dt),由此可以记录热流速率对温度的关系曲线。功率补偿型DSC技术的为美国Perkin-Elmer公司独有。
2)热流型DSC(外加热式DSC )
采取外加热的方式使均温块受热,然后通过空气和康铜做的热垫片两个途径把热传递给试样杯和参比杯,试样杯的温度由镍铬丝和镍铝丝组成的高灵敏度热电偶检测,参比杯的温度由镍铬丝和康铜组成的热电偶加以检测。
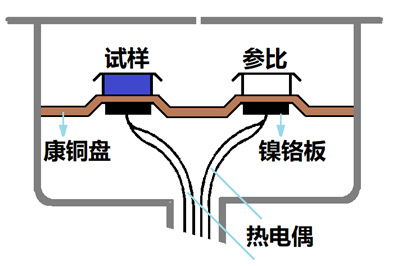
由此可知,检测的是温差ΔT,它是试样热量变化的反映。根据热学原理,温差ΔT的大小等于单位时间试样热量变化(dQs/dt)和试样的热量向外传递所受阻力R的乘积,即
ΔT=R·dQs/dt
式中R只和热传导系数与热辐射、热容等有关,且强烈依赖于实验条件和温度,因此ΔT不是一个很确定的量,它反映热量,但不一定与热量成正比。这是曾一度是热流型DSC定量性不良的症结所在。ΔT不准确的解决办法:一是采用高灵敏度的热电偶对试样和参比物的温差进行精确的测量;二是采用高导热率材料制成的圆盘把热流快速均匀地传给试样和参比物;三是对热阻进行温度校正,即所谓的多点校正法(有的仪器采用20个点),在测试的温度范围内,随温度不断升高,获得热阻只与温度的非线性函数关系,以不断修正的值作为常数,就能按照热流公式将检测的ΔT转换成能量。
2、DSC的实验技术
从操作上,DSC实验技术分为如下7方面:1)坩埚;2)系统校正;3)装样;4)气氛;5)样品量选择;6)升温速率;7)二次扫描。
1)坩埚
DSC用的坩埚种类很多,常见的有铝坩埚、Al2O3坩埚、铜坩埚、钢质坩埚、黄金坩埚、白金坩埚、镀金钢坩埚、石墨坩埚等。测试依照测试温度、压力、密封性、样品种类、测试效果等,选择不同种类的坩埚。对于聚合物测试一般采用铝坩埚。

2)系统校正
在样品测试之前,须定期对DSC仪进行基线、温度和热量的校正,以保证谱图数据的准确性。
基线校正是在所测温度范围内,当样品池和参比池都未放任何东西时,进行温度扫描,得到的谱图应当是一条直线。
如果校正曲线有曲率或斜率甚至出现小吸热或放热峰,则需要进行仪器的调整加以修正和炉子的清洗,使基线平直,否则仪器不能进行测试。
温度和能量校正通过测定标准纯物质的熔点和熔融热来实现校正。
3)气氛
一般使用惰性气体,如N2、Ar、He等,不会产生氧化反应峰,同时又可减少试样挥发物对检测器的腐蚀。气流流速必须恒定,(控制在10mL/min),否则会引起基线波动。
气体性质对测定有显著影响,要引起注意。如He气的热导率比N2、Ar气的热导率大约4倍,所以在做低温DSC用He作保护气时,冷却速度加快,测定时间缩短。在空气中测定时,要注意氧化作用的影响。有时可通过比较N2和O2中的DSC曲线,来解释某些氧化反应。

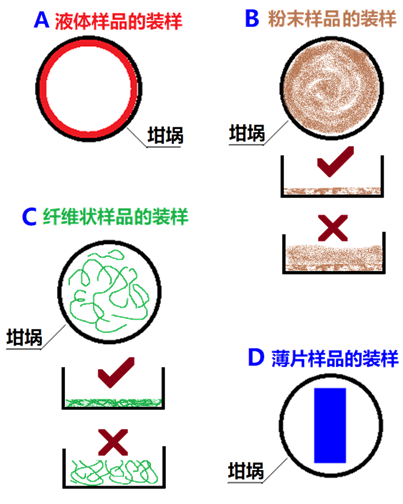
4)装样
固态、液态或粘稠状样品都可用DSC分析测试。为了获得良好的测试效果,DSC装样的原则是使样品均匀密实分布在样品皿(坩埚)内,以提高传热效率,减少样品与坩埚之间的热阻,这对于固体样品尤为重要。
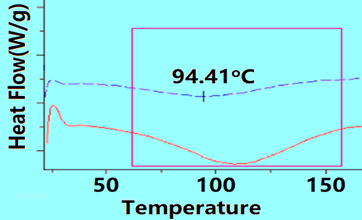
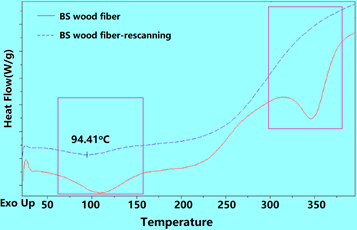
下图是蓬松木纤维进行DSC测试的结果(红实线),因为装样不密实,在105oC附近出现了假峰,对之进行二次扫描(蓝色虚线),该峰仍然出现,证明为假峰。
5)样品量选择
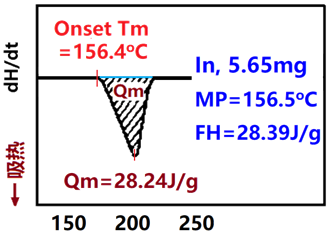
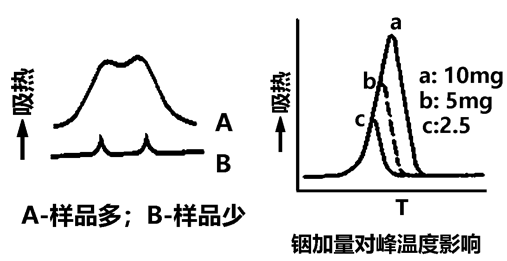
样品量少,样品的分辨率高,但灵敏度下降,一般根据样品热效应大小调节样品量,一般3—5mg,如左下图。样品量多少对所测转变温度也有影响。右下图所示是铟的量变化,随样品量增加,峰起始点温度基本不变,但峰顶温度增加,峰结束温度也提高。因此,如同类样品要相互比较其差异,最好采用相同的量。
6)升温速率的选择
通常升温速率范围在5~20oC/min。一般来说,升温速率越快,灵敏度提高,分辨率下降。灵敏度和分辨率是一对矛盾,人们一般选择较慢的升温速率以保持好的分辨率,而适当增加样品量来提高灵敏度。
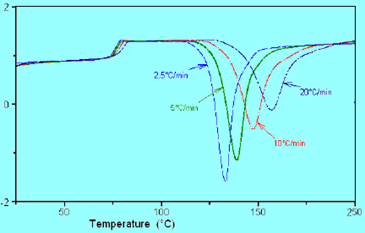
由下图可知,随升温速率的增加,熔化峰起始温度变化不大,而峰顶和峰结束温度提高,峰形变宽。由此可见,测试时若改变升温速率,就必须重新校正温度是必不可少的工作。
7)二次扫描
对于聚合物,由于微量水、残留溶剂的存在,固体形态以及复杂的历史效应影响,第一次扫描时常有干扰。消除干扰的方法之一就是重复扫描,将第一次扫描作为样品的预处理,再进行第二次扫描,以后的准确的结果。
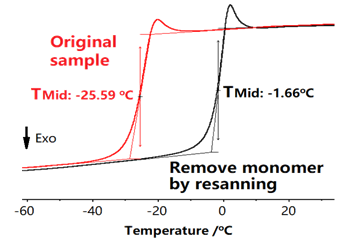
有时也采用重复扫描来判断某些DSC峰是否为可逆峰,通常物理转变峰为可逆峰,而化学转变峰为不可逆峰。对于固体粉末测试玻璃化转变温度或者对于未退火样品测试结晶温度,时常存在干扰,此时对于采用重复扫描就很有意义。
3、DSC技术的应用
下图是一张典型的DSC图,由此可见,DSC能够直接提供的信息为:1)参与热事件物质的种类与量;2)热事件的起始温度、峰值和结束温度;3)热效应的大小和方向。
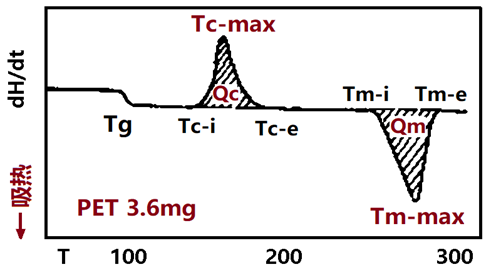
基于上述DSC能够提供的直接信息,可将DSC用于测量或表征物质的晶态转变、熔融、蒸发、脱水、升华、玻璃化转变、液晶转变、热容的变化、燃烧、聚合、固化、交联等热焓效应变化明显的物理转变与化学反应。
目前DSC技术在聚合物研究中的应用主要集中在如下几个方面:1)聚合物玻璃化转变的研究;2)聚合物熔融与结晶的研究;3)聚合物化学转变的研究;4)动力学研究。
1)聚合物玻璃化转变的研究
聚合物的玻璃化转变,在DSC曲线上表现为基线偏移,出现了一个台阶,这一台阶的出现本质上是由于聚合物在玻璃化转变前后体系比热容改变导致。
DSC的热流速率(dH/dt)与比热容c的关系如下:
dH/dt = m·c·dT/dt
式中:m指样品质量;dT/dt指升温速率。
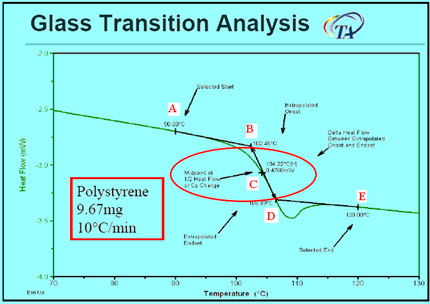
对于在DSC图上确定聚合物玻璃化转变温度Tg有如下几种方法:a.台阶曲线的切线与起始基线的交点B,也称onset点,这种表示方法最为常用;b.台阶曲线的切线与终了基线的交点D,也称endset点;c.两个切点的中点C,间称中点。
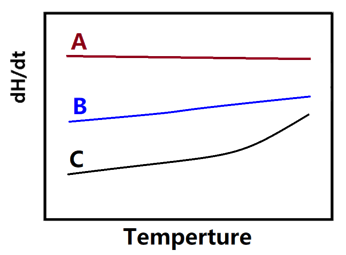
在聚合物的制备、加工或者DSC制备处理过程中,往往存在各种各样加热、冷却、保温等操作,这些热历史操作对聚合物的玻璃化转变温度有着很重要的影响,如下图所示。
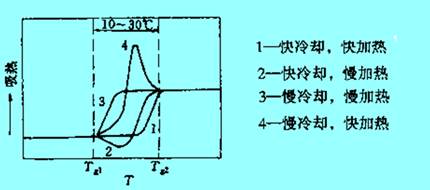
如果热历史中的冷却速率比DSC测试时的升温速率小,则表征Tg的曲线变成吸热的滞后峰(有人称之为抬头峰),如下左图中的4号曲线;反之之出现放热峰(有人称之为摆尾峰);只有冷却速率与测定速率相同或相近时,才出现标准的玻璃化转变曲线,从而表现出升温速率对DSC曲线的形状或Tg的测量有较大的影响。
2)聚合物熔融/结晶转变的研究
大多数结晶聚合物,在DSC实验中测得的熔融温度都有一较宽的范围,但它仍是热力学平衡熔融行为,只不过由于聚合物体系通常处于非平衡态,所以测得的熔点远低于其热力学平衡熔点。只有在平衡熔点下熔融的晶体是该聚合物最完善的结晶,具有最小的自由能(DG= DH-T·DS=0)。
影响聚合物的熔融和结晶转化的因素很多,例如:结晶温度、升温速率、历史效应等。作为聚合物研究方法,下面将介绍DSC测试条件对熔融和结晶转化的影响。
影响聚合物结晶的条件主要有结晶温度和升温速率。一般上,结晶温度越高,形成结晶越完善,熔点越高。如下图所示:

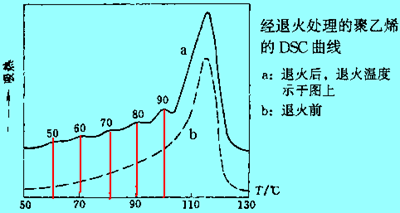
冷却速率越快,结晶越小越不完善,其熔点越低。实际上聚合物结晶总是处于各种亚稳态。高分子材料的生产或加工过程中常经过各种热处理,相当于退火,小分子结晶很易退火到平衡完善化而消除热历史,但高分子结晶很少能退火到这个程度这意味着退火是在原先热历史(可能还有应力历史,形态历史和结构历史)上叠加退火历史。这样使实际的聚合物材料的DSC曲线相当复杂。如:尼龙6在不同温度下结晶16h,从下面DSC图上可看到不同热历史,最多能观察到五个峰。有人将同一聚乙烯样品依次在不同温度下退火,每隔10℃退火1h,结果升温时出现一系列小退火熔融峰,每一退火峰熔融温度均比退火温度高10℃左右。
3)聚合物化学转变的研究
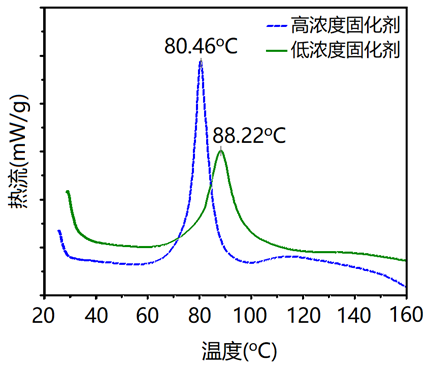
一些聚合物的氧化、分解、交联在DSC谱图上均有很明显的反映,氧化、交联反应会出现放热峰,而分解反应则出现吸热峰。如下图是用DSC研究脲醛树脂在不同固化剂用量下(蓝色5%;绿色0.9%)的固化反应结果,其固化峰值和放热量明显不同。
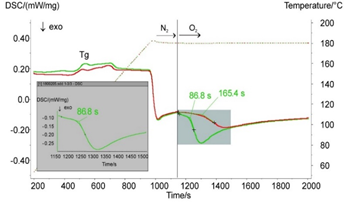
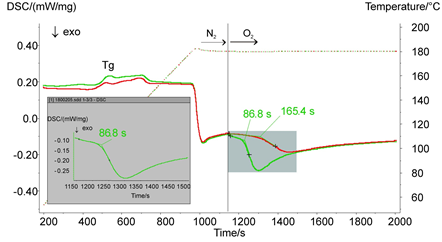
下面是关于ABS抗氧化性评价的DSC谱图,通过对测试样品改变气氛(先进行氮气测试再改用氧气),发现绿色曲线的样品在氧气气氛下存在明显的氧化反应,说明其抗氧化性不如红色曲线的样品。
4)动力学的研究应用
DSC动力学研究能用于所有有热效应的反应,尤其适用于固体–固体、液体–固体、一般方法难以测量的液体–液体之间的反应,或者是在较低温度下反应比较慢,而在较高温度下又不易于测试的情形。DSC对于聚合物的动力学研究的应用主要以变温模式(改变升温速率)的反应动力学为主,例如树脂固化反应动力学、聚合物降解反应动力学等已有很多报道。应用DSC研究反应动力学旨在求解或者获得某个反应活化能和动力学方程,测试依据方程:

式中,T为DSC峰的峰顶温度,绝对温度;β为升温速率;A为指前因子;E为活化能;R为理想气体常数,8.314。
对于Kissinger方程,通过对ln(β/T2)对1/T进行回归,就可求得反应的活化能E,进而获得指前因子A;对于Ozawa方程,通过对ln(β)对1/T回归,就可求得反应的活化能E。
现以脲醛树脂为例,研究其在某催化剂存在下固化反应动力学。首先以不同的升温速率β对树脂-催化剂体系进行DSC扫描,如下图:
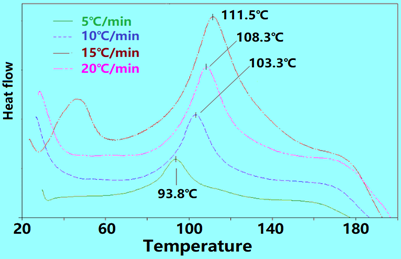
将对应的峰顶温度T和升温速率β代入方程(4),回归拟合结果如下图,由此可得到如下方程:
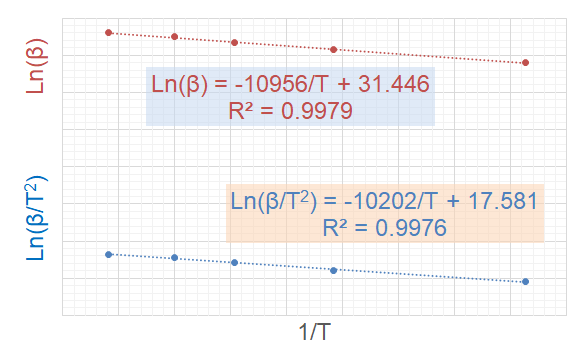
ln(β/T2)=17.581-102021/T
由此可求得活化能Ek=84.83kJ/mol,Eo=86.59kJ/mol(二者误差2%)。由此可依据Kissinger方程求得指前因子A=7.48×1010。
课外作业:见“4.5 拓展阅读与作业”,对DSC的资料进行拓展阅读。


