第七节 注射剂的质量要求及中药注射剂安全问题讨论
一、注射剂的质量要求
除另有规定外,注射剂应进行以下相应检查。
1.装量 注射液及注射用浓溶液照下述方法检查,应符合规定。
检查法 供试品标示装量不大于2mL者,取供试品5支(瓶);2mL 以上至50mL者,取供试品3支(瓶)。开启时注意避免损失,将内容物分 别用相应体积的干燥注射器及注射针头抽尽,然后缓慢连续地注入经 标化的量入式量筒内(量筒的大小应使待测体积至少占其额定体积的40%,不排尽针头中的液体),在室温下检视。测定油溶液、乳状液或 混悬液时,应先加温(如有必要)摇匀,再用干燥注射器及注射针头抽尽后,同前法操作,放冷(加温时),检视。每支(瓶)的装量均不得少于其 标示量。
标示装量为50mL以上的注射液及注射用浓溶液照《中国药典》2020年版四部通则最低装量检查法检查,应符合规定。
也可采用重量除以相对密度计算装量。准确量取供试品,精密称 定,求出每1mL供试品的重量(即供试品的相对密度精密称定用干燥注射器及注射针头抽出或直接缓慢倾出供试品内容物的重量),再除以供试品相对密度,得出相应的装量。
预装式注射器和弹筒式装置的供试品:标示装量不大于2mL者,取供试品5支(瓶);2mL以上至50mL者,取供试品3支(瓶)。供试品与 所配注射器、针头或活塞装配后将供试品缓慢连续注入容器(不排尽针头中的液体),按单剂量供试品要求进行装量检查,应不低于标示量。
2.装量差异 除另有规定外,注射用无菌粉末照下述方法检查, 应符合规定。
检查法 取供试品5瓶(支),除去标签、铝盖,容器外壁用乙醇擦净,干燥,开启时注意避免玻璃屑等异物落入容器中,分别迅速精密称定;容器为玻璃瓶的注射用无菌粉末,首先小心开启内塞,使容器内外气压平衡,盖紧后精密称定。然后倾出内容物,容器用水或乙醇洗净,在适宜条件下干燥后,再分别精密称定每一容器的重量,求出每瓶(支)的装量与平均装量。每瓶(支)装量与平均装量相比较(如有标示 装量,则与标示装量相比较),应符合下列规定,如有1瓶(支)不符合规 定,应另取10瓶(支)复试,应符合规定。

凡规定检查含量均匀度的注射用无菌粉末,一般不再进行装量差 异检查。
3.渗透压摩尔浓度 生物膜,例如人体的细胞膜或毛细血管壁,一般具有半透膜的性质,溶剂通过半透膜由低浓度向高浓度溶液扩散的现象称为渗透,阻止渗透所需要施加的压力,称为渗透压。在涉及溶质的扩散或通过生物膜的液体转运各种生物过程中,渗透压都起着 极其重要的作用。在制备注射剂、眼用液体制剂等药物制剂时,必须关注其渗透压。处方中添加了渗透压调节剂的制剂,均应控制其渗透压摩尔浓度。
静脉输液、营养液、电解质或渗透利尿药(如甘露醇注射液)等制剂,应在药品说明书上标明其渗透压摩尔浓度,以便临床医生根据实际需要对所用制剂进行适当的处置(如稀释)。正常人体血液的渗透压摩尔浓度范围为285~310mOsmol/kg,0.9 % 氯化钠溶液或5%葡萄糖溶 液的渗透压摩尔浓度与人体血液相当。
渗透压摩尔浓度的单位,通常以每千克溶剂中溶质的毫渗透压摩尔来表示,可按下列公式计算毫渗透压摩尔浓度(mOsmol/kg):
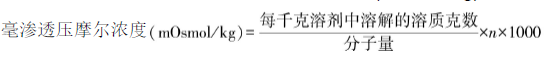
除另有规定外,静脉输液及椎管注射用注射液按各品种项下的规定,照《中国药典》2020年版四部通则渗透压摩尔浓度测定法测定, 应符合规定。
4.可见异物 系指存在于注射剂、眼用液体制剂和无菌原料药中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50μm。
注射剂、眼用液体制剂应在符合药品生产质量管理规范(GMP) 的条件下生产,产品在出厂前应采用适宜的方法逐一检查并同时剔除不合格产品。临用前,需在自然光下目视检查(避免阳光直射),如有可见异物,不得使用。
除另有规定外,照《中国药典》2020年版四部通则可见异物检查 法检查,应符合规定。
5.不溶性微粒 系用以检查静脉用注射剂(溶液型注射液、注射用 无菌粉末、注射用浓溶液)及供静脉注射用无菌原料药中不溶性微粒的大小及数量。
除另有规定外,用于静脉注射、静脉滴注、鞘内注射、椎管内注射的溶液型的注射液、注射用无菌粉末及注射用浓溶液照《中国药 典》2020年版四部通则不溶性微粒检查法检查,均应符合规定。
6.中药注射剂有关物质 系指中药材经提取、纯化制成注射剂后,残留在注射剂中可能含有并需要控制的物质。
除另有规定外,一般应检查蛋白质、鞣质、树脂等,静脉注射液 还应检查草酸盐、钾离子等。按各品种项下规定,照《中国药典》 2020年版四部通则注射剂有关物质检查法检查,应符合有关规定。
7.重金属及有害元素残留量 除另有规定外,中药注射剂照《中 国药典》2020年版四部通则铅、镉、砷、汞、铜测定法测定,按各品 种项下每日最大使用量计算,铅不得超过12μg,镉不得超过3μg,砷 不得超过6μg,汞不得超过2μg,铜不得超过150μg。
8.无菌 照《中国药典》2020年版四部通则无菌检查法检查,应符合规定。
9.细菌内毒素或热原 除另有规定外,静脉用注射剂按各品种项下的规定,照《中国药典》2020年版四部通则细菌内毒素检查法或热 原检查法检查,应符合规定。
《中国药典》2020年版四部通则注射剂安全性检查法应用指导原则要求:静脉用注射剂,均应设细菌内毒素(或热原)检查。其中,化学 药品注射剂一般首选细菌内毒素检查;中药注射剂一般首选热原检查项,若该药本身对家兔的药理作用或毒性反应影响热原检测结果,可 选择细菌内毒素检查。临床用药剂量较大,生产工艺易污染细菌内毒 素的肌肉注射用注射剂,应考虑设细菌内毒素检查。
10.注射剂安全性检查 注射剂安全性检查包括异常毒性、细菌内毒素(或热原)、过敏反应、溶血与凝聚、降压物质(包括组胺类物质)等 检查。
《中国药典》2020年版四部制剂通则要求,必要时注射剂应进行相应的安全性检查,均应符合要求。
《中国药典》2020年版四部通则注射剂安全性检查法应用指导原则要求:根据处方、工艺、用法及用量等设定相应的检查项目并进行 适用性研究。其中,细菌内毒素检查与热原检查项目间、降压物质检 查与组胺类物质检查项目间,可以根据适用性研究结果相互替代,选择两者之一作为检查项目。
(1)异常毒性检查 系将一定量的供试品溶液注入小鼠体内,规定 时间内观察小鼠出现的死亡情况,以判定供试品是否符合规定。
静脉用注射剂及肌肉注射用注射剂所用原料系动植物来源或微生物发酵液提取物,组分结构不清晰或有可能污染毒性杂质且又缺乏有 效的理化分析方法的静脉用注射剂,应考虑设立异常毒性检查。
(2)降压物质检查 系通过静脉注射限值剂量供试品,观察对麻醉 猫的血压反应,以判定供试品中所含降压物质的限值是否符合规定。供试品的不合格表明药品中含有限值以上的影响血压反应的物质,临 床用药时可能引起急性降压不良反应。
(3)组胺类物质检查 系将一定浓度的供试品和组胺对照品依次注 入离体豚鼠回肠浴槽内,分别观察出现的收缩反应幅度并加以比较, 以判定供试品是否符合规定的一种方法。不合格供试品表明含有组胺 和类组胺物质,在临床上可能引起血压下降和类过敏反应等严重的不 良反应。
静脉用注射剂所用原料系动植物来源或微生物发酵液提取物时,组分结构不清晰或有可能污染组胺、类组胺样降血压物质的静脉用注 射剂,特别是中药注射剂,如缺乏相关的理化分析方法且临床发现类 过敏反应,应考虑设立降压物质或组胺类物质检查项。检查项目一般首选降压物质检查项,但若降血压药理作用与该药具有的功能主治有 关,或对猫的反应干扰血压检测,可选择组胺类物质检查项替代。
所用原料系动植物来源或微生物发酵液提取物时,组分结构不清晰或有可能污染异源蛋白或未知过敏反应物质的肌肉注射用注射剂, 如缺乏相关理化分析方法且临床发现过敏反应,应考虑设立过敏反应 检查项。
(4)过敏反应检查 系将一定量的供试品皮下或腹腔注射入豚鼠体 内致敏,间隔一定时间后静脉注射供试品进行激发,观察豚鼠出现过 敏反应的情况,以此判定供试品是否符合规定。供试品不合格表明注 射剂含有过敏反应物质,临床用药时可能使患者致敏或产生过敏反应,引起严重不良反应。
静脉用注射剂所用原料系动植物来源或微生物发酵液提取物时,组分结构不清晰且有可能污染异源蛋白或未知过敏反应物质的静脉用 注射剂,如缺乏相关的理化分析方法且临床发现过敏反应,应考虑设 立过敏反应检查项。
(5)溶血与凝聚检查 系将一定量供试品与2%兔红细胞混悬液混 合,温育一定时间后,观察其对红细胞的溶血与凝聚反应以判定供试品是否符合规定。
中药注射剂应考虑设溶血与凝聚检查项。
(6)其他检查 椎管内、腹腔、眼内等特殊途径的注射剂,其安全 性检查项目一般应符合静脉用注射剂的要求,必要时应增加其他安全 性检查项目,如刺激性检查、细胞毒性检查。注射剂用辅料使用面 广,用量大,来源复杂,与药品的安全性直接相关。在质量控制中,应根据辅料的来源、性质、用途、用法用量,配合理化分析方法,设 立必要的安全性检查项目。原料和生产工艺特殊的注射剂必要时应增加特殊的安全性检查项目,如病毒检查、细胞毒性检查等。
11.主药含量 《中药、天然药物注射剂基本技术要求》规定:有效成分制成的注射剂,主药成分含量应不少于90%。多成分制成的注 射剂,所测成分应大于总固体量的80%。注射剂中含有多种结构类型 成分的,应分别采用HPLC和/或GC等定量方法测定各主要结构类型成分中至少一种代表性成分的含量。此外,应对未测定的其他成分进行 研究。处方中含有毒性成分或已上市单一成分药品的,应测定其含量。注射剂质量标准中含测指标均应规定其含量的上下限。
12.中药材指纹图谱 系指中药材经适当处理后,采用一定的分析 手段,得到的能够标示该中药材特性的共有峰的图谱。如原药材需经 过特殊炮制(如醋制、酒制、炒炭等),则应制定原药材和炮制品指纹图 谱的检测标准。
为加强中药注射剂质量管理,国家药品监督管理局在2000年8月制 定了《中药注射剂指纹图谱研究的技术要求(暂行)》,以确保中药注射 剂的质量稳定、可控,中药注射剂在固定中药材品种、产地和采收期的前提下,需制定中药材、有效部位或中间体、注射剂的指纹图谱。 指纹图谱的建立是根据10批次以上供试品的检测结果所给出的相关参数,制定指纹图谱。
再有《中药、天然药物注射剂基本技术要求》要求:原料(药材、饮片、提取物、有效部位等)、中间体、注射剂成品均应分别研究建立 指纹图谱。还应进行标定原料、中间体、注射剂成品各指纹图谱之间 的相关性研究。指纹图谱的研究应全面反映注射剂所含成分的信息, 必要时应建立多张指纹图谱。经质量研究明确结构的成分,应当在指 纹图谱中得到体现,一般不低于已明确成分的90%,对于不能体现的 成分应有充分合理的理由。指纹图谱的评价可采用相对峰面积、相对 保留时间、非共有峰面积或者相似度等指标进行评价。同时,也可根据产品特点增加特征峰比例等指标及指纹特征描述,并规定非共有峰 数及相对峰面积。指纹图谱的评价还可选用对照提取物对照的方法。
二、中药注射剂安全问题讨论
中药注射剂是以中医药理论为指导,采用现代的科学技术和方法,从中药或中药复方中提取的有效物质制成的注射剂,是我国继承 和发展中医药文化的特色创新。1977年版《中国药典》收载了23种中药注射剂,但1985年版《中国药典》删除了所有的中药注射剂,1995年又开始收载,但仅有止喘灵注射液一个品种。2005年版增加了灯盏细辛注射液和清开灵注射液,目前2020年版《中国药典》一部收载4种:止喘灵注射液、灯盏细辛注射液、注射用双黄连、清开灵注射液。
随着中药注射剂种类的增加和临床应用的不断扩大,不良反应也有逐渐增多的趋势。2004年国家食品药品监督管理局下发了关于葛根 素引起急性血管内溶血的通知,2006年7月国家食品药品监督管理局通 知暂停鱼腥草等7个中药注射液的临床使用。2008年卫生部出台了《关 于进一步加强中药注射剂生产和临床使用管理的通知》,2007年国家 食品药品监督管理局制定了《中药、天然药物注射剂基本技术要求》,2009年下发了《关于开展中药注射剂安全性再评价工作的通 知》、2010年下发了《中药注射剂指纹图谱研究的技术要求(暂行)》 等文件,以监督中药注射剂的安全应用。
中药注射剂不良反应主要表现为:①过敏反应:表现为突发的心慌、胸闷、呼吸困难、喉头水肿。皮肤过敏反应均表现为皮疹及皮肤 瘙痒。②发热:以中度及高热为主,伴有或不伴有寒战。③消化道反应:主要表现为恶心、呕吐、腹痛、腹泻、黄疸、转氨酶升高等。④血液系统损害:表现为出血、溶血性贫血、白细胞减少、血小板减少、过敏性紫瘫等。⑤心血管系统损害:以心律失常多见,亦见有心绞痛、心肌损伤、血压骤升或骤降等。⑥中枢神经系统反应:以头 痛、头晕、眩晕、兴奋、烦躁等为主。⑦运动系统反应:包括腰背剧痛、肌肉震颤、关节肿胀疼痛等。⑧其他:急性肾衰竭、急性肺水肿、静脉炎等。
(一)中药注射剂的生产质量问题
1.药材来源 药材是生产中药注射剂的源头,如果药材出现问 题,将很难保证中间体和最终产品的质量,进而对产品的安全性产生 影响。不同来源的同一药材质量差别较大,有效成分及杂质的含量也不同,不但影响中药注射剂的质量控制,同时可能产生不可预知的不 良反应。如丹参存在种子种苗不断退化的情况,使不同产地的丹参药材质量存在很大差异,如不同地区的丹参中含丹参酮ⅡA的含量差别较大,有的相差达16倍。
因此,针对药材来源不稳定可能导致中药注射剂产品质量不稳定的情况,建议采用《中药材生产质量管理规范》(GAP),固定药材的基 原、药用部位、产地、采收期、产地加工、贮存条件等,建立相对稳 定的药材基地,并加强药材生产全过程的质量控制,尽可能采用规范 化种植的药材。同时,通过指纹图谱特征性的相关鉴定,有效鉴别药材的真伪优劣,控制最初药材的品质。
2.制备工艺 制备工艺研究是中药注射剂安全性、有效性研究的基础,通过对产品有效成分、有效物质及其有害成分等的研究,才能 客观、准确地判断中药注射剂的安全与否。在提取工艺上,许多中药 注射剂只是将原药材经过简单的提取工艺制备而成。在注射剂生产过 程中为提高有效成分的溶解度、稳定性而加入助溶剂、稳定剂等添加 剂,也是引发中药注射剂安全性问题的因素之一。
因此,为提高中药注射剂的安全性,应采用新技术、新设备完善中药注射剂的制备工艺,如超声提取法、超滤、渗滤等设备,保证产 品质量的均一稳定。配料时直接加入的辅料应符合注射用要求,其质 量标准中一般应包含热原(细菌内毒素)检查、无菌检查、有关物质检查 等检查项目。注射剂用辅料无药用标准的,应研究建立符合注射用要 求的质量标准。并根据GMP要求进行生产,严格执行工艺规程,以减少外来异物污染制剂的机会。
3.质量标准 质量标准是药品不可或缺的重要指标,由于中药的 化学成分极其复杂,加上原料药材、生产工艺存在许多不稳定因素, 为制定严格的质量标准带来很大困难。目前中药注射剂基本上还是采 用指标成分或个别有效成分作为质量控制标准,不能完整对中药注射剂中其他成分进行质量控制。而中药注射剂所含的成分复杂,标准要求过低,难以保证中药注射剂的质量,容易导致不良反应的发生。
针对中药注射剂的特点开展相应的质量研究,加强产品的风险分析、评估与控制,建立全面、系统的质量研究与风险控制网络,从而 保证中药注射剂的质量均一、稳定、安全、有效。如《中国药典》 2020年版一部对清开灵注射液增加了指纹图谱的测定。
(二)中药注射剂的配伍使用问题
中药注射剂加入输液中静脉滴注或与其他药物配伍现象在临床日益增多,注射剂联合用药可减少注射的次数,还可增加药物的协同作 用。但是中药注射液由于成分复杂,在与其他药物联合应用时,可能 发生配伍变化,使不良反应的发生率增高。中药注射剂联合用药发生 配伍禁忌呈混浊、沉淀、变色,或产生气泡等现象,主要原因为混合 后pH值发生改变,使有效成分溶解度降低而析出,增加了微粒的数量,而微粒进入血管后引起微血管阻塞造成局部栓塞性出血、血肿、损伤和坏死,导致肺部肉芽肿及栓塞,引起不良反应的增加。《中国 药典》2020年版一部明确规定清开灵注射液以10%葡萄糖注射液200mL或氯化钠注射液100mL稀释后使用,如经10%葡萄糖或氯化钠注射液稀释后,出现沉淀、浑浊亦不得使用;并且已确认清开注射液 不能与硫酸庆大霉素、青霉素G钾、肾上腺素、阿拉明、乳糖酸红霉素、多巴胺、山梗菜碱、硫酸美芬丁胺等药物配伍使用。
另外,超出药品适应证用药,用药剂量过大,疗程过长,滴注速 度过快等临床使用不恰当会造成中药注射剂安全问题。
总之,中药注射剂安全性问题涉及诸多方面,是个复杂的系统工 程,需要引起我们的高度重视。中药注射剂采用现代化提取工艺、高 科技控制手段从药材、辅料、中间体到终产品,建立一整套生产及质 量控制体系,完善中药注射剂质量标准,来评价最终产品的安全性与 有效性。并且在临床使用中应采用合理配液方法,控制滴注速度,加 强用药观察,以确保中药注射剂的安全、有效、合理用药。


