血清白蛋白的分离纯化与鉴定

紫外吸收法原理
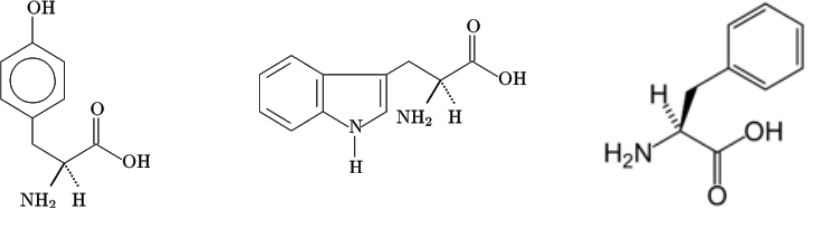
由于蛋白质中的酪氨酸、色氨酸及苯丙氨酸残基含有共轭双键,对紫外光有吸收作用,其吸收高峰在280nm波长处,且在此波长内蛋白质的吸光度值A280nm与其浓度(范围是0.1~1.0mg/ml)成正比关系,280nm的吸光度故可作为蛋白质定量测定的依据。
1.制作标准曲线
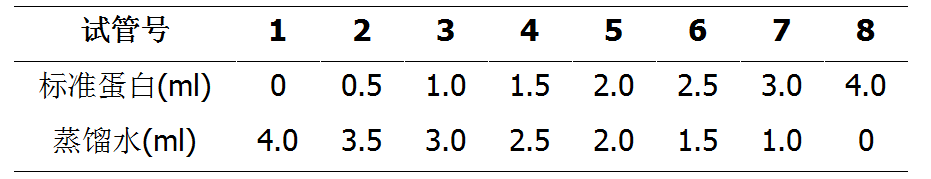
以蛋白质浓度为横坐标,吸光度值为纵坐标,绘出标准曲线。
2.样品测定
取纯化后的白蛋白溶液,测定其在280nm处的吸光度值,并从标准曲线上查出白蛋白的浓度。
若测得的白蛋白浓度过高,可按适当的比例稀释之后重新进行测定。测完之后的样品回收到原试管中保存。
SDS-PAGE原理
单体丙烯酰胺和交联剂亚甲基双丙烯酰胺在加速剂和催化剂的作用下,聚合交联成三维网状的凝胶,并以此凝胶为支持物的电泳方法。

SDS-PAGE操作方法
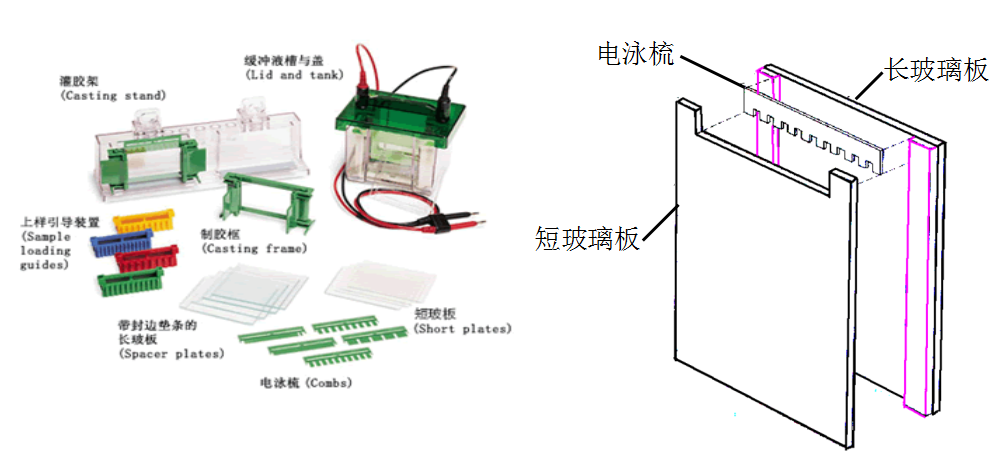
制板:将长短不等的两块玻璃板洗净晾干后安装好。
制备分离胶:按照表1配制12%的分离胶。混匀后用移液枪抽取凝胶液加至长、短玻璃板间的窄缝内,留出梳齿的齿高加1cm的空间停止灌胶,并小心覆盖一层蒸馏水或正丁醇,约30min聚合完成。待分离胶聚合完全后,除去覆盖的蒸馏水或正丁醇,用吸水纸尽可能的吸干残液。
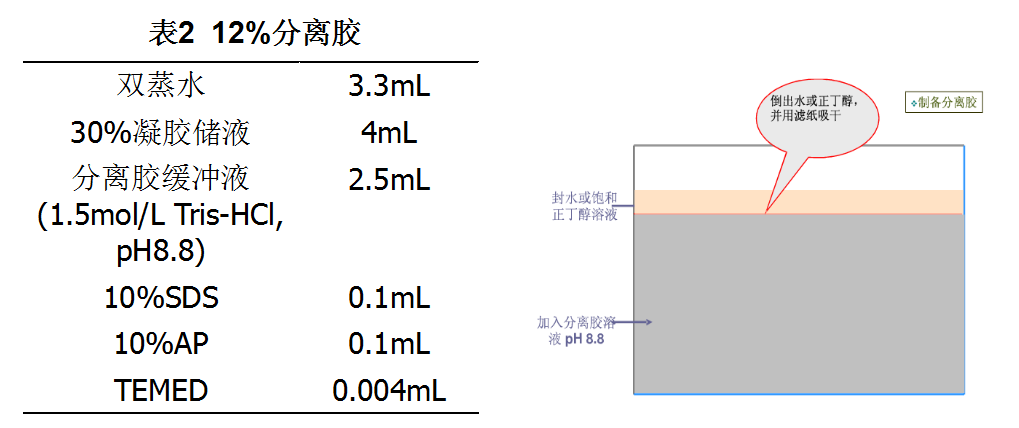
制备浓缩胶:按照表2配制5%的浓缩胶。配完后立即用移液枪将浓缩胶加在分离胶上,灌满后小心地插入合适的电泳梳,避免出现气泡,聚合约30 min。
电泳槽安装:
注意电极方向,短玻璃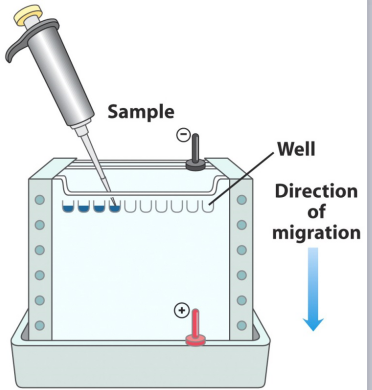 板位于阴极一侧,长玻璃板位于阳极一侧。
板位于阴极一侧,长玻璃板位于阳极一侧。
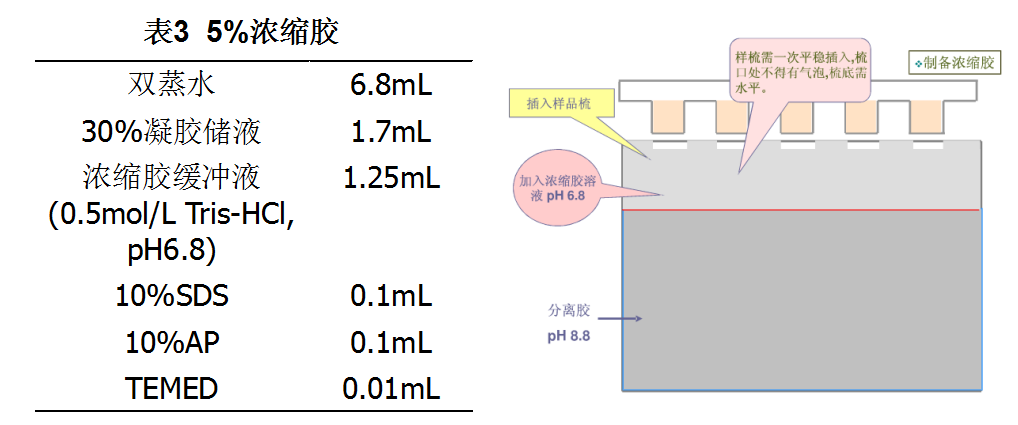
加样:室温下聚合30min后小心拔出电泳梳,用双蒸水涮洗样品孔,去除未聚合的丙烯酰胺。用移液枪将处理好的蛋白marker、血清样品和白蛋白样品轻轻加到凝胶凹形样品槽底部。
电泳:在电泳槽两侧加电泳缓冲液,电泳液面要高于样品孔,接好电极进行电泳。开始电压为80V,当示踪染料进入浓缩胶成一条极细的水平线后,将电压增加到120V,继续电泳直至染料距分离胶底部约0.5-1cm时停止电泳。
染色:电泳结束后取出凝胶,在第一点样侧的凝胶上切去一角以标注凝胶的方位,用染色液浸泡凝胶,放在摇床上室温染色10-20min。
脱色:加入脱色液反复脱色,直至背景清晰透明,将脱色后的凝胶照相或干燥,也可用塑料袋密封在20%甘油水溶液中长期保存。
根据白蛋白样品条带情况与血清样品条带情况的比较,分析纯化效果;根据目标条带所在的位置与蛋白marker标准分子量的位置对比,可以粗略估计目标条带分子量的大小。
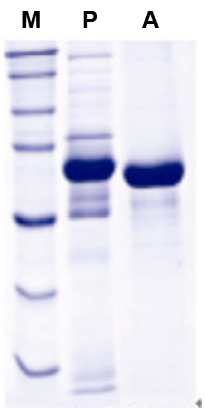
M:蛋白Marker;P:血清;
A:血清白蛋白


