肌红蛋白与血红蛋白
上一节
下一节
一、肌红蛋白(myoglobin)
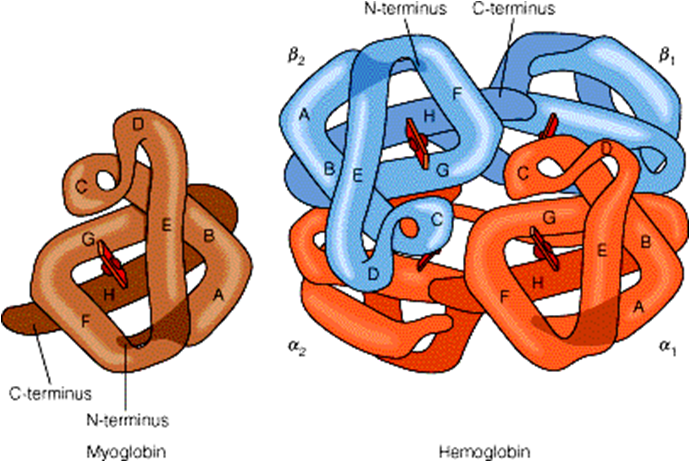
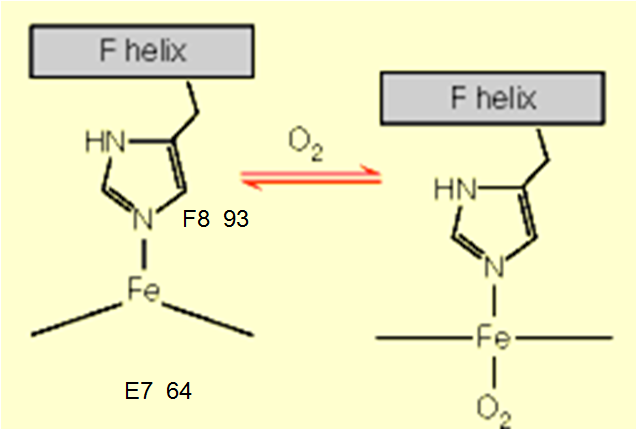
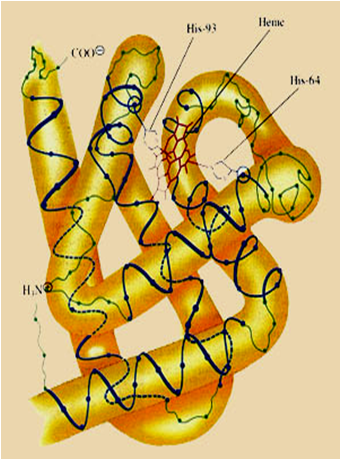 肌红蛋白是第一个被确定的具有三级结构的蛋白质,主要生物学功能是结合氧,是哺乳动物肌肉中储氧的蛋白质。肌红蛋白由一条多肽链组成,呈扁平的棱形,含有一个血红素辅基,有8段-螺旋,血红素居于分子内部的空穴中,其上的丙氨酸与蛋白质的碱性氨基酸形成盐键,Fe与F8上的组氨酸形成配位键。
肌红蛋白是第一个被确定的具有三级结构的蛋白质,主要生物学功能是结合氧,是哺乳动物肌肉中储氧的蛋白质。肌红蛋白由一条多肽链组成,呈扁平的棱形,含有一个血红素辅基,有8段-螺旋,血红素居于分子内部的空穴中,其上的丙氨酸与蛋白质的碱性氨基酸形成盐键,Fe与F8上的组氨酸形成配位键。
二、血红蛋白(hemoglobin)
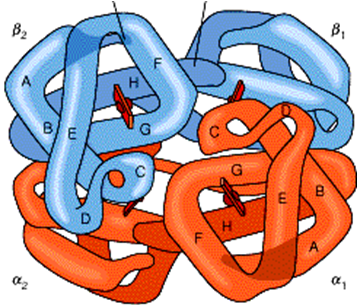 血红蛋白是脊椎动物红细胞主要组成部分,它的主要功能是运输氧和二氧化碳,维持血液pH值的稳定等作用。血红蛋白是由四个亚基构成的四级结构,呈四面体结构,每个亚基的三级结构与肌红蛋白极为相似。成人α2β2;胎儿α2γ2;早期胚胎 α2ε2。四个亚基之间被8对盐键所稳定。
血红蛋白是脊椎动物红细胞主要组成部分,它的主要功能是运输氧和二氧化碳,维持血液pH值的稳定等作用。血红蛋白是由四个亚基构成的四级结构,呈四面体结构,每个亚基的三级结构与肌红蛋白极为相似。成人α2β2;胎儿α2γ2;早期胚胎 α2ε2。四个亚基之间被8对盐键所稳定。
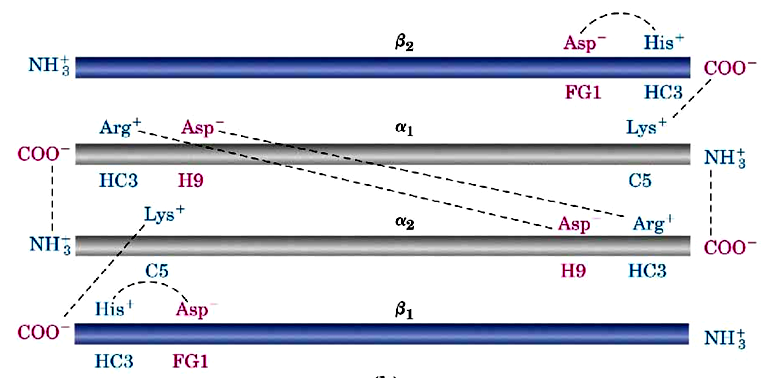
三、别构效应
1.别构效应:由于小分子(O2)与大分子(Hb)亚基结合,导致蛋白质分子构象改变及功能变化的现象称为别构效应。

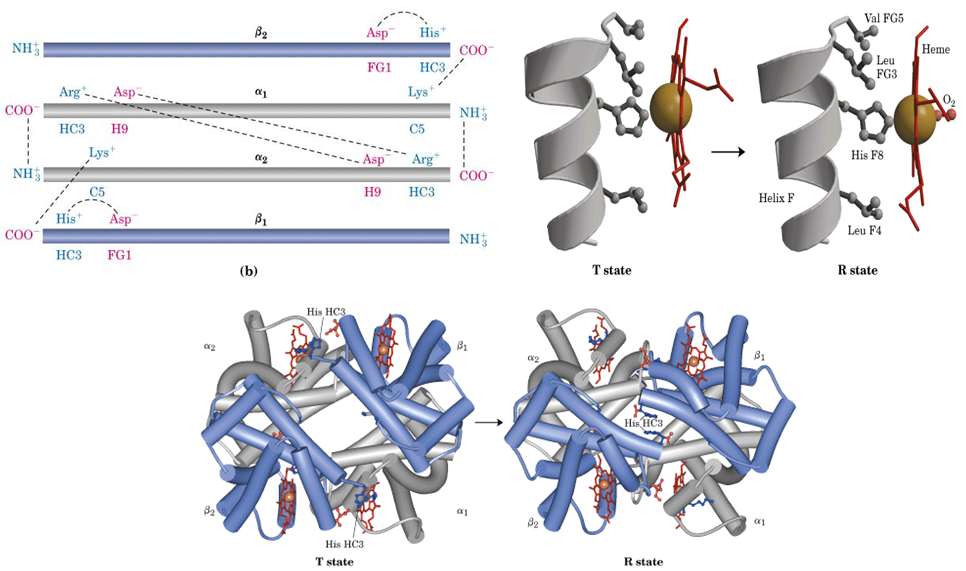
氧合可以引发维系血红蛋白4个亚基的8对离子键相继断开,从比较紧凑的T构象转变为比较松弛的R构象。
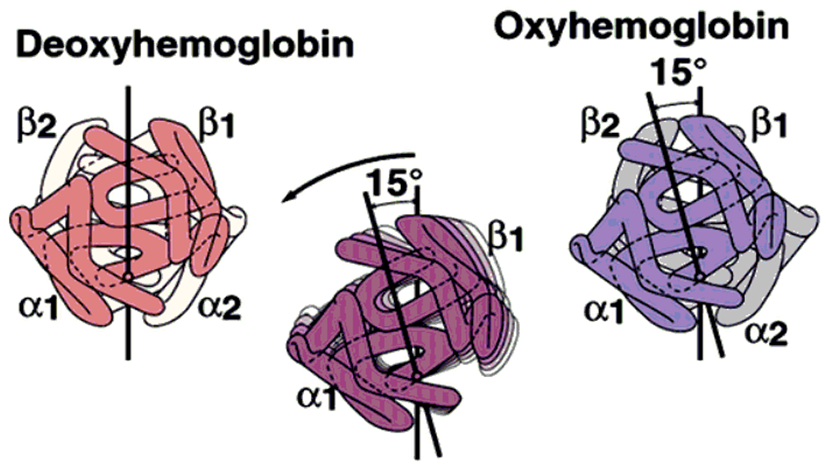
2.协同效应:一个亚基与其配体(O2)结合后,可影响寡聚体中另一亚基与配体的结合能力的现象称为协同效应。
小分子物质,称为别构效应剂。
起促进作用的,为正协同效应,称为别构激活剂;
起抑制作用的,为负协同效应,称为别构抑制剂。
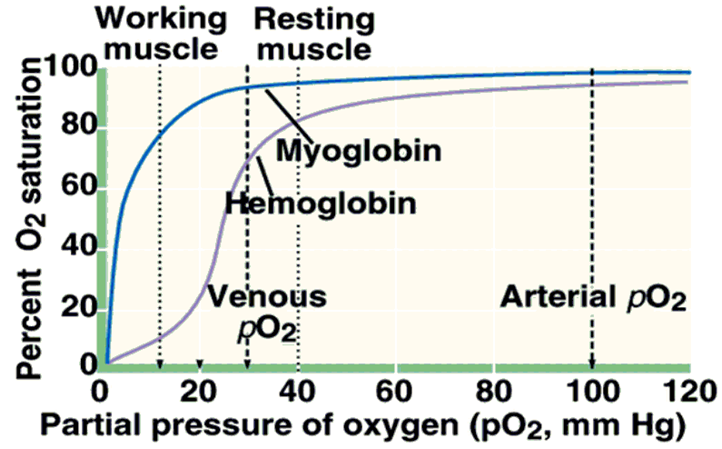
3.血红蛋白与氧的解离曲线为“S”形