一、蛋白质的性质
(一)蛋白质的两性电离与等电点
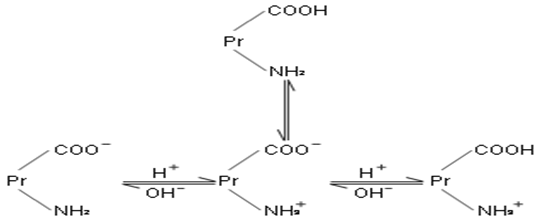
蛋白质的等电点( isoelectric point, pI):蛋白质在一定的pH溶液中其分子所带正负电荷相等,成为两性离子,在电场中即不向阳极移动也不向阴极移动,此时溶液的pH值即为该蛋白质的等电点(pI)。在等电点时,蛋白质的溶解度最小,在电场中不移动。
几种蛋白质的等电点
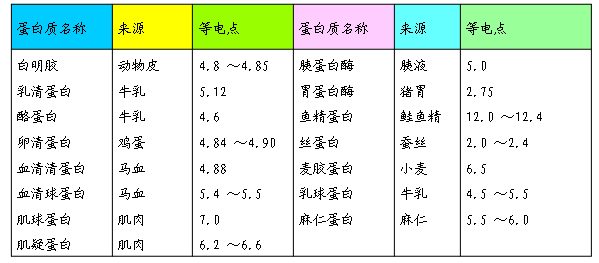
人和动物体内的大多数蛋白质的等电点在 5.0 左右,而体液的 pH 值约为 7.4 ,所以体内的蛋白质大多以阴离子形式存在,可与 K+ 、 Ca2+ 等离子结合成盐。
(二)蛋白质的紫外线吸收性质
 由于绝大多数蛋白质含有三种芳香族氨基酸,所以蛋白质具有紫外吸收的性质,最大吸收峰为280nm。
由于绝大多数蛋白质含有三种芳香族氨基酸,所以蛋白质具有紫外吸收的性质,最大吸收峰为280nm。
(三)蛋白质的胶体性质
 蛋白质属于生物大分子之一,分子量可自1万至100万之巨,其分子的直径可达1~100nm,为胶粒范围之内。
蛋白质属于生物大分子之一,分子量可自1万至100万之巨,其分子的直径可达1~100nm,为胶粒范围之内。
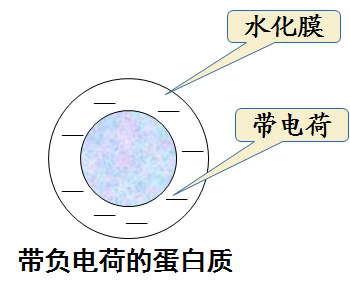
* 蛋白质胶体稳定的因素:
颗粒表面电荷
水化膜
蛋白质胶体性质的应用
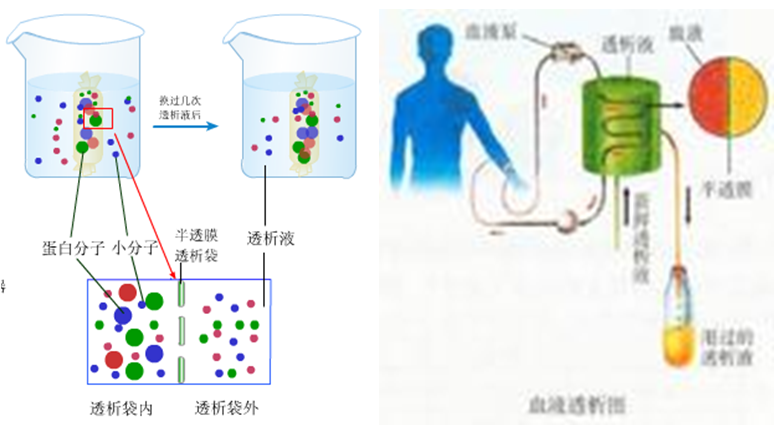
由于胶体溶液中的蛋白质不能通过半透膜,因此可以应用透析法将非蛋白的小分子杂质除去。
透析法:以半透膜提纯蛋白质的方法叫透析法
半透膜:只允许溶剂小分子通过,而溶质大分子不能通过,如羊皮纸、火棉胶、玻璃纸等。
(四)蛋白质的沉淀
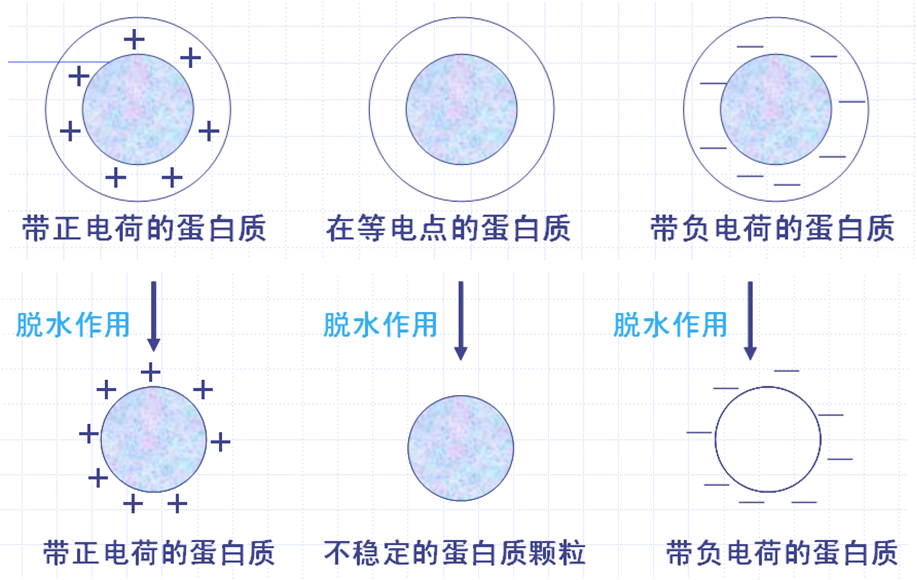
蛋白质在溶液中的稳定性是有条件的、相对的。如果加入适当的试剂使蛋白质分子处于等电点状态或失去水化层(消除相同电荷,除去水膜),蛋白质胶体溶液就不再稳定并将产生沉淀。
定义:蛋白质在溶液中靠水膜和电荷保持其稳定性,水膜和电荷一旦除去,蛋白质溶液的稳定性就被破坏,蛋白质就会从溶液中沉淀下来,此现象即为蛋白质的沉淀作用。
1.可逆沉淀
定义:在温和条件下,通过改变溶液的pH或电荷状况,使蛋白质从胶体溶液中沉淀分离。
在沉淀过程中,结构和性质都没有发生变化,在适当的条件下,可以重新溶解形成溶液,所以这种沉淀又称为非变性沉淀。
可逆沉淀是分离和纯化蛋白质的基本方法,如等电点沉淀法、盐析法和有机溶剂沉淀法等。
(1)盐析
在蛋白质的水溶液中,加入大量高浓度的强电解质盐如硫酸铵、氯化钠、硫酸钠等,可破坏蛋质分子表面的水化层,中和它们的电荷,因而使蛋白质沉淀析出,这种现象称为盐析。
而低浓度的盐溶液加入蛋白质溶液中,会导致蛋白质的溶解度增加,该现象称为盐溶。
机理:破坏蛋白质的水化膜,中和表面的净电荷。
各种蛋白质的亲水性及荷电性均有差别,因此不同蛋白质所需中性盐浓度也有不同,只要调节中性盐浓度,就可使混合蛋白质溶液中的几种蛋白质分散沉淀析出,这种方法称为分段盐析。
(2)弱酸或弱碱沉淀法(等电点沉淀)
用弱酸或弱碱调节蛋白质溶液的pH处于等电点处,使蛋白质沉淀。
弱酸或弱碱沉淀法机理:破坏蛋白质表面净电荷。
溶液中蛋白质的聚沉
(3)有机溶剂沉淀法
在蛋白质溶液中,加入能与水互溶的有机溶剂如乙醇、丙酮等,蛋白质产生沉淀。
有机溶剂沉淀法的机理:
破坏蛋白质的水化膜。
注意:有机溶液沉淀蛋白质通常在低温条件下进行,否则有机溶剂与水互溶产生的溶解热会使蛋白质产生变性。
2、不可逆沉淀
定义:在强烈沉淀条件下,不仅破坏了蛋白质胶体溶液的稳定性,而且也破坏了蛋白质的结构和性质,产生的蛋白质沉淀不可能再重新溶解于水。
由于沉淀过程发生了蛋白质的结构和性质的变化,所以又称为变性沉淀。
如加热沉淀(次级键)、强酸碱沉淀(影响电荷)、重金属盐沉淀(、
、
、
)和生物碱试剂或某些酸类沉淀等都属于不可逆沉淀。
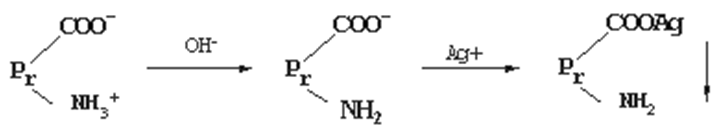
(4)重金属盐沉淀(条件:pH 稍大于pI为宜)
当pH 稍大于pI时,蛋白质颗粒带负电荷这样就容易与重金属离子结合成不溶性盐而沉淀。
重金属沉淀法的机理:
重金属盐加入之后,与带负电的羧基结合。
(5)生物碱试剂沉淀法(条件:pH稍小于pI)
生物碱是植物组织中具有显著生理作用的一类含氮的碱性物质。
能够沉淀生物碱的试剂称为生物碱试剂。生物碱试剂一般为弱酸性物质,如单宁酸、苦味酸、三氯乙酸等。
生物碱试剂沉淀蛋白质的机理:
在酸性条件下,蛋白质带正电,可以与生物碱试剂的酸根离子结合而产生沉淀。例如:“柿石症”(鞣酸使蛋白质凝固,在柿皮中含量高)
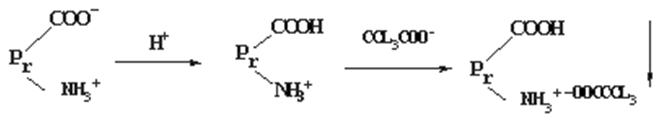
(6)加热变性沉淀法
几乎所有的蛋白质都因加热变性而凝固。少量盐促进蛋白质加热凝固。
当蛋白质处于等电点时,加热凝固最完全和最迅速。
如:煮鸡蛋

(五)蛋白质的变性与复性
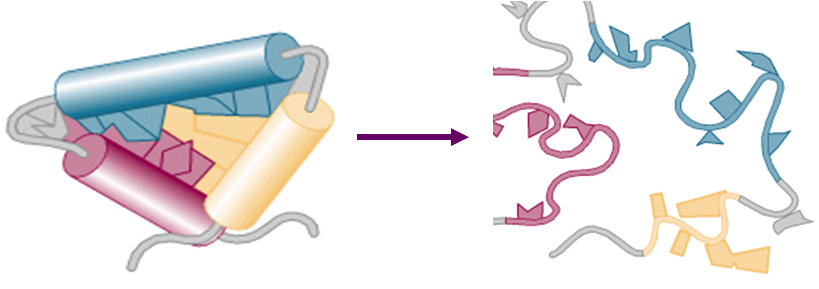
1.蛋白质的变性定义
天然蛋白质因受物理、化学因素的影响,使蛋白质分子的构象发生了异常变化,从而导致生物活性的丧失以及物理、化学性质的异常变化。但一级结构未遭破坏,这种现象称为蛋白质的变性。
2.引起蛋白质变性的主要因素
(1)物理因素:
加热、高压、紫外线照射、X-射线、超声波、剧烈振荡和搅拌等
(2)化学因素:
强酸、强碱、脲、去污剂(十二烷基硫酸钠(SDS))、重金属盐、三氯醋酸、浓乙醇等。
3.蛋白质变性的本质
分子中各种次级键断裂(非共价键和二硫键) ,使其空间构象从紧密有序的状态变成松散无序的状态,一级结构不破坏。
变性后的蛋白质在结构上虽有改变,但组成成分和相对分子质量不变。
4.蛋白质的变性的特征
生物活性丧失;物理性质改变:溶解度降低;易结絮、凝固沉淀;失去结晶能力;粘度增加;紫外光谱改变;易被酶水解。组分和分子量不变。
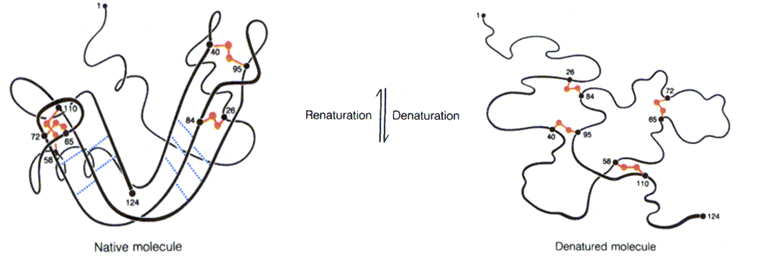
5.蛋白质的复性
定义:如果引起变性的因素比较温和,蛋白质构象仅仅是有些松散时,当除去变性因素后,可根据热力学原理缓慢地重新自发折叠恢复原来的构象,这种现象称作复性。
核糖核酸酶变性与复性作用
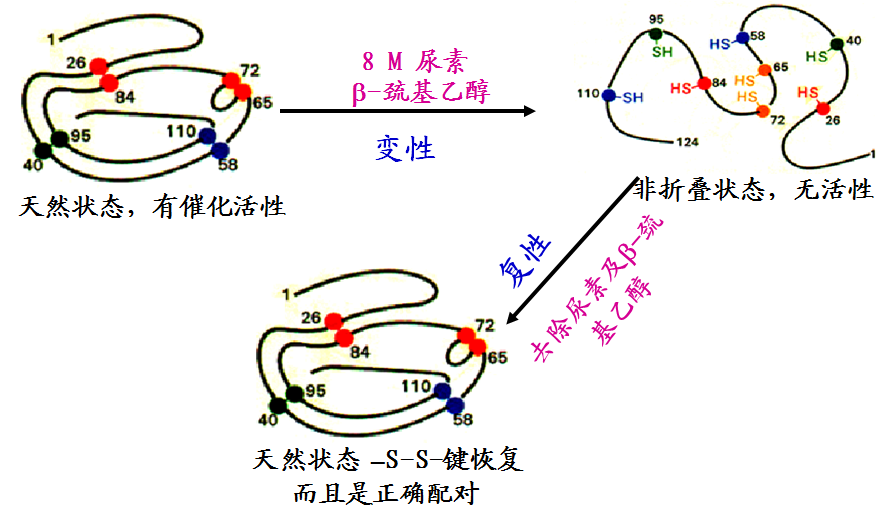
6.应用
①利用变性:酒精消毒、高压灭菌、变性制食品(豆腐:加热+盐卤MgCl2,豆腐脑、老豆腐、嫩豆腐)、加热变性使熟食易消化、抗衰老(种子和有机体蛋白质缓慢变性,亲水性相应减弱)。
②防止变性:低温保存生物制品(酶、疫苗等)。
③取代变性:解毒剂(生牛奶、豆浆、生鸡蛋清与重金属生成不溶性盐,用于急救重金属、
中毒)。
我国生物化学的开拓者——吴宪教授
 蛋白质研究领域内国际上最具有权威性的综述性丛书《Advances in Protein Chemistry》第47卷(1995年)发表了美国哈佛大学教授、蛋白质研究的老前辈J. T. Eddsall的文章“吴宪与第一个蛋白质变性理论(1931)Hsien Wu and the first Theory of Protein Denaturation(1931)”,对吴宪教授的学术成就给予了极高的评价。该卷在1995年还重新刊登了吴宪教授六十四年前关于蛋白质变性的论文。
蛋白质研究领域内国际上最具有权威性的综述性丛书《Advances in Protein Chemistry》第47卷(1995年)发表了美国哈佛大学教授、蛋白质研究的老前辈J. T. Eddsall的文章“吴宪与第一个蛋白质变性理论(1931)Hsien Wu and the first Theory of Protein Denaturation(1931)”,对吴宪教授的学术成就给予了极高的评价。该卷在1995年还重新刊登了吴宪教授六十四年前关于蛋白质变性的论文。
一篇在1931年发表的论文居然在1995年仍然值得在第一流的丛书上重新全文刊登,不能不说是国际科学界的一件极为罕见的大事。
蛋白质的变性就是从卷曲变到伸展的过程。
(六)蛋白质的呈色反应
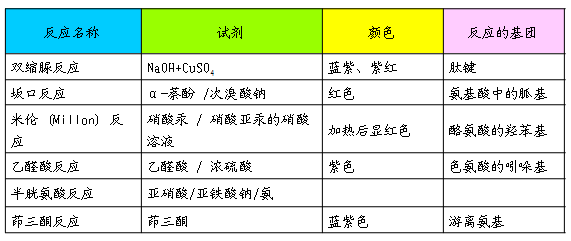
⒈茚三酮反应(ninhydrin reaction)
蛋白质经水解后产生的氨基酸也可发生茚三酮反应。
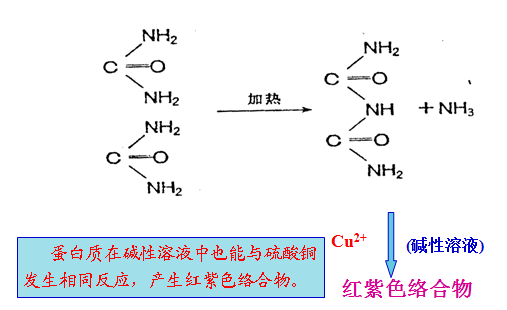
⒉双缩脲反应(biuret reaction)
含有两个或两个以上肽键的化合物都能发生此反应。蛋白质和多肽分子中肽键在稀碱溶液中与硫酸铜共热,呈现紫色或红色,此反应称为双缩脲反应,双缩脲反应可用来检测蛋白质水解程度。
双缩脲反应
蛋白质的颜色反应
二、蛋白质的分离提纯
一. 分离纯化蛋白质的意义
1.研究蛋白质的结构与功能:
要求纯度高,不变性;
2.提取活性的酶或蛋白质:
必须保持天然活性状态;
3.作为药物或食品添加剂:
纯度要求一般。
二、蛋白质提纯的总目标:
增加制品纯度或比活力,设法除去变性的蛋白质和其他杂蛋白,且希望所得的蛋白质的产量达到最高值。


1.根据分子量大小不同的分离纯化方法
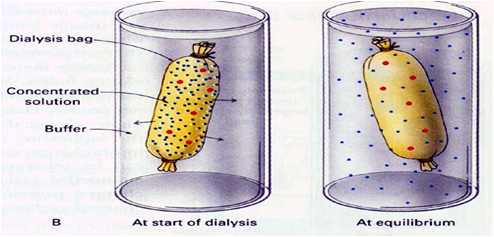 (1)透析:利用半透膜把大小分子分开的方法。
(1)透析:利用半透膜把大小分子分开的方法。
操作
蛋白质溶液置半透膜袋中,置流动溶剂(如蒸馏水)中,使小分子杂质(如无机盐、单糖、双糖、AA、小肽等透出)蛋白质留于袋中而得到分离。
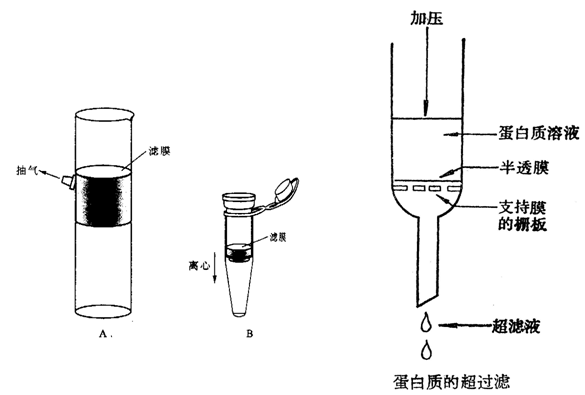
(2)超滤:超滤是利用压力或离心力使小分子溶质通过半透膜而蛋白质被截留在膜上而分离。
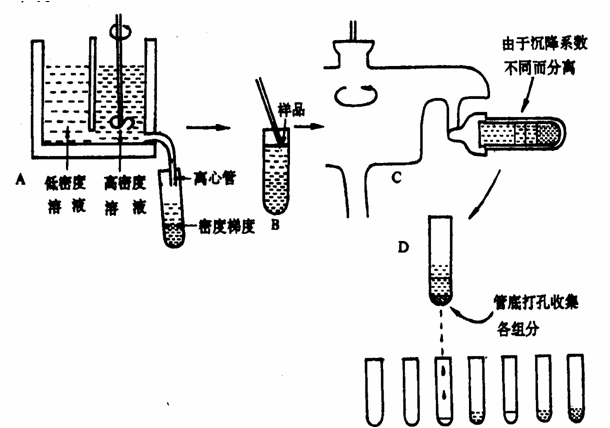
(3)密度梯度离心:蛋白质颗粒在具有密度梯度的介质中离心时,质量和密度大的颗粒比质量和密度小的颗粒沉降得快,且每种蛋白质颗粒沉降到与其自身密度相等的介质密度梯度时,即停止不前,最后各种蛋白质在离心管中被分离成不同的区带。
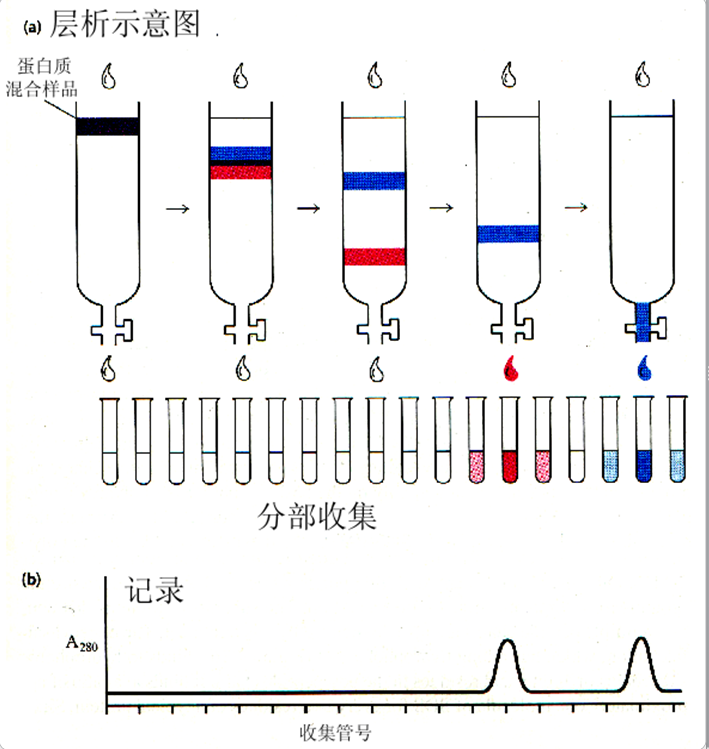
2. 层析
层析也称之色谱,基本原理是分析样品作为流动相流过固相时,由于样品中的各个成分与固相相互作用不同使得样品中的各个成分通过固相的速率产生了差别,从而达到分离样品中各个成分的目的。
层析因固相介质不同又分为凝胶层析、离子交换层析、吸附层析、亲和层析等各种层析。
Ø将作为固相成分的不溶性基质,例如葡聚糖凝胶、纤维素、树脂等填充到柱子中,用平衡液平衡。
Ø 然后加样品,再用适当的溶剂洗脱。
Ø 样品中各种成分通过柱子取决于与固相成分的相互作用,最后以不同速率被洗脱出来,达到将各个成分分离的目的。
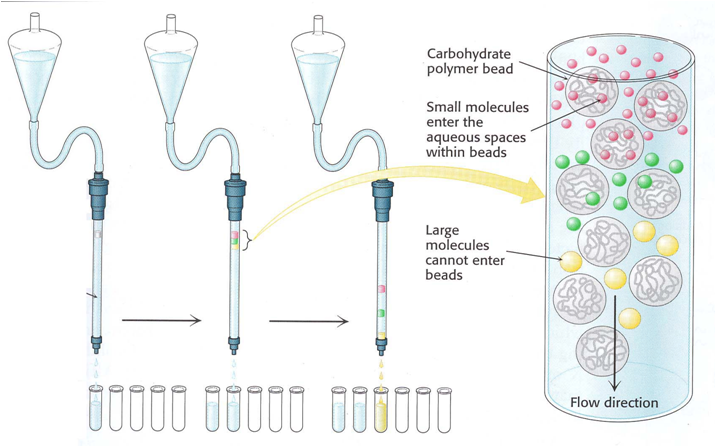
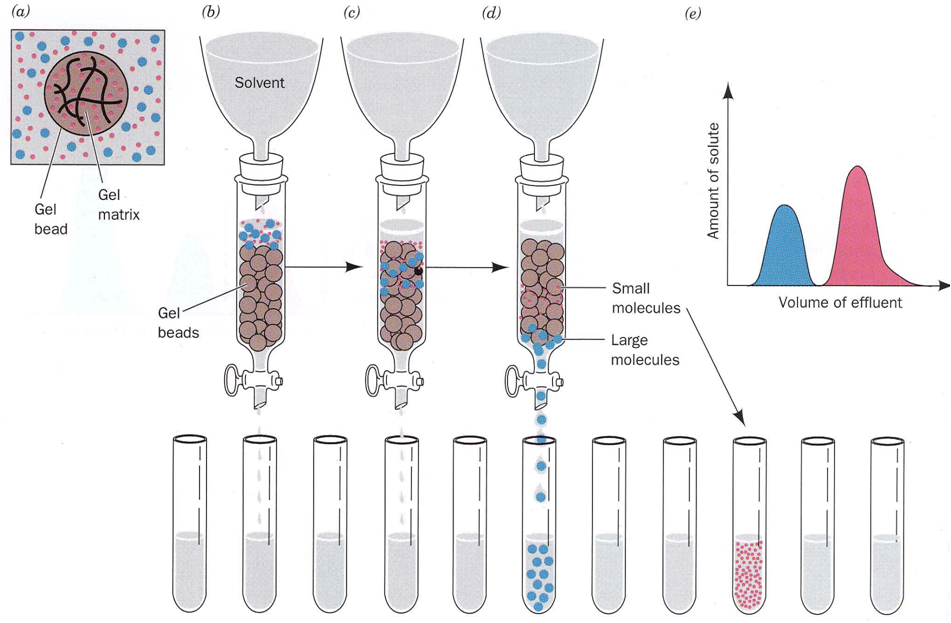
(1)凝胶过滤层析
层析也称之色谱,基本原理是分析样品作为流动相流过固定相时,由于样品中的各个成分与固定相相互作用不同使得样品中的各个成分通过固定相的速率产生了差别,从而达到分离样品中各个成分的目的。
层析因固定相介质不同又分为离子交换层析、分子筛层析和吸附层析等各种层析。
① 凝胶过滤层析的定义
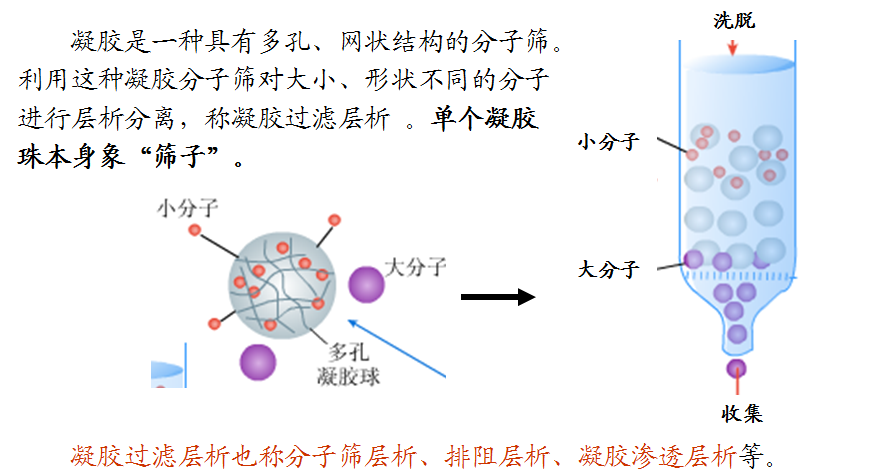
② 凝胶过滤层析原理
(2)凝胶层析的应用范围:
凝胶层析法适用于分离和提纯蛋白质、酶、多肽、激素、多糖、核酸类等物质。分子大小彼此相差25%的样品,只要通过单一凝胶床就可以完全将它们分开。利用凝胶的分子筛特性,可对这些物质的溶液进行脱盐、浓缩、去热源和脱色。
(3)凝胶层析的优点
凝胶层析具有设备简单、操作方便、分离迅速及不影响分子生物学活性等优点。目前已被广泛应用于各种生化产品的分离和纯化。
(4)凝胶层析的特点
1.凝胶层析操作简便,所需设备简单。有时只要有一根层析柱便可进行工作。分离介质—凝胶完全不需要像离子交换剂那样复杂的再生过程便可重复使用
2.分离效果较好,重复性高。
3.分离条件缓和。凝胶骨架亲水,分离过程又不涉及化学键的变化,所以对分离物的活性没有不良影响。
4.应用广泛。适用于各种生化物质,如肽类、激素、蛋白质、多糖、核酸的分离纯化、脱盐、浓缩以及分析测定等。分离的分子量范围也很宽,如Sephadex G类为102~105d;Sepharose类为105~108d。
5.分辨率不高,分离操作较慢。由于凝胶层析是以物质分子量的不同作为分离依据的,分子量的差异仅表现在流速的差异上,所以分离时流速必须严格把握。因而分离操作一般较慢。而且对于分子量相差不多的物质难以达到很好的分离。此外,凝胶层析要求样品粘度不宜太高。凝胶颗粒有时还有非特异吸附现象 。
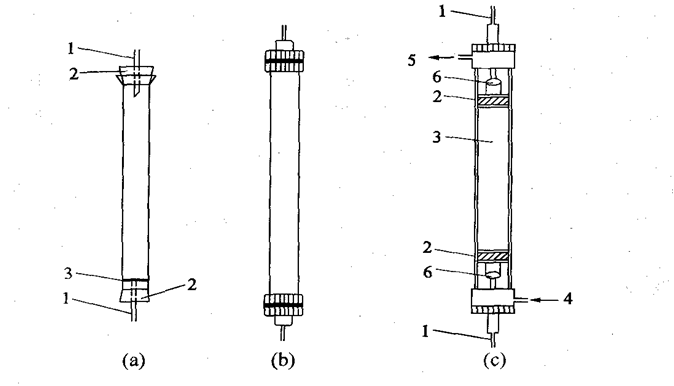
层析柱
(a)自制简易层祈柱(1.玻璃管;2.橡皮塞;3.尼龙网);(b)普通商品柱;(c)双底板层析柱(1.洗脱液进出口;2.多孔底板;3.柱床;4.恒温水进口;5.恒温水出口;6.可调节的塞子)
2.根据蛋白质的溶解度分离
(1)等电点沉淀
(2)盐析(salt precipitation):是将硫酸铵、硫酸钠或氯化钠等加入蛋白质溶液,使蛋白质表面电荷被中和以及水化膜被破坏,导致蛋白质沉淀。
(3)低温有机溶剂沉淀:使用丙酮沉淀时,必须在0~4℃低温下进行,丙酮用量一般10倍于蛋白质溶液体积。蛋白质被丙酮沉淀后,应立即分离。除了丙酮以外,也可用乙醇沉淀。
3.根据电离性质不同的分离纯化方法
(1)电泳
在外液pH低于等电点的溶液中,蛋白质粒子带正电荷,在电场中向负极移动;在外液pH高于等电点的溶液中,蛋白质粒子带负电荷,在电场中向正极移动。这种现象称为蛋白质电泳—带电粒子在电场中移动的现象。
①电泳原理示意图
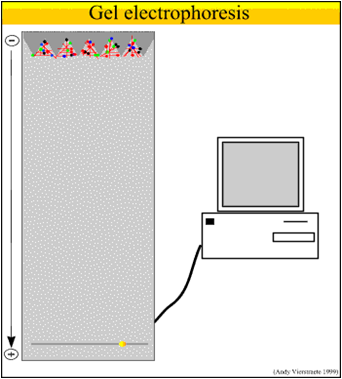
②电泳影响因素
电荷种类及数量、分子大小及形状、溶液离子强度及pH等
③几种重要的蛋白质电泳
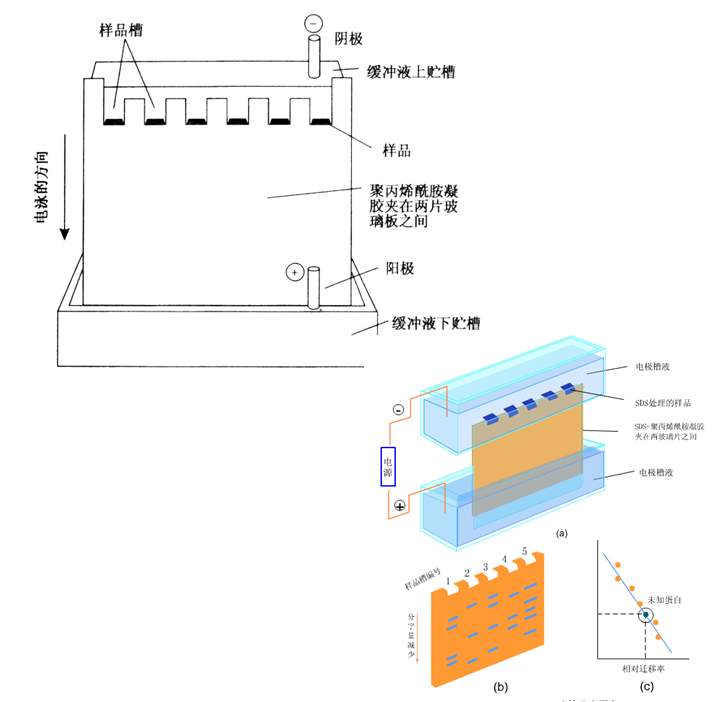
※聚丙烯酰胺凝胶电泳法
& 聚丙烯酰胺凝胶电泳(PAGE)是利用聚丙烯酰胺凝胶作为支持物的电泳法,聚丙烯酰胺凝胶是由单体丙稀酰胺和交联剂甲叉双丙稀酰胺交联而成的多孔网状凝胶。
& 不连续PAGE有分离胶、浓缩胶和样品胶。
& PAGE分辨率很高。
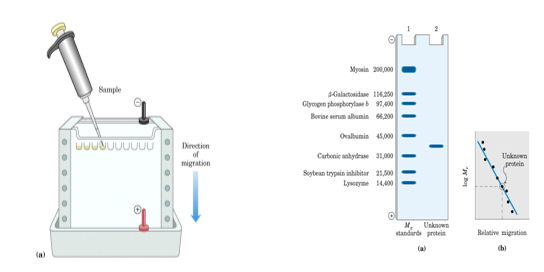
※ SDS—聚丙烯酰胺凝胶电泳法
& SDS(十二烷基磺酸钠)是一种阴离子型表面活性剂,它能够与蛋白质多肽链中的氨基酸残基按大约1 1.4比例结合。
& 每一个蛋白质分子都因为结合了许多的SDS而带有大量的负电荷,而蛋白质分子原有的电荷则可以忽略。该法主要利用了蛋白质分子量大小不同而分离蛋白质。
& 用已知分子量的蛋白质作为标准,则可以估算出不同蛋白质的分子量。
几种常用的电泳
纸电泳
醋酸纤维薄膜电泳
聚丙烯酰胺凝胶电泳(PAGE)
(可分为圆盘电泳和垂直平板电泳)
琼脂糖凝胶电泳
SDS-聚丙烯酰胺凝胶电泳
等电聚焦(IEF)
双向电泳
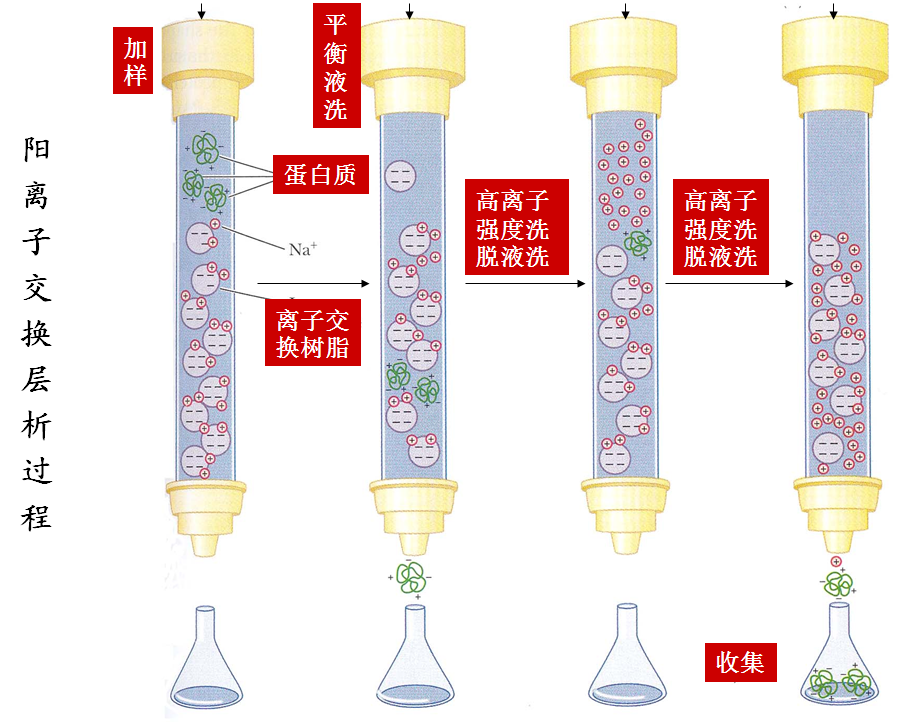
(2)离子交换层析
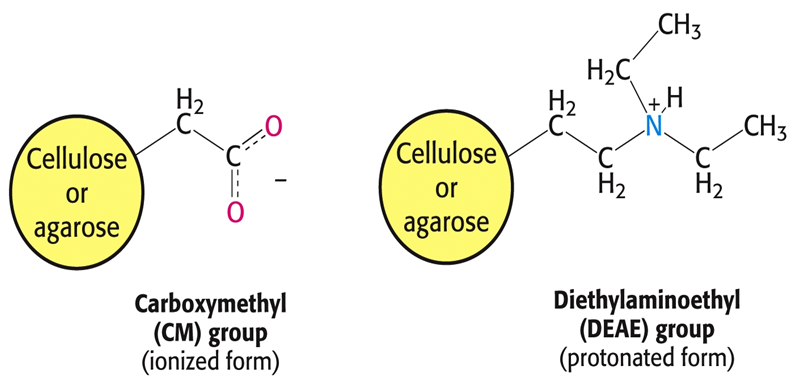
①此法是利用离子交换树脂作为柱层析支持物,将带有不同电荷的蛋白质进行分离的方法。
②离子交换树脂可以分为阳离子交换纤维素,如羧甲基纤维素(CM纤维素)等,阴离子交换纤维素,如二乙基氨基乙基纤维素(DEAE纤维素)等。
③带正电荷多的蛋白质与纤维素结合较强,而带正电荷少的蛋白质与纤维素结合则较弱。用不同浓度的阳离子洗脱液,如NaCl溶液进行梯度洗脱,通过Na+的离子交换作用,可以将带有不同正电荷的蛋白质进行分离。
离子交换层析的固相是离子交换体,包括离子交换树脂、离子交换纤维素、离子交换葡聚糖。
阳离子交换基;
阴离子交换基。
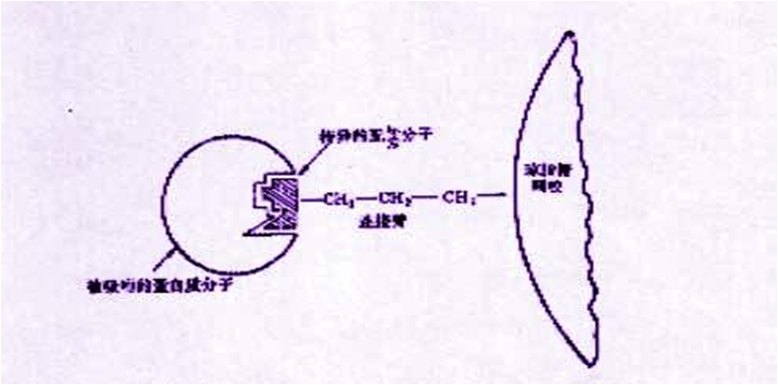
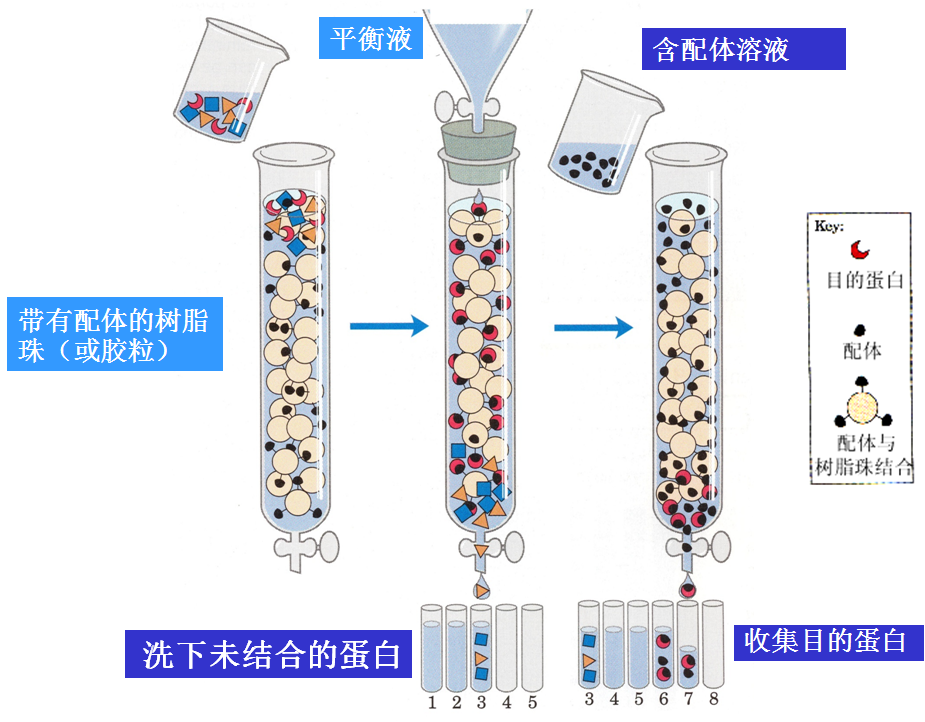
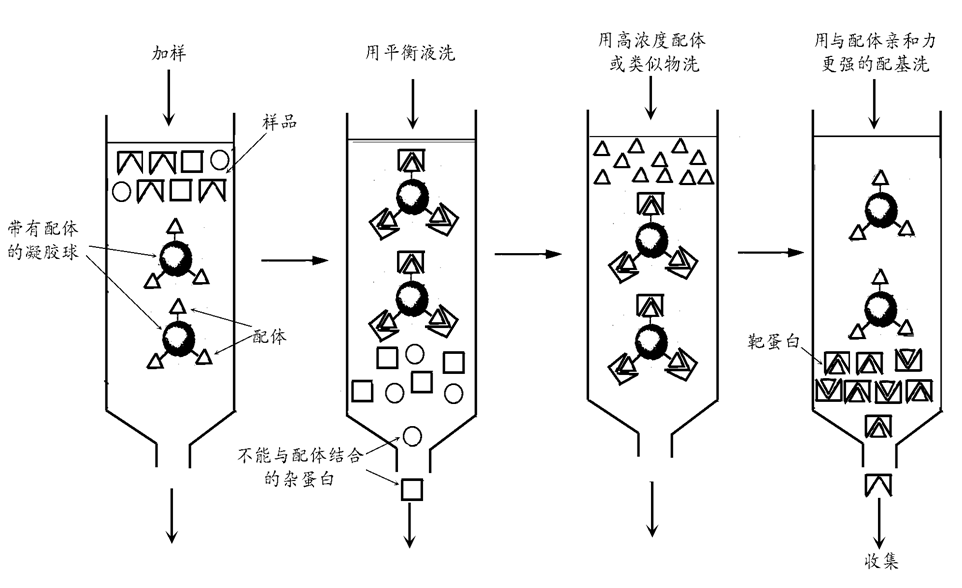
3、根据配体的亲和性不同的分离纯化方法——亲和层析
依赖于蛋白质和它的配体(ligand)之间的相互作用来分离的。配体通常指的是能与另一个分子或原子结合(一般是非共价结合)的分子、基团、离子、或原子。但在亲和层析中,配体是通过共价键先与基质结合,配体可以是酶结合的一个反应物或产物,或是一种可以识别靶蛋白的抗体。
当蛋白质混合物通过装有连接了配体的基质的亲和层析柱时,只有靶蛋白可以特异地与基质结合,而其它没有结合的蛋白质首先被洗脱下来。特异结合在基质上的靶蛋白最后可以用含有高浓度自由配体的溶剂洗下。所以有时只用亲和层析就可使蛋白质的纯化提高1000至10000倍。
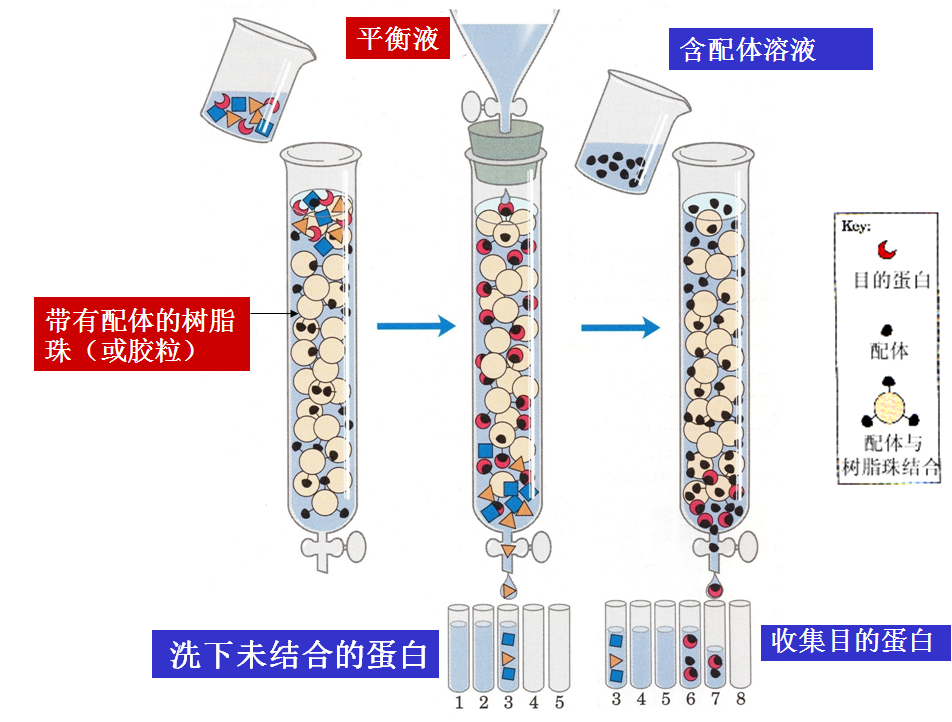
常用的配基有抗体、抗原、激素或受体蛋白、酶的底物和抑制剂等。层析柱载体为琼脂糖凝胶等。
三、蛋白质的鉴定
 1. 纯度鉴定
1. 纯度鉴定
(1)电泳法
(2)化学法
(3)仪器法
2. 分子量测定
(1)根据化学组成测定最低分子量
(2)利用凝胶过滤法测定分子量
公式:-
= a-b logM
logM = -
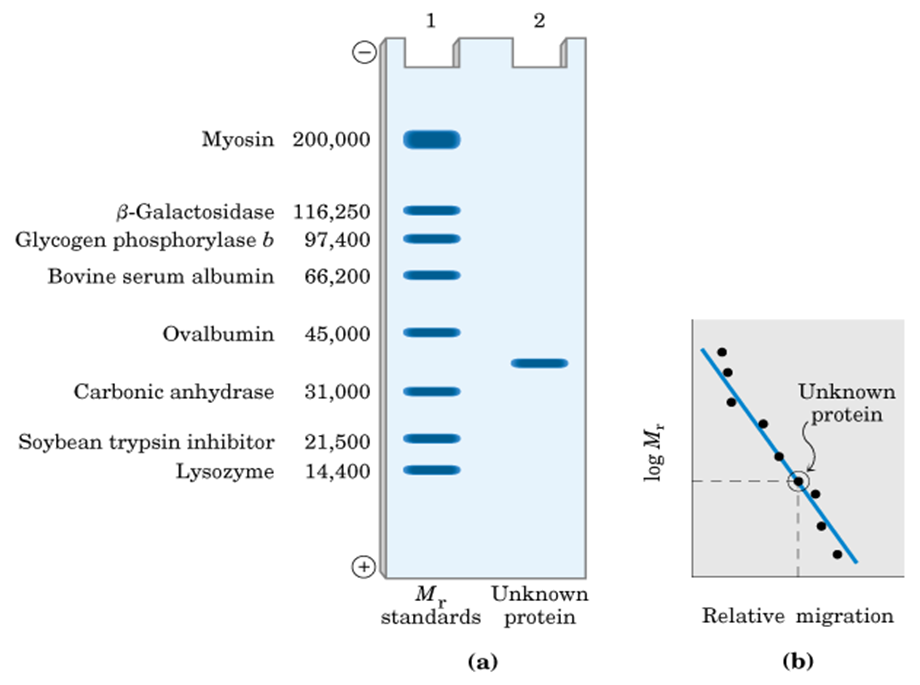
(3)利用SDS—PAGE法测定分子量
公式: logM = -
μR
(4)质谱法
(5)通过渗透压测定蛋白质分子量
3.蛋白质含量测定
(1)凯氏定氮法
(2)紫外吸收法
(3)双缩脲法
(4)福林试剂反应
(5)考马斯亮蓝G-250法


