酶促反应动力学
研究各种因素对酶促反应速度的影响。
影响因素包括有
酶浓度、底物浓度、pH、温度、抑制剂、激活剂等。
研究前提
Ⅰ.单底物、单产物反应
Ⅱ.酶促反应速度用单位时间内底物的消耗量和产物的生成量来表示
Ⅲ.反应速度取其初速度,即底物的消耗量很小(一般在5﹪以内)时的反应速度
Ⅳ.底物浓度远远大于酶浓度
一、底物浓度对反应速度的影响
1.在其他因素不变的情况下,底物浓度对反应速度的影响呈矩形双曲线关系。

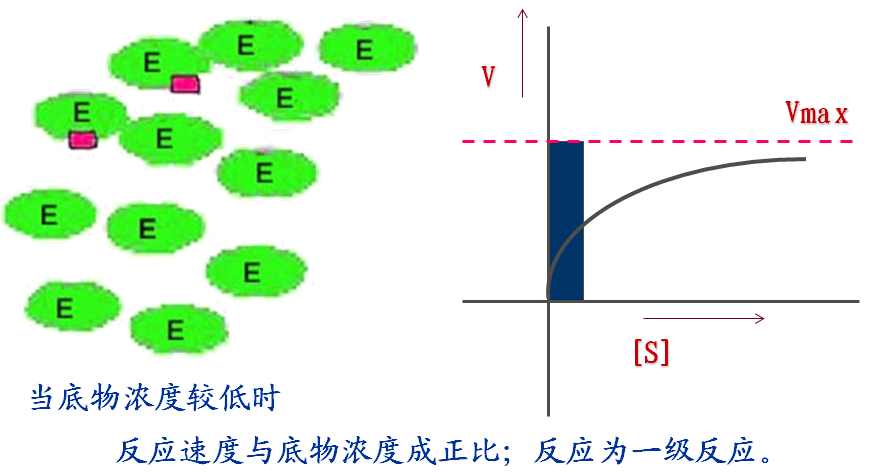

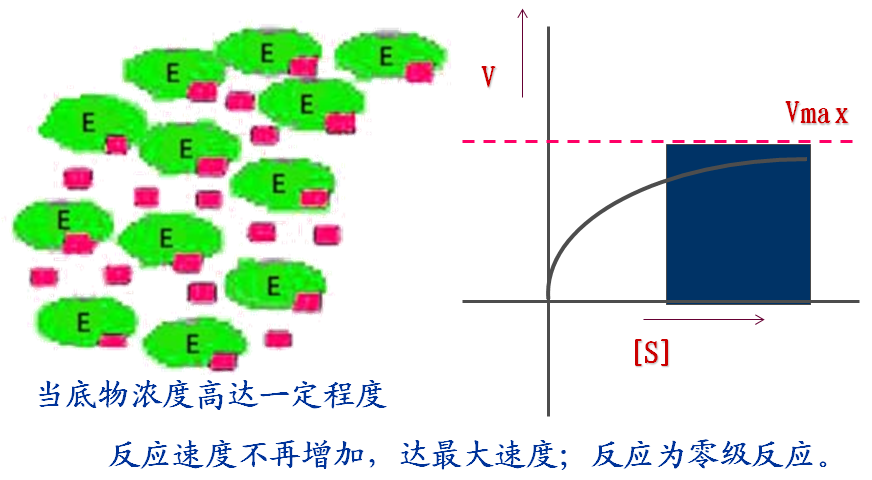

(1) 什么是米氏方程式?
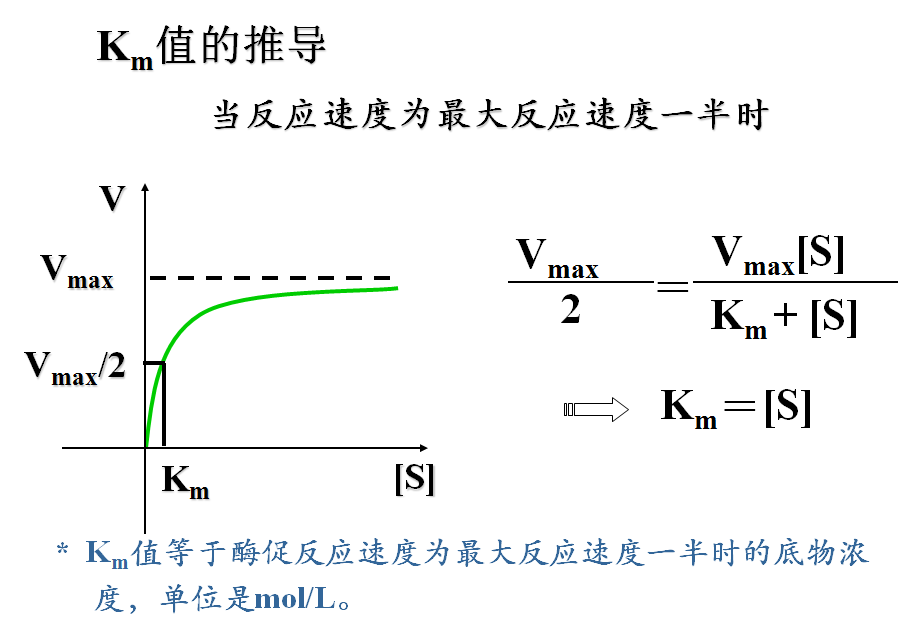
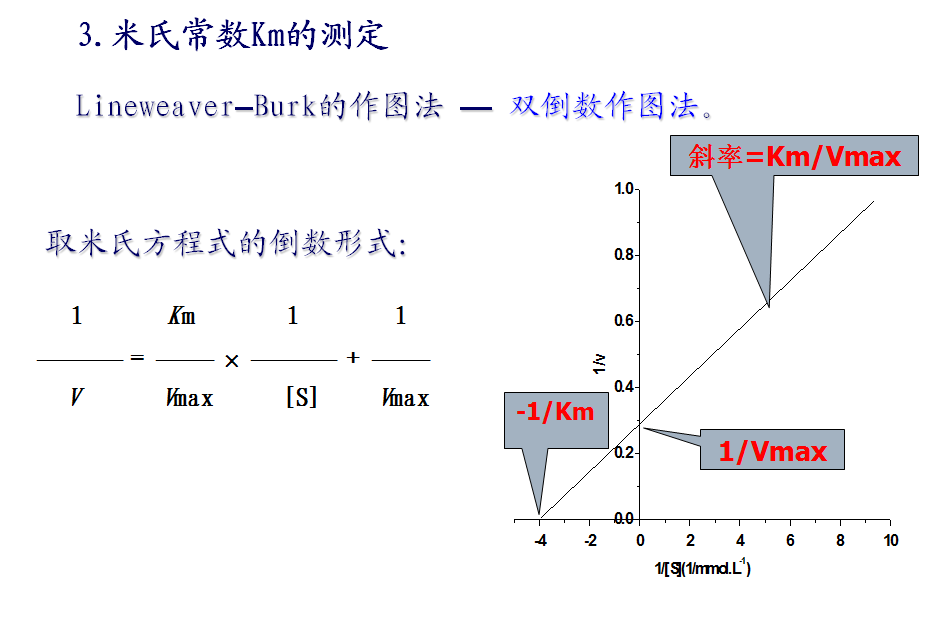
1913年Michaelis和Menten在快速平衡理论的基础上提出反应速度与底物浓度关系的数学方程式,简称米氏方程式(Michaelis equation),1925年Briggs和Haldane在稳态平衡理论的基础上并对米化方程进行了修正,但为纪念仍称米氏方程。




二、酶浓度对反应速度的影响
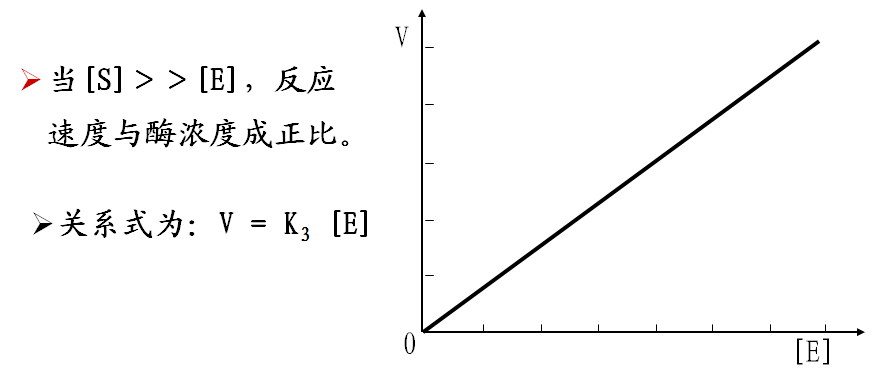
三、温度对反应速度的影响
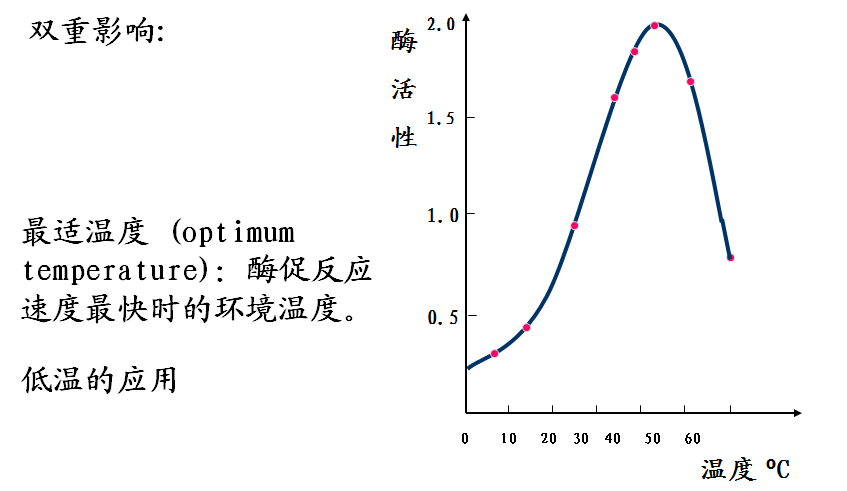
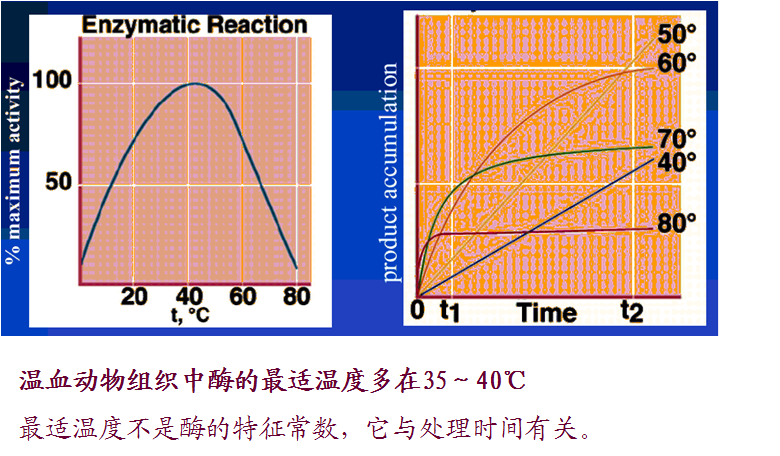
四、pH对反应速度的影响
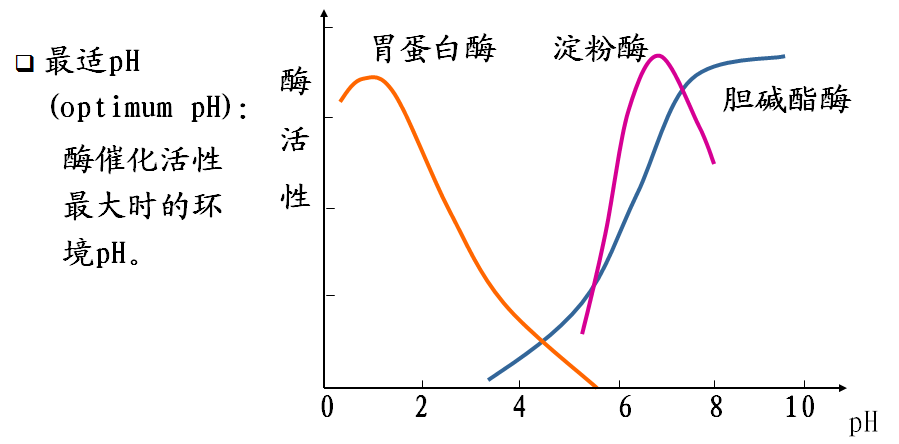
五、激活剂对反应速度的影响
激活剂(activator)
使酶由无活性变为有活性或使酶活性增加的物质。
• 必需激活剂 (essential activator)
• 非必需激活剂 (non-essential activator)
六、抑制剂对反应速度的影响
★ 酶的抑制剂(inhibitor)
凡能使酶的催化活性下降而不引起酶蛋白变性的物质统称为酶的抑制剂。
★ 区别于酶的变性
抑制剂对酶有一定选择性,而变性的因素对酶没有选择性。
抑制作用的类型
1.不可逆性抑制 (irreversible inhibition)
2.可逆性抑制 (reversible inhibition):
(1)竞争性抑制 (competitive inhibition)
(2)非竞争性抑制 (non-competitive inhibition)
(3)反竞争性抑制 (uncompetitive inhibition)
(一) 不可逆性抑制作用
* 概念
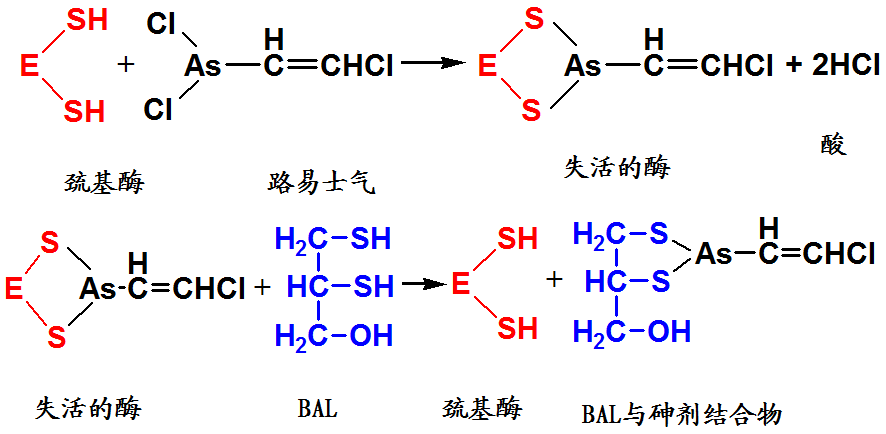
抑制剂通常以共价键与酶活性中心的必需基团相结合,使酶失活,不能用透析、超滤等方法予以除去。
* 举例
有机磷化合物→羟基酶
解毒——解磷定(PAM)
重金属离子及砷化合物→巯基酶
解毒——二巯基丙醇(BAL)


(二)可逆性抑制作用
* 概念
抑制剂以非共价键与酶或酶-底物复合物可逆性结合,使酶的活性降低或丧失;抑制剂可用透析、超滤等方法除去。
* 类型
竞争性抑制
非竞争性抑制
反竞争性抑制
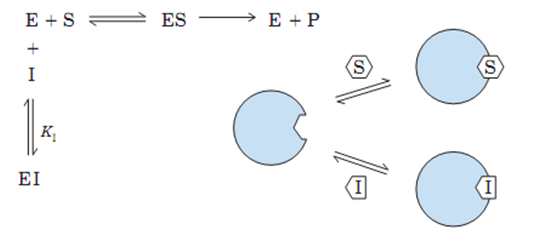
1.竞争性抑制作用
定义
抑制剂与底物的结构相似,能与底物竞争酶的活性中心,从而阻碍酶底物复合物的形成,使酶的活性降低。
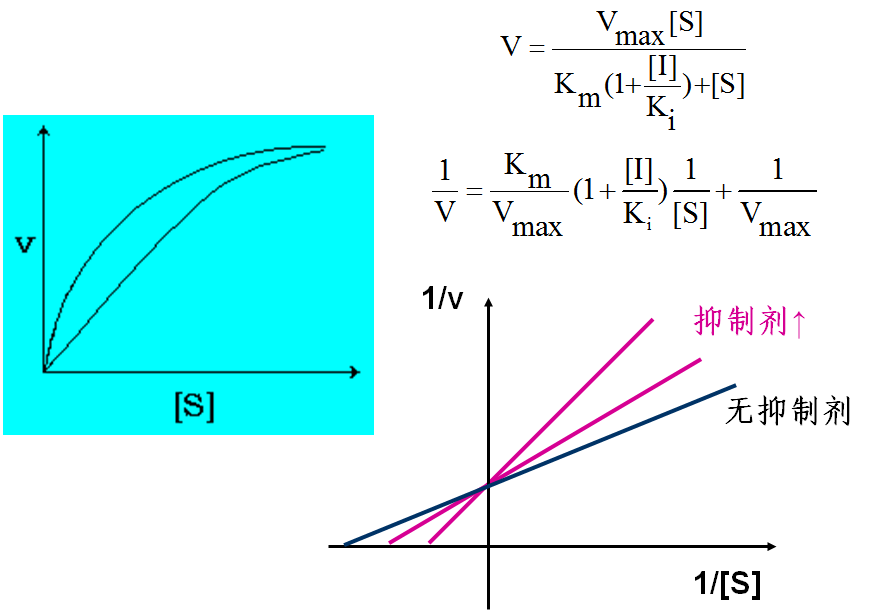
竞争性抑制的特点:
⑴ 竞争性抑制剂往往是酶的底物类似物或反应产物;
⑵ 抑制剂与酶的结合部位与底物与酶的结合部位相同;
⑶ 抑制剂浓度越大,则抑制作用越大;但增加底物浓度可使抑制程度减小;
⑷ 动力学参数:Km值增大,Vm值不变。
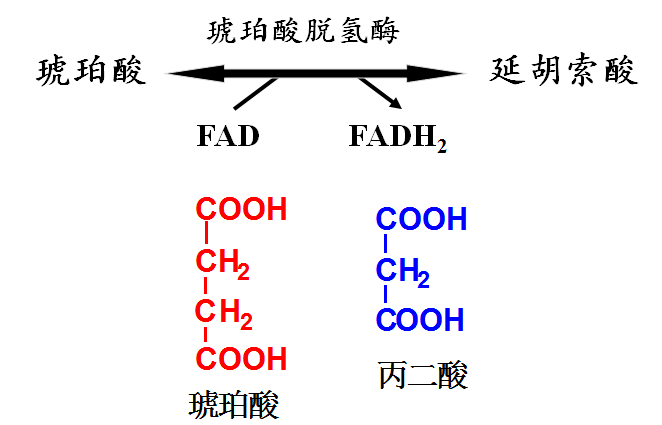
例1:丙二酸对琥珀酸脱氢酶的抑制
例2. 磺胺药对细菌FH2合成酶的抑制
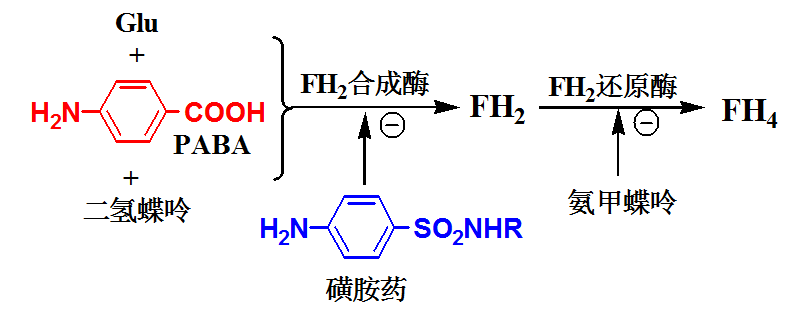
例3. 抗代谢物的抗癌作用
2. 非竞争性抑制
抑制剂与酶活性中心外的必需基团结合,底物与抑制剂之间无竞争关系。
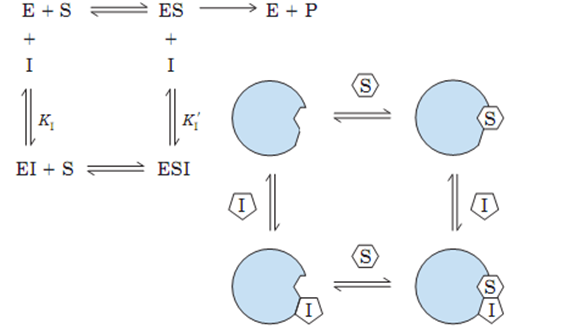
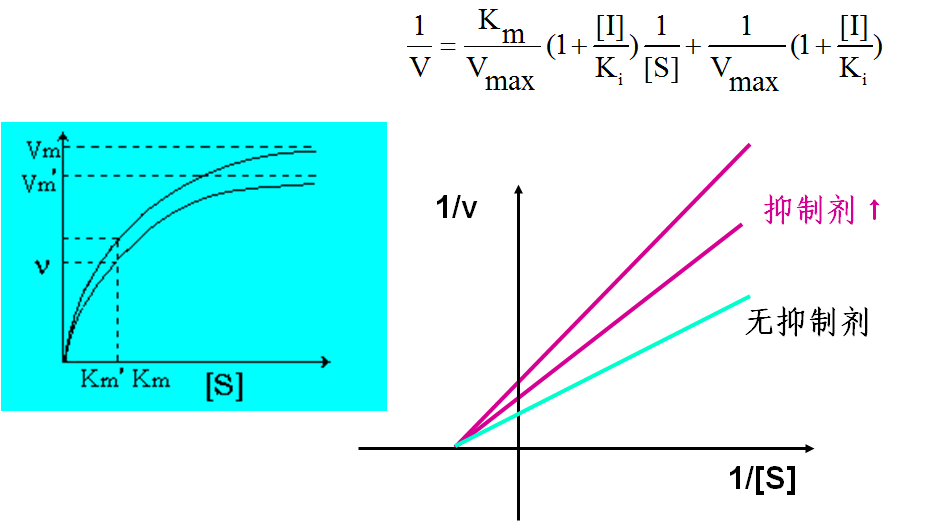
非竞争性抑制的特点:
⑴ 非竞争性抑制剂的化学结构不一定与底物的分子结构类似;
⑵ 底物和抑制剂分别独立地与酶的不同部位相结合;
⑶ 抑制剂对酶与底物的结合无影响,故底物浓度的改变对抑制程度无影响;
⑷ 动力学参数:Km值不变,Vm值降低。
3.反竞争性抑制
抑制剂仅与酶和底物形成的中间产物结合,使ES的量下降。
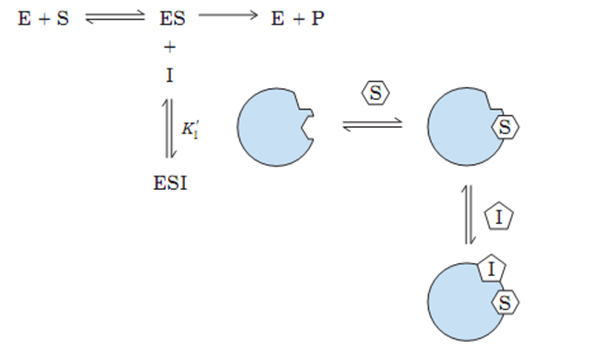
反竞争性抑制
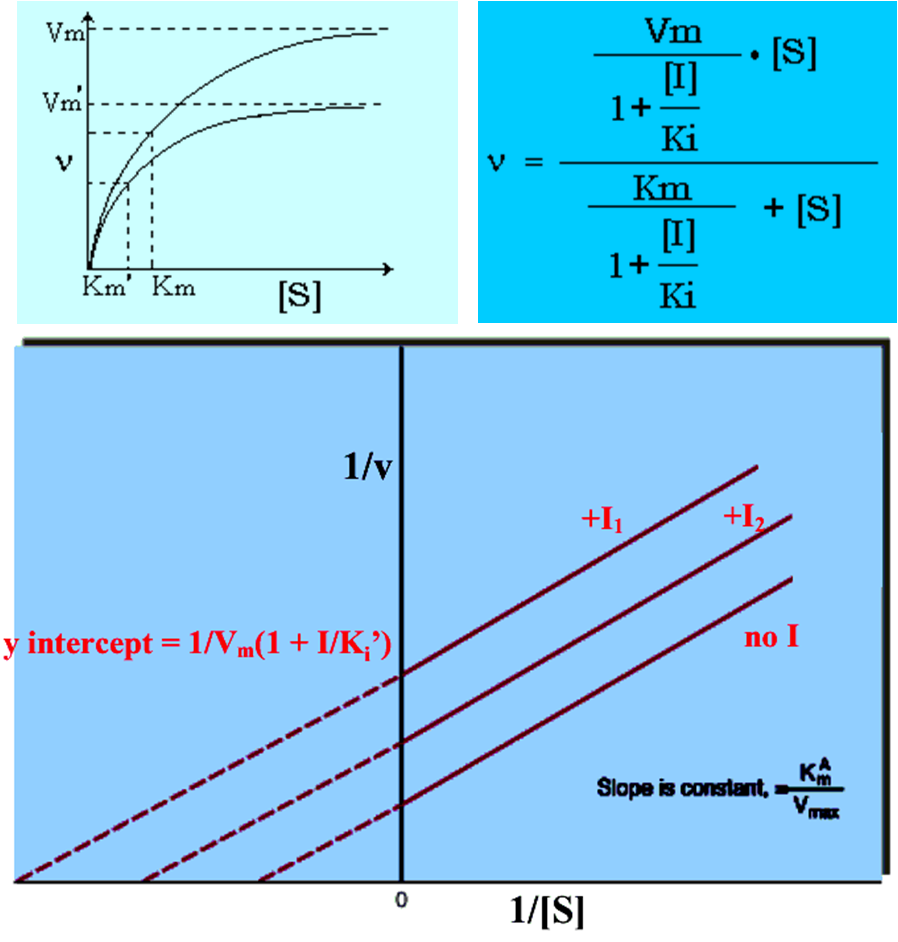
反竞争性抑制的特点:
⑴ 反竞争性抑制剂的化学结构不一定与底物的分子结构类似;
⑵ 抑制剂与底物可同时与酶的不同部位结合;
⑶ 必须有底物存在,抑制剂才能对酶产生抑制作用;抑制程度随底物浓度的增加而增加;
⑷ 动力学参数:Km减小,Vm降低。


