一、蛋白质的分类
1. 根据蛋白质形状

2. 根据蛋白质组成成分



3.根据溶解度分类

蛋白质种类繁多、功能多样,但是其组成的单位——氨基酸只有20个,那这样的对应关系怎样实现的呢?结构决定功能,那么,20种氨基酸怎样决定蛋白的空间结构,进而决定其功能的呢?
1952年丹麦科学家Linderstrom-Lang认为,蛋白质的结构分为四个层次,即一级、二级、三级和四级结构。
二、蛋白质结构的主要层次
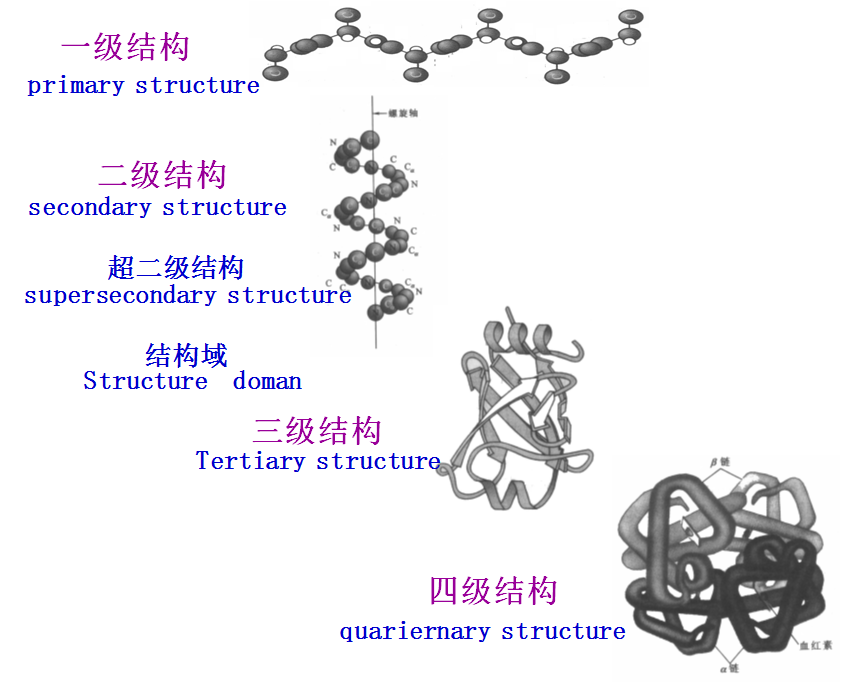
(一)蛋白质的一级结构
定义—1969年,国际纯化学与应用化学委员会(IUPAC)规定:
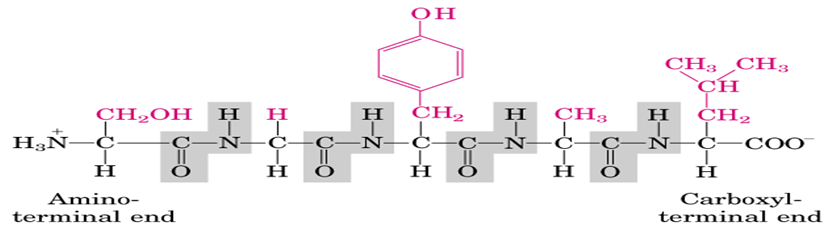
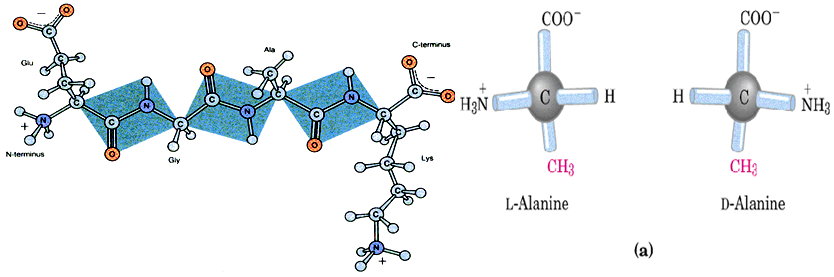
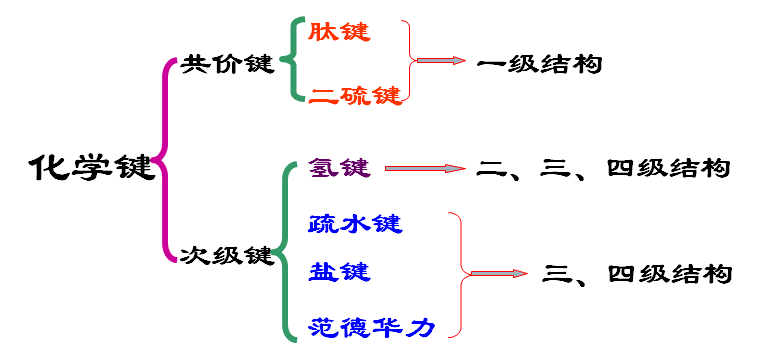
一级结构是指蛋白质的多肽链中氨基酸的排列顺序;主要靠肽键维系。
二~四级结构称为蛋白质的空间结构,或空间构象;主要靠次级键维系,尤其是疏水键。
(二)蛋白质的二级结构(secondary structure)
蛋白质的二级结构是指多肽链骨架中原子的局部空间排列,不涉及侧链的构象,也就是该肽段主链骨架原子的相对空间位置。
主要有α-螺旋、β-折叠、β-转角和无规则卷曲。
维持二级结构的力量为氢键。
构象与构型
构象是指原子或基团围绕单键旋转所形成的不同空间结构。
构型是指原子或基团在空间的不同排列方式,构型的转换需要键的断裂。
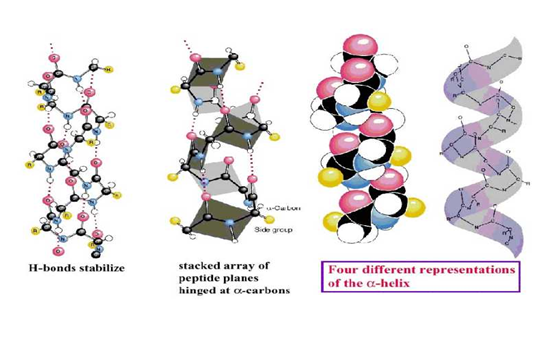
1.α-螺旋(α-helix)
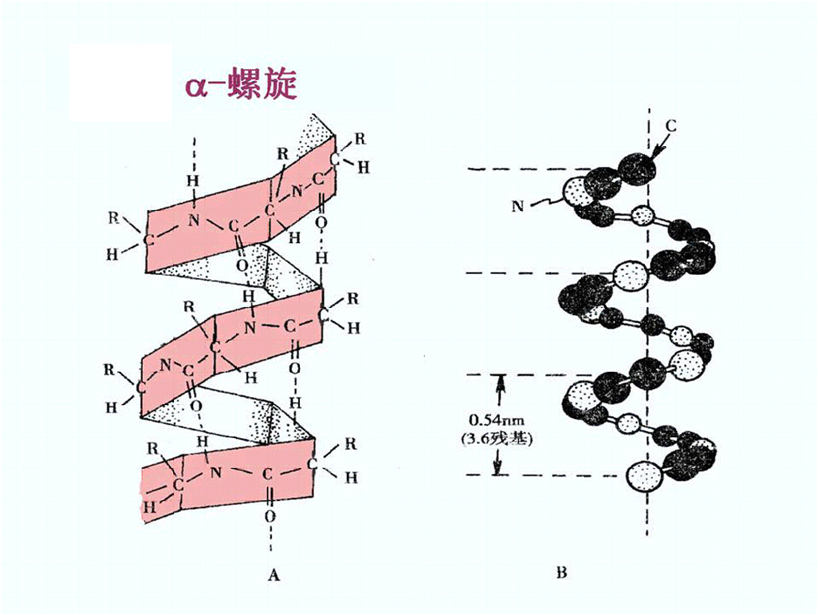
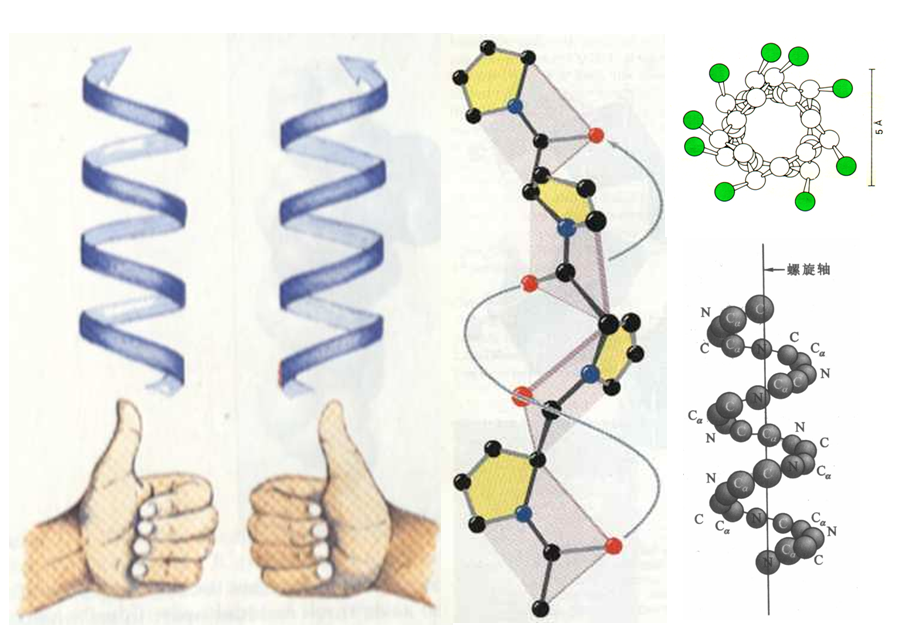
(1)α-螺旋特征
右手螺旋:3.6个AA/圈,螺距0.54nm;
氢键维系:链内氢键(从N-末端出发,AA1中C=O …AA4 N-H的形成),平行长轴;
所有氨基酸残基R侧链伸出螺旋
多数为右手(较稳定)。
(2)α-螺旋结构形成的限制因素
凡是有Pro存在的地方,不能形成。因Pro形成的肽键N原子上没有H,不可能形成氢键。
静电斥力。若一段肽链有多个Glu或Asp相邻,则因pH=7.0时都带负电荷,防碍α螺旋的形成;同样多个碱性氨基酸残基在一段肽段内,正电荷相斥,也防碍α螺旋的形成。
位阻。如Asn、Leu侧链很大,防碍α螺旋的形成。
2.β-折叠( β- sheet)
多肽链中一段较伸展的周期性折叠的锯齿形的主链构象。
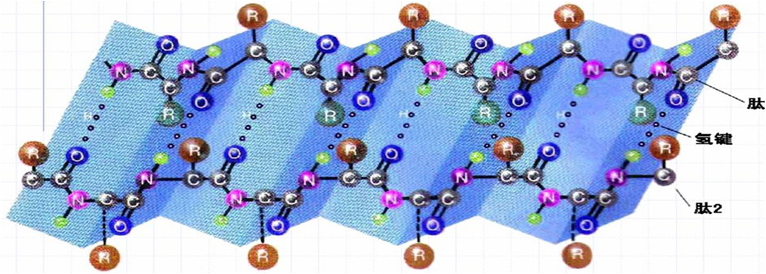
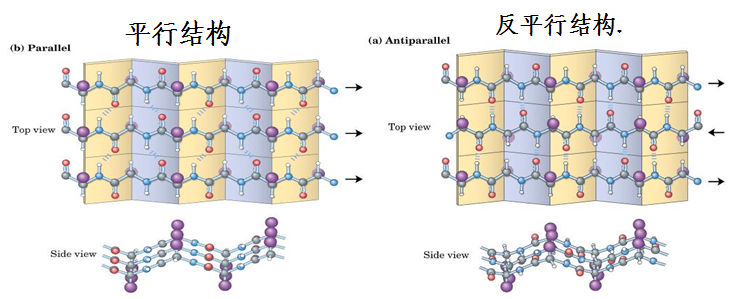
(1)β-折叠的两种类型:
平行式:即所有肽链的N-端都在同一边。
反平行式:即相邻两条肽链的方向相反。
(2)β-折叠特征
&多肽链充分伸展,肽平面折叠成锯齿状;
&侧链交错位于锯齿状结构的上下方;
&氢键维系:氢键的方向垂直长轴;
&可有顺平行片层和反平行片层结构;
&肽链同侧两个相邻的同一基团之间的距离:平行折叠进制0.65nm;反平行折叠0.7nm;
3.β-转角(β-turn,β-弯曲、回折或发夹结构)
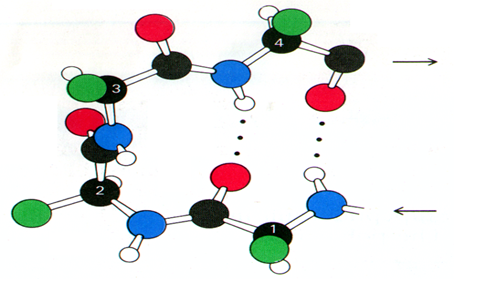
β-转角特征
由多肽链上4个连续的氨基酸残基组成,主链骨架以1800回折 ,第一个氨基酸残基C=O与第四个氨基酸残基的N-H之间形成氢键。
由于β-转角结构使多肽链走向发生改变。
甘氨酸残基侧链为氢原子,适于充当多肽链大幅度转向的成员,脯氨酸残基的环状侧链的固定取向有利于多肽链β-转角的形成.
4、自由回转(无规则卷曲)
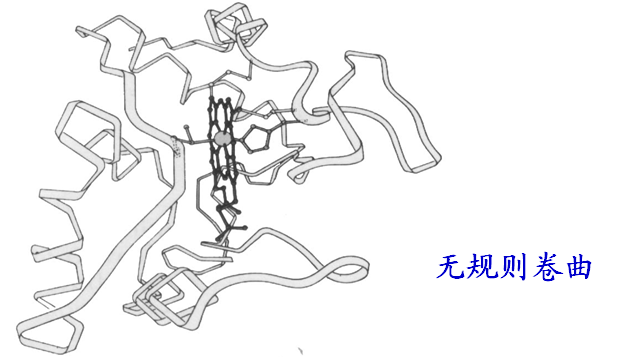
无规则卷曲特征
&蛋白质分子中那些没有确定规律性的部分肽链构象;
&有利于多肽链形成灵活的具有特异生物学活性的球状构象(卷曲对环境极为敏感)。
&球状蛋白质分子含有大量无规则卷曲。
(三)超二级结构和结构域
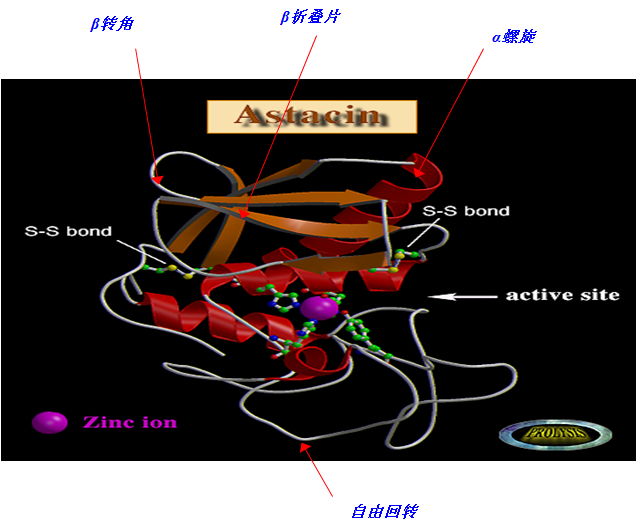
1、超二级结构(super secondary structure):
在蛋白质中经常存在由若干相邻的二级结构单元按一定规律组合在一起,形成有规则的二级结构集合体。
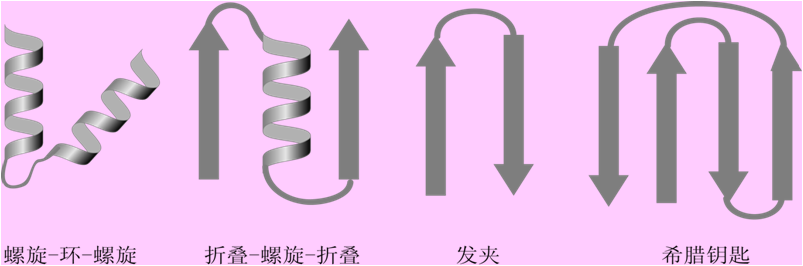
2.结构域
对于较大的蛋白质分子或亚基,多肽链常折叠成两个或多个球状簇,这种球状簇叫做域或结构域。

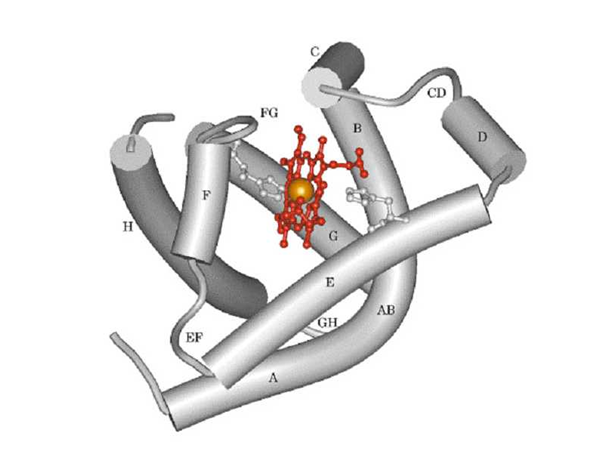
(四)蛋白质三级结构
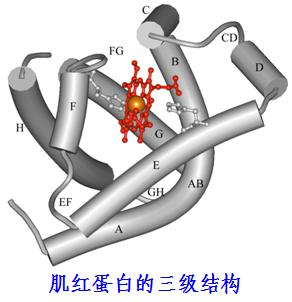 三级结构(tertiary structure):指一条多肽链在二级结构的基础上,进一步盘绕、折叠而成的具有特定肽链走向的紧密球状结构, 或者说三级结构是指多肽链中所有原子和基团在三维空间的排布。
三级结构(tertiary structure):指一条多肽链在二级结构的基础上,进一步盘绕、折叠而成的具有特定肽链走向的紧密球状结构, 或者说三级结构是指多肽链中所有原子和基团在三维空间的排布。
三级结构的稳定主要靠非共价键作用(疏水键、离子键、氢键和范德华引力等)
1.蛋白质三级结构中的次级键
 (1)非共价键
(1)非共价键
氢键
离子键
范德华力
疏水作用
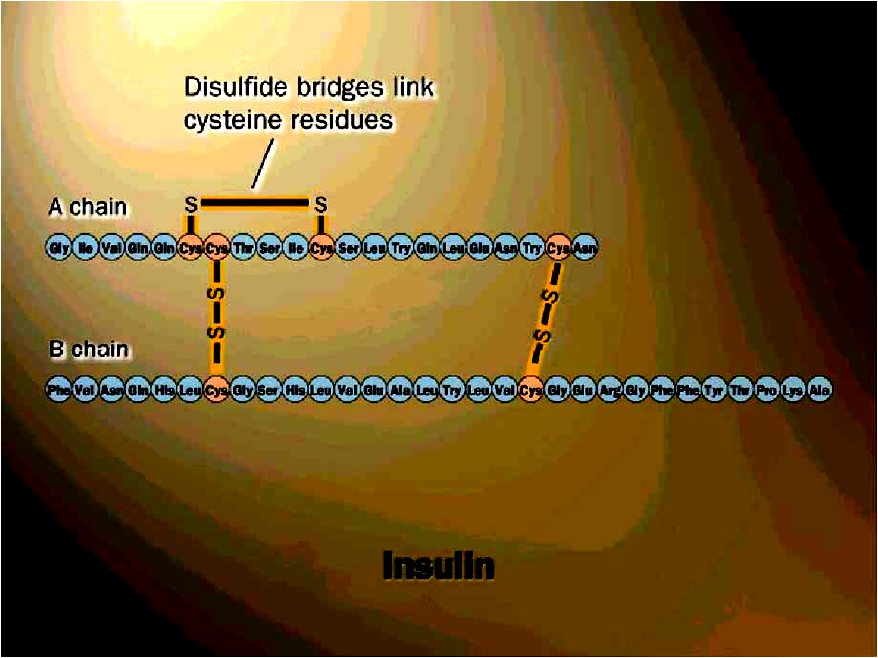
(2) S-S键
2.蛋白质三级结构的特点
含有丰富的二级结构单元;
具有明显的折叠层次;
分子呈现球状或椭圆形;
疏水基团位于分子内部,亲水基团位于表面
分子表面常有空穴。
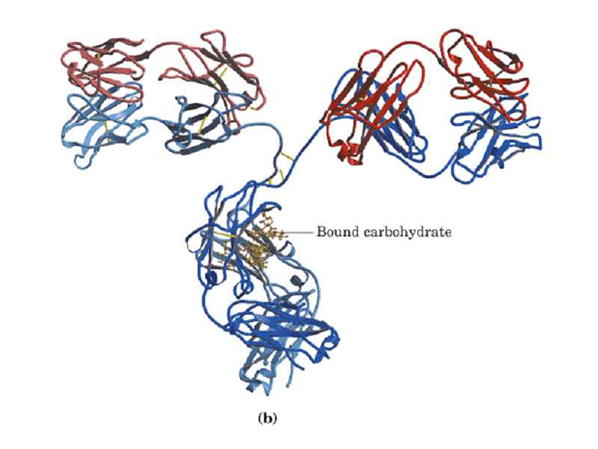
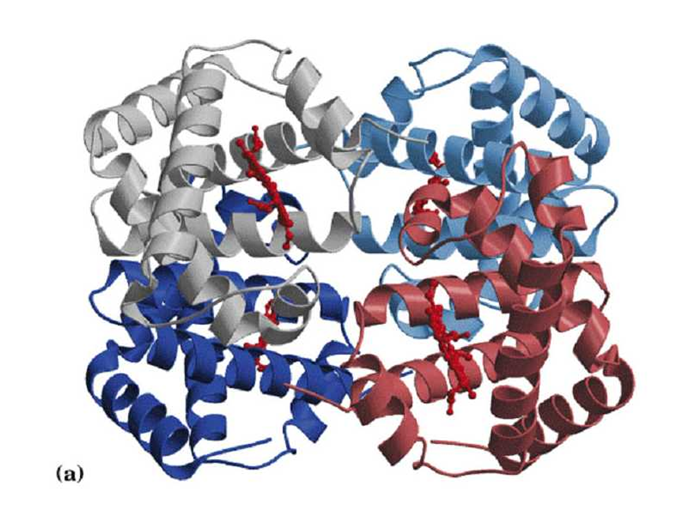
(五)蛋白质的四级结构
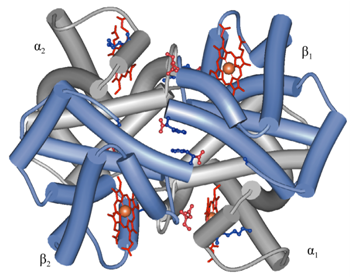 四级结构(quaternary structure):多个具有三级结构的多肽链的聚合。或者说四级结构指亚基的种类、数目及各个亚基在寡聚蛋白中的空间排布和亚基之间的相互作用。
四级结构(quaternary structure):多个具有三级结构的多肽链的聚合。或者说四级结构指亚基的种类、数目及各个亚基在寡聚蛋白中的空间排布和亚基之间的相互作用。
四级结构的稳定主要靠是疏水作用力,另外还有离子键、氢键、范德华引力等。
蛋白质的结构层次:

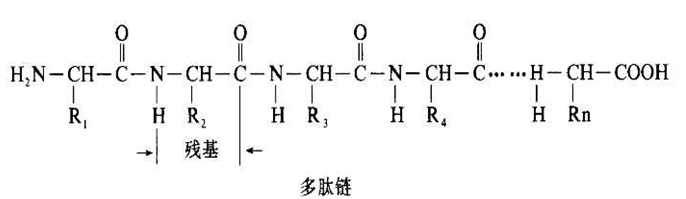

蛋白质分子中的共价键与次级键
(六)蛋白质的结构与功能
1.一级结构决定空间结构

(1)一级结构的变异与分子病保守氨基酸改变,功能改变
实例:镰型细胞贫血病
(2)同源蛋白质的一级结构差异与生物进化保守氨基酸不变,功能不变。
实例:不同生物的细胞色素C

2.空间结构是功能的基础——蛋白构象与疾病
老年痴呆
疯牛病
亨汀顿舞蹈病


(二级结构多为α螺旋、对蛋白酶敏感、水溶性) (一级结构相同,但二级结构全为β折叠, 抗蛋白酶、水溶性差、蛋白聚集成淀粉样沉淀)


