Protein Processing (蛋白质加工)
新生的多肽链大多数没有功能,必须经过加工修饰才能转变为活性蛋白质
 一、新生肽链的切割
一、新生肽链的切割
新生蛋白质经蛋白酶切割后变成有功能的成熟蛋白质
1、N端fMet或Met的切除无论原核生物还是真核生物,N端的甲硫氨酸往往在多肽链合成完毕前就被切除。
2、新生肽的切割方式
(1)N末端切割
(2)多聚蛋白的切割
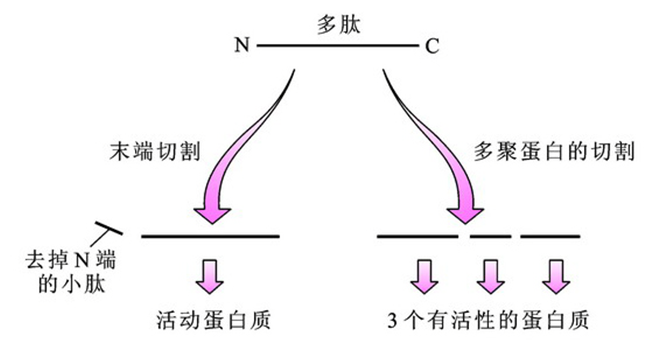
左: 新生蛋白质在去掉N端一部分残基后变成有功能的蛋白质;
右: 某些病毒或细菌可合成无活性的多聚蛋白质,经蛋白酶切割后成为有功能成熟蛋白。
(3) 切除新生肽中的非功能片段


实例1:前胰岛素原蛋白翻译后成熟过程
二 半胱氨酸间形成二硫键 (To from disulfide bonds between Cysteines)

三 特定氨基酸的修饰
1.Covalent modification (共价修饰):
Acetylation; 乙酰化作用 (如组蛋白)
Phosphorylation; 磷酸化 (如核糖体蛋白质)
Methylation; 甲基化 (如组蛋白、肌肉蛋白质)
Glycosylation; 糖基化 (如各种糖蛋白)
Hydroxylation; 羟基化作用 (如胶原蛋白)
Carboxylation; 羧基化
Addition of nucleotides. 加上核苷酸
To from disulfide bonds between Cysteines(半胱氨酸)
2.磷酸化(Phosphorylation )
• 主要由多种蛋白激酶催化
• 发生在丝氨酸、苏氨酸
和酪氨酸等三种氨基酸的侧链。
3.糖基化
• 糖蛋白主要是蛋白质侧链上的天冬氨酸、丝氨酸、苏氨酸残基加上糖基形成的;
• 内质网可能是蛋白质N-糖基化的主要场所。
• 所有的分泌蛋白和膜蛋白几乎都是糖基化蛋白质。
四、 蛋白质的折叠(folding)
1.蛋白质折叠是翻译后形成功能蛋白质的必经阶段。
2.是一个复杂的过程:
首先折叠成二级结构,然后再进一步折叠盘绕成三级结构。
对于单链多肽蛋白质,三级结构就已具有蛋白质的功能;
对于寡聚蛋白质,仍需进一步组装成更为复杂的四级结构,才能表现出天然蛋白的活性或功能。
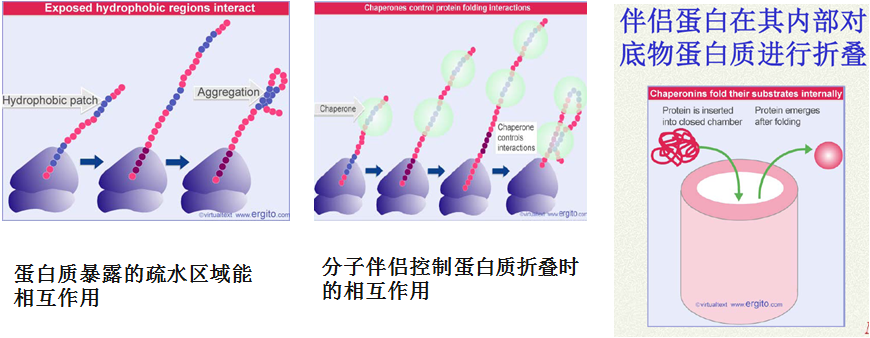
(一)分子伴侣(molecular chaperone)
分子伴侣是一类序列上没有相关性但有共同功能的保守性蛋白质,它们在细胞内能帮助其它多肽进行正确的折叠、组装、运转和降解。
(二)分子伴侣的分类
1 热休克蛋白(heat shock protein)
它是一类应激反应性蛋白,包括Hsp7 0、Hsp 40和GrpE三族,广泛存在于原核及真核细胞中。三者协同作用,促使某些能自发折叠的蛋白质正确折叠形成天然空间构象。
2 伴侣素(chaperonin)
包括Hsp60和Hsp10(原核细胞中的同源物分别为GroEL和GroES),它主要是为非自发性折叠蛋白提供能折叠形成天然结构的微环境。
(三)分子伴侣的作用
伴侣分子在新生肽链折叠中主要通过:
1.防止或消除肽链的错误折叠,
2.增加功能性蛋白质折叠产率来发挥作用,而非加快折叠反应速度。
3.分子伴侣本身并不参与最终产物的形成



