诱导契合学说
上一节
下一节
决定酶作用特异性的机制——诱导契合学说
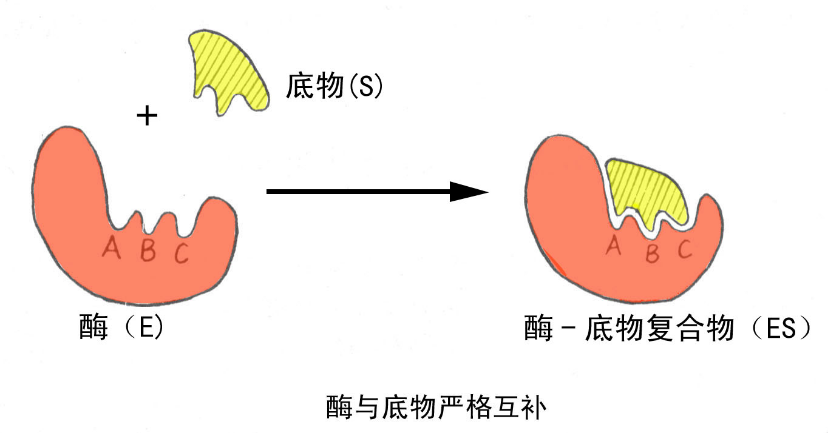
1.锁钥学说(1890):
认为整个酶分子的天然构象是具有刚性结构的,酶表面具有特定的形状。酶与底物的结合如同一把钥匙对一把锁一样。
此学说可以较好的解释酶的立体异构专一性;但不能解释:酶的多底物现象、酶对正反方向的催化等。
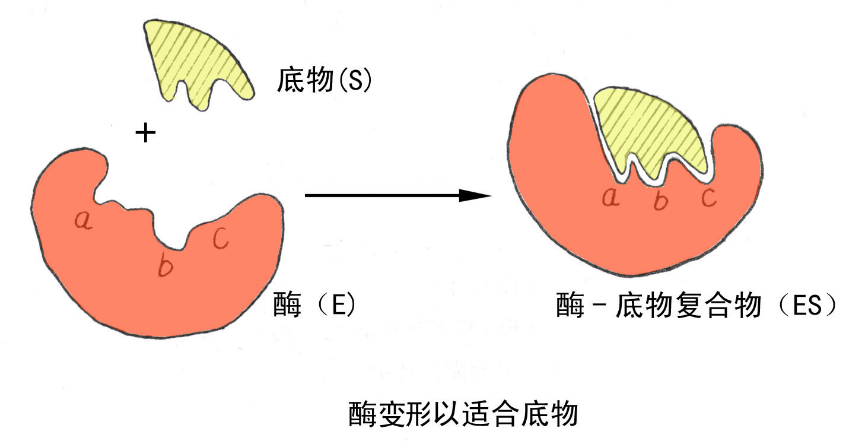
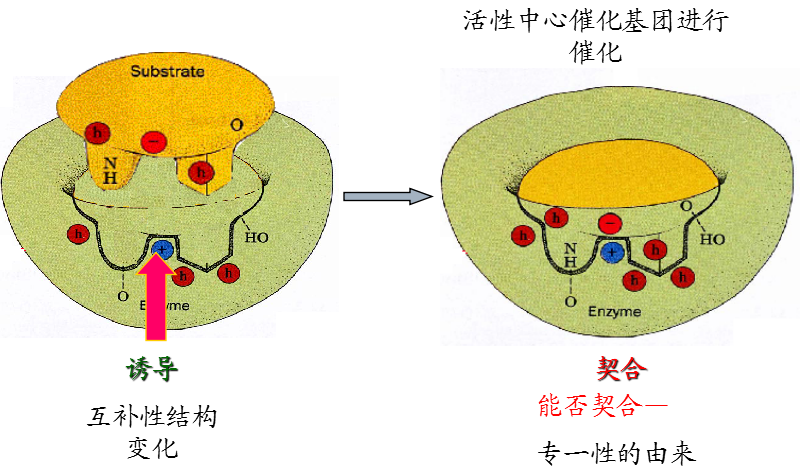
2、诱导契合学说(1964年 )
该学说认为酶的活性部位并不是和底物的形状正好互补的,而是在酶和底物结合的过程中,底物分子或酶分子,有时是两者的构象同时发生了一定的变化后才互补的,这时催化基团的位置也正好在所催化底物键的断裂和即将生成键的适当位置。这个动态的辨认过程称为诱导契合。
诱导契合机制
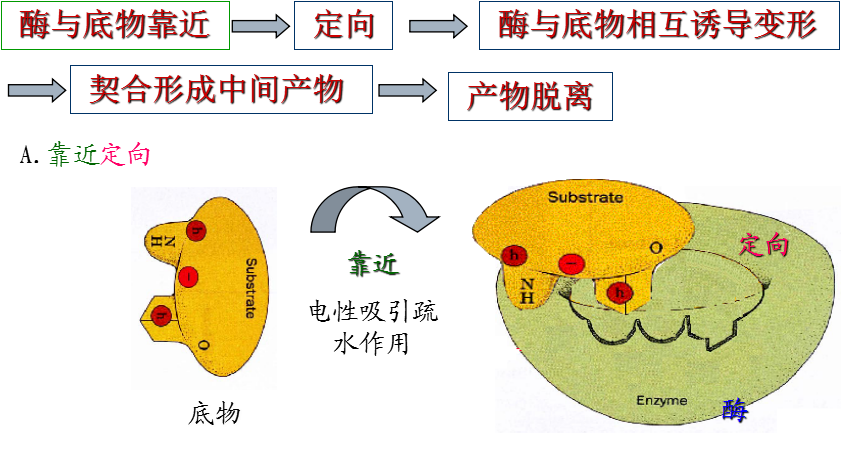
B.诱导契合
C.产物脱离