一、酶催化作用与分子活化能
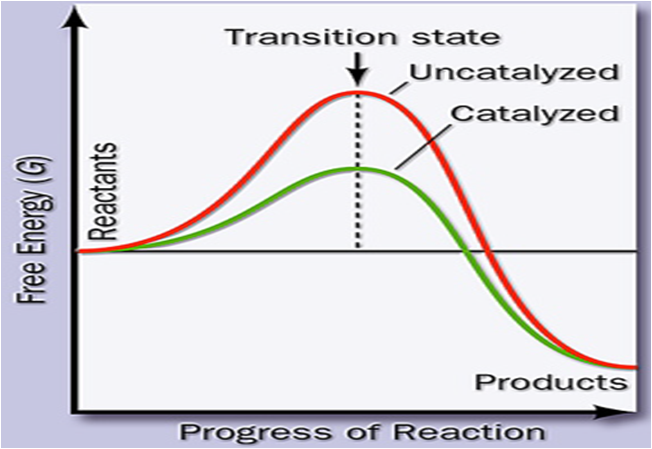
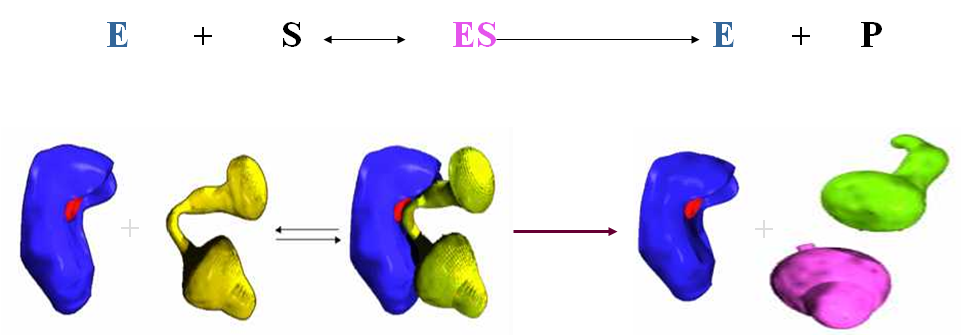
二、中间产物学说
三、决定酶作用特异性的机制——诱导契合学说
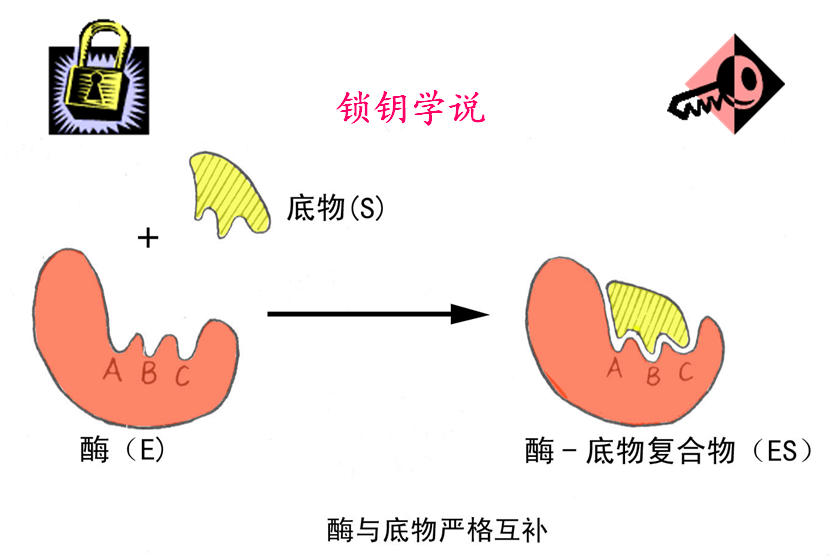
1.锁钥学说(1890):
认为整个酶分子的天然构象是具有刚性结构的,酶表面具有特定的形状。酶与底物的结合如同一把钥匙对一把锁一样。
此学说可以较好的解释酶的立体异构专一性;但不能解释:酶的多底物现象、酶对正反方向的催化等。
2、诱导契合学说(1964年)
该学说认为酶的活性部位并不是和底物的形状正好互补的,而是在酶和底物结合的过程中,底物分子或酶分子,有时是两者的构象同时发生了一定的变化后才互补的,这时催化基团的位置也正好在所催化底物键的断裂和即将生成键的适当位置。这个动态的辨认过程称为诱导契合。
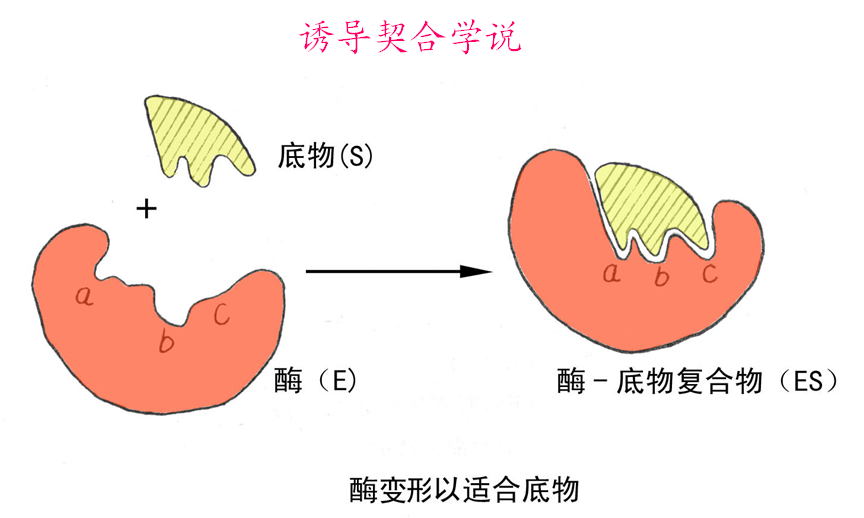
3.诱导契合机制
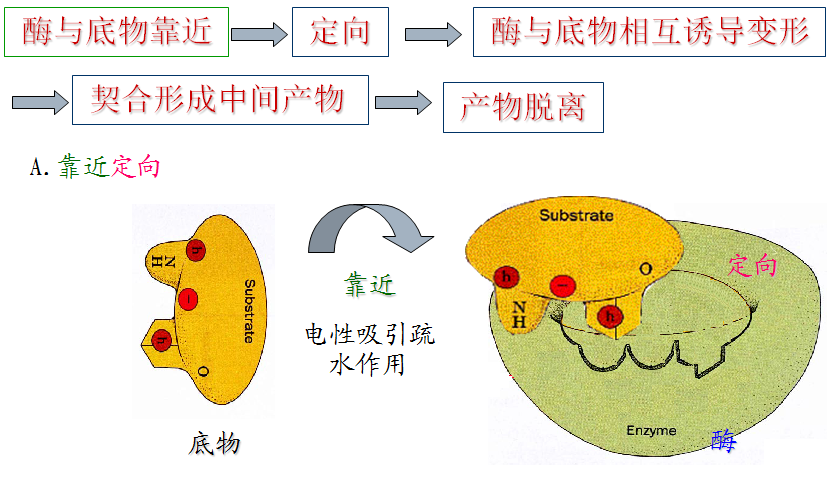
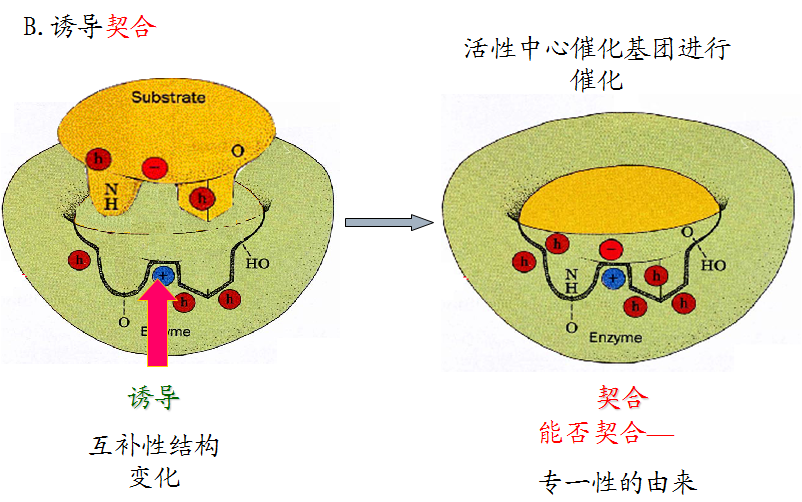
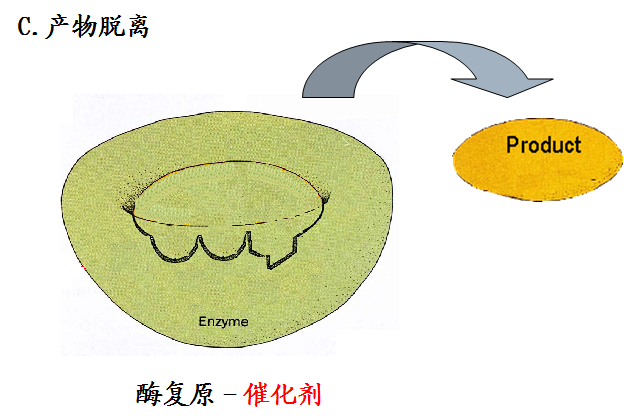
四、酶具有高催化效率的因素
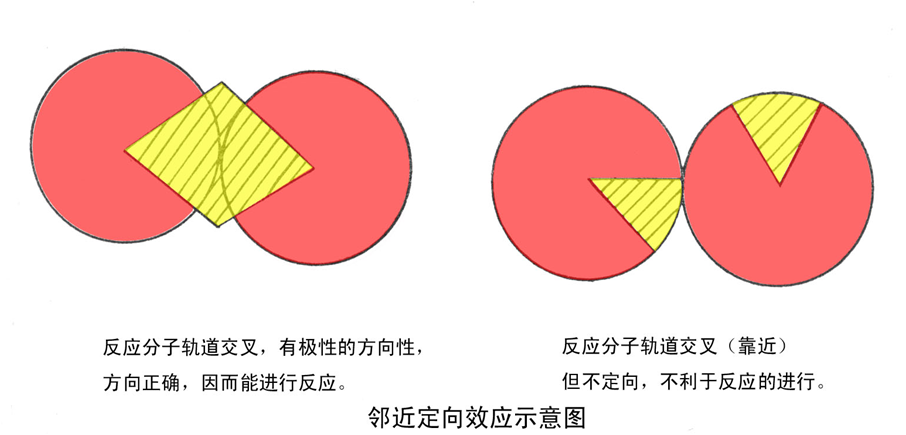
1.邻近效应、 定向效应
邻近效应:在酶促反应中,由于酶和底物分子之间的亲和性,底物分子有向酶的活性中心靠近的趋势,最终结合到酶的活性中心,使底物在酶活性中心的有效浓度大大增加的效应。
定向效应:当专一性底物向酶活性中心靠近时,会诱导酶分子构象发生改变,使酶活性中心的相关基团和底物的反应基团正确定向排列,同时使反应基团之间的分子轨道以正确方向严格定位,使酶促反应易于进行。
以上两效应使分子间的反应变成类分子内的反应。
使酶具有高效率和专一性特点。
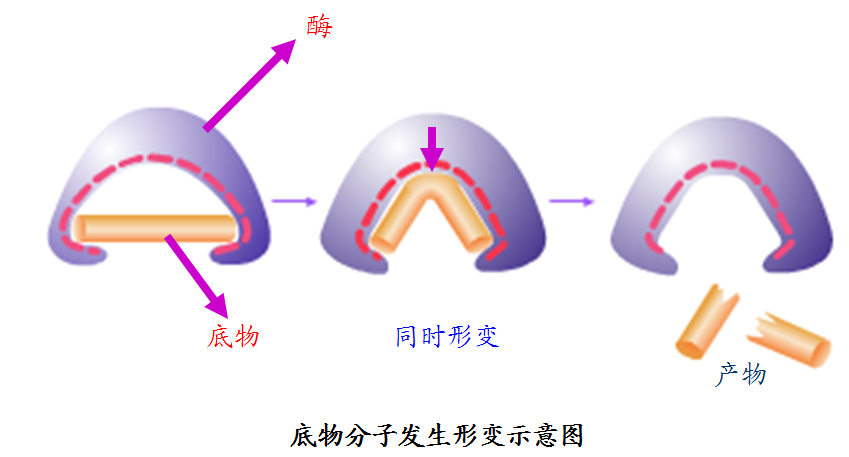
2.底物分子的张力和形变效应
当酶与底物靠近时,不仅酶构象受底物作用而变化,底物分子也常常受酶作用而变化,也就是酶使底物分子中的敏感键发生“变形”,从而促使底物中的敏感键更易于破裂。因而更容易形成一个互相契合的酶—底的复合物而提高催化效率。
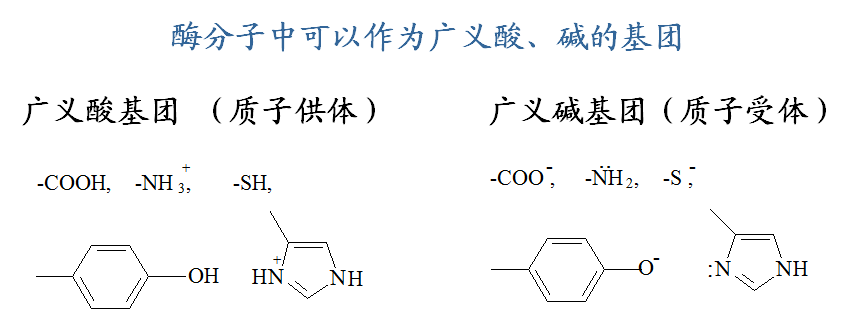
3.酸碱催化
酸碱催化是通过瞬时的向反应物提供质子或从反应物接受质子以稳定过渡态,加速反应的一类催化机制。
4.共价催化
催化剂通过与底物形成反应活性很高的共价过渡产物,使反应活化能降低,从而提高反应速度的过程,称为共价催化。
它包括两种类型:亲核催化和亲电催化
亲核基团: His 的咪唑基,Cys 的硫基,Asp 的羧基,Ser 的羟基等;
亲电子基团: 、
、
、
某些辅酶,如焦磷酸硫胺素和磷酸吡哆醛等也可以参与共价催化作用。
5.活性中心的低介电性
活性中心内部是一个疏水的非极性环境。
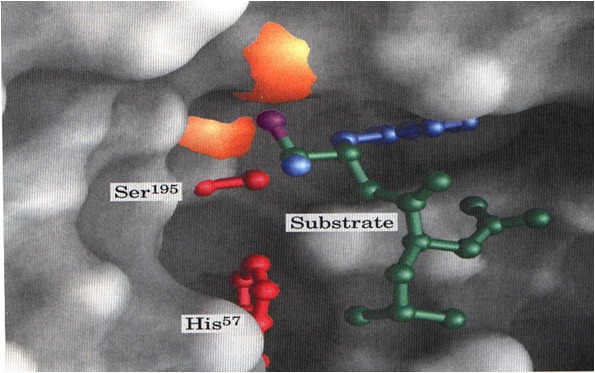
综上所述:
酶与底物结合时,由于酶的变形(诱导契合)或底物变形使二者相互适合,并依靠离子键、氢键、范德华力的作用和水的影响,结合成中间产物,在酶分子的非极性区域内,由于酶与底物的邻近、定向,使二者可以通过亲核/亲电催化、一般酸/碱催化或金属离子催化方式进行多元催化,从而大大降低反应所需的活化能,使酶促反应迅速进行。


