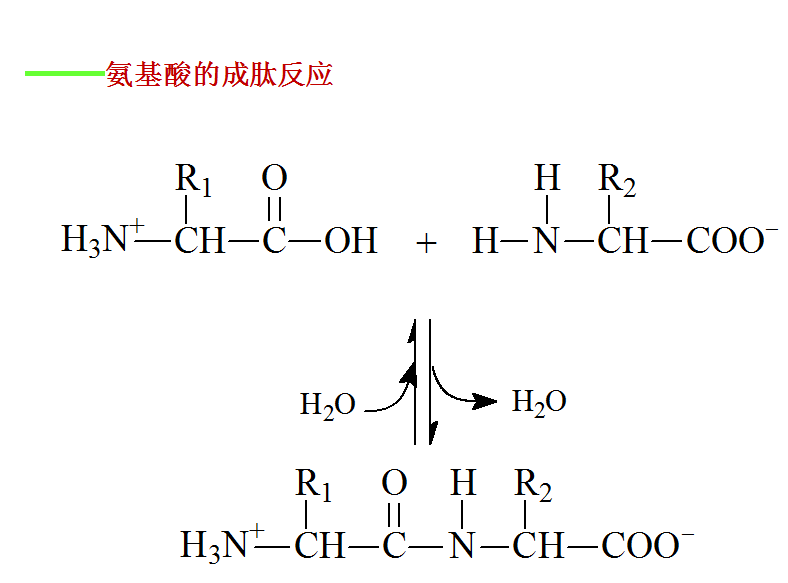
一、蛋白质的元素组成

二、氨基酸—— 组成蛋白质的基本单位
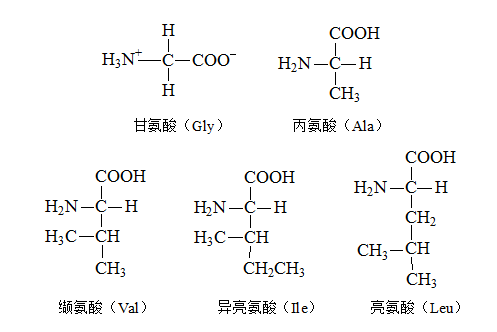
(一)氨基酸(Amino Acid)结构
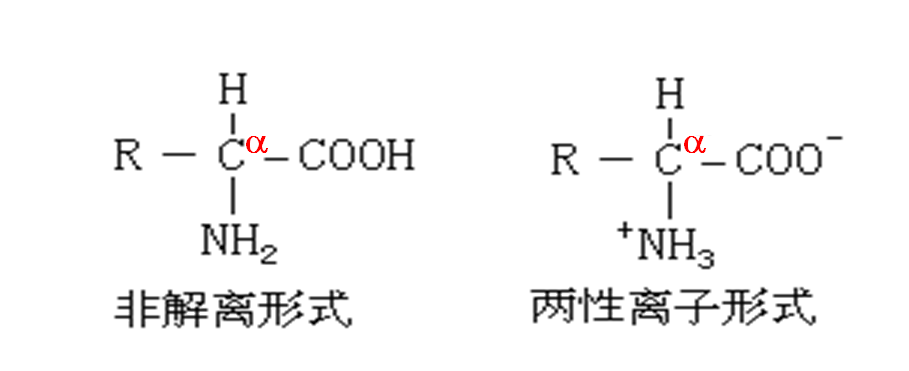
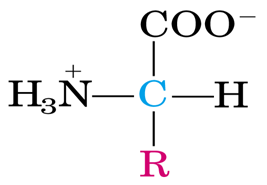
1、氨基酸的结构特点:
 存在自然界氨基酸有300种,组成生物体氨基酸有20种。
存在自然界氨基酸有300种,组成生物体氨基酸有20种。
(1)两性电解质;
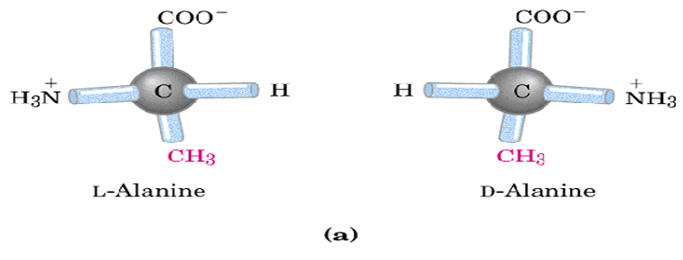
(2)除甘氨酸, α-碳原子都为不对称碳原子;
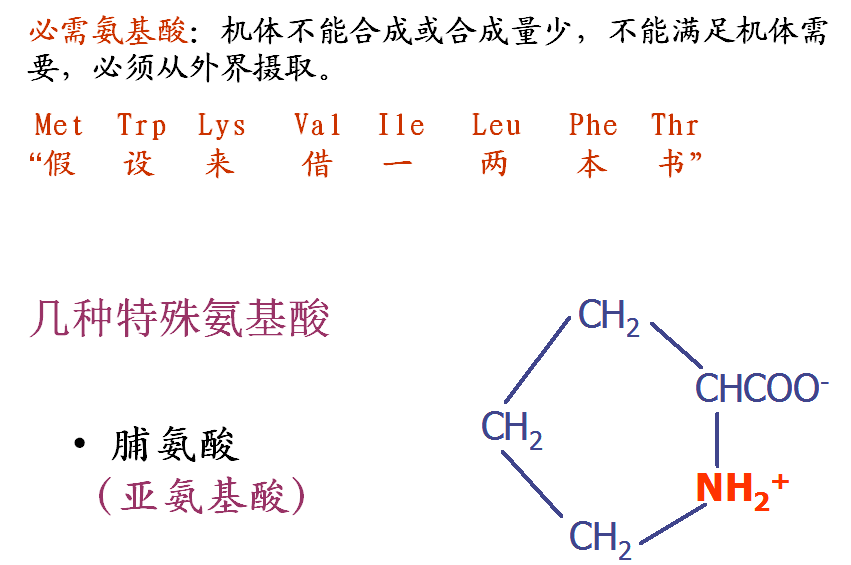
(3)均为α-氨基酸(除脯氨酸);
(4)均为L-氨基酸(除甘氨酸);

(二)氨基酸的分类
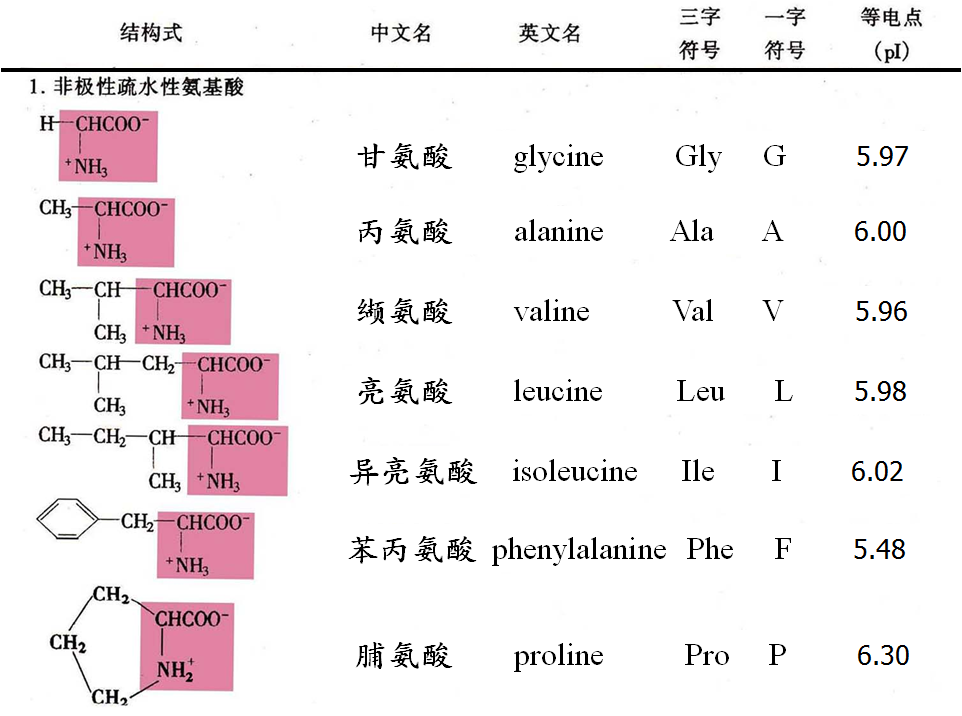
1.脂肪族氨基酸
2.芳香族氨基酸
3.杂环氨基酸
20种氨基酸的英文名称、缩写符号及分类如下:
1. 脂肪族氨基酸——R为脂肪烃基
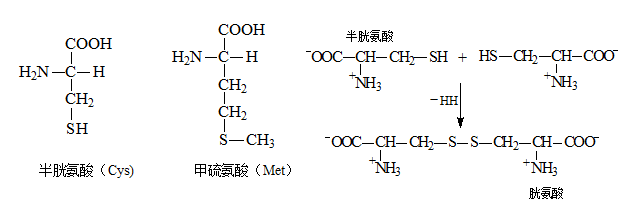
脂肪族氨基酸——R含硫
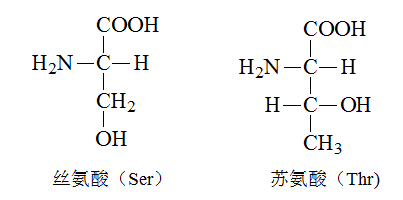
脂肪族氨基酸——R含羟基
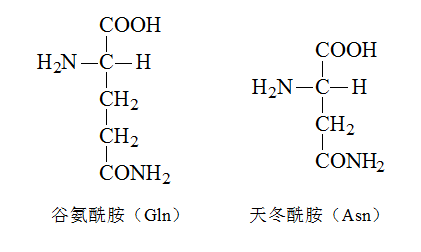
脂肪族氨基酸——R含酰胺基
脂肪族氨基酸——R含羧基
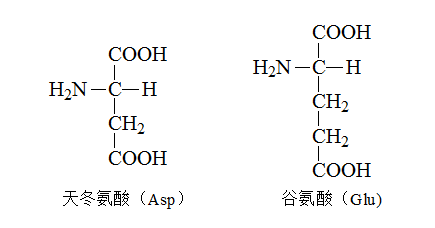
脂肪族氨基酸——R含氨基
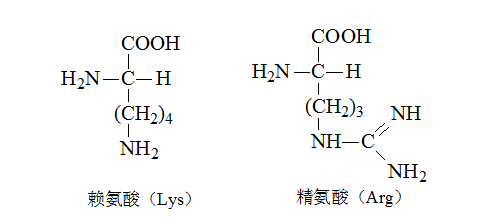
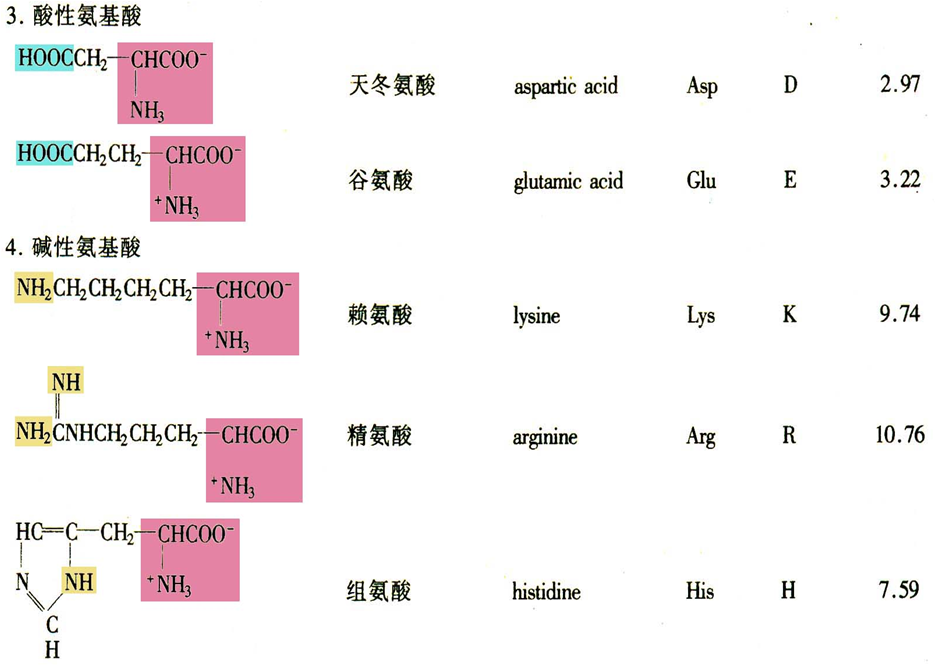
2. 芳香族氨基酸——R含苯环
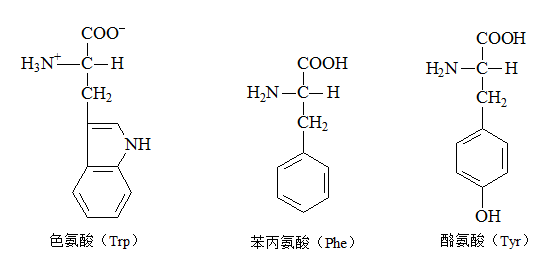
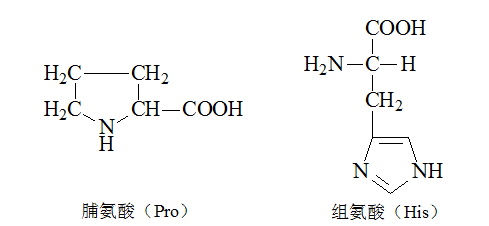
3. 杂环氨基酸

三、氨基酸的理化性质
1.物理性质
常见氨基酸均为无色结晶,其形状因构型而异
溶解性:各种氨基酸在水中的溶解度差别很大,并能溶解于稀 酸或稀碱中,但不能溶解于有机溶剂。
熔点:氨基酸的熔点极高,一般在200℃以上。
味感:其味随不同氨基酸有所不同,谷氨酸的单钠盐有鲜味,是味精的主要成分。
旋光性:除甘氨酸外,氨基酸都具有旋光性,能使偏振光平面向左或向右旋转,左旋者通常用(-)表示,右旋者用(+)表示。
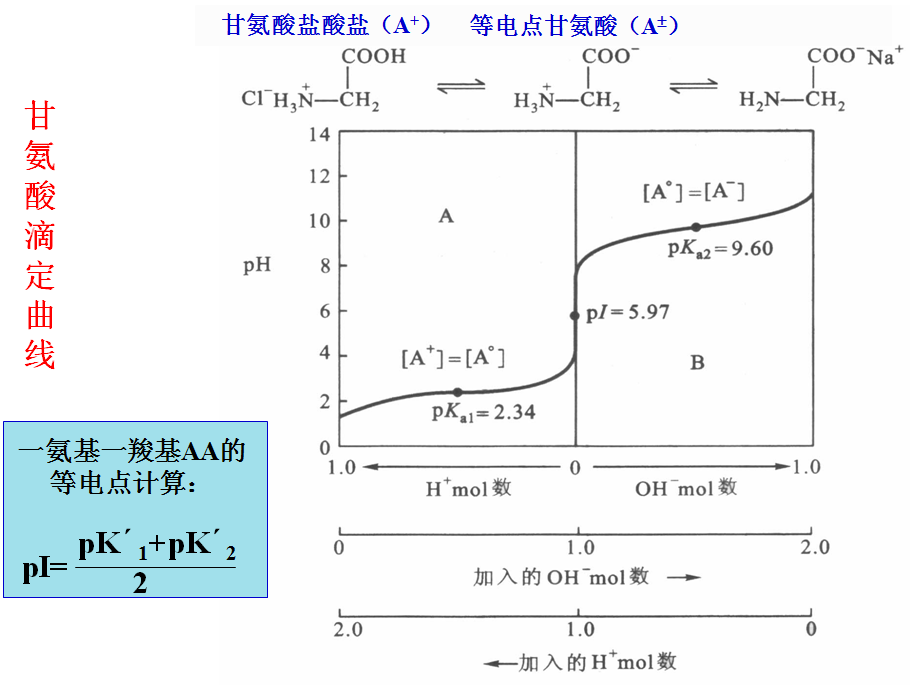
2.氨基酸的两性解离性质及等电点(pI)
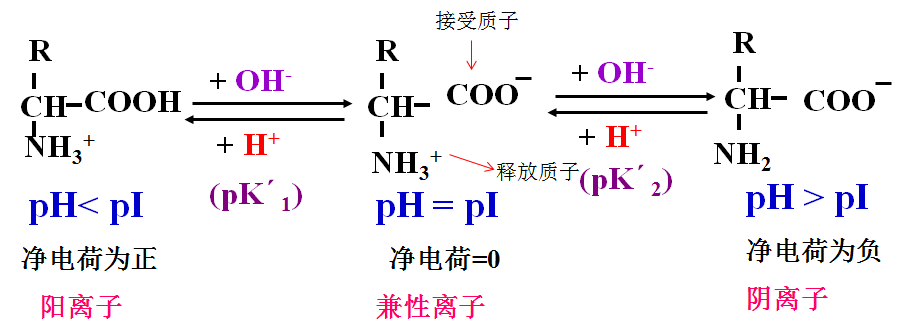
当氨基酸溶液在某一定pH值时,使某特定氨基酸分子上所带正负电荷相等,成为两性离子,在电场中既不向阳极也不向阴极移动,此时溶液的pH值即为该氨基酸的等电点(isoelctric point)。
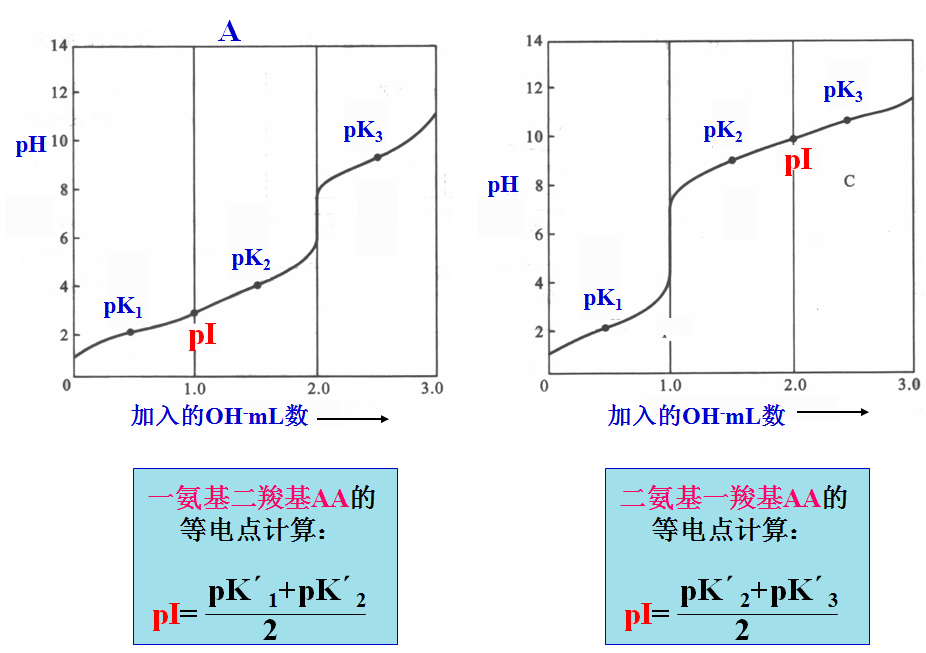
谷氨酸(A)和赖氨酸(B)滴定曲线和等电点计算
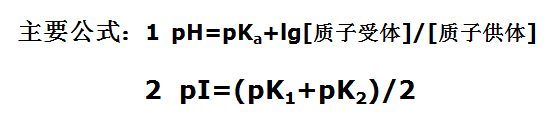

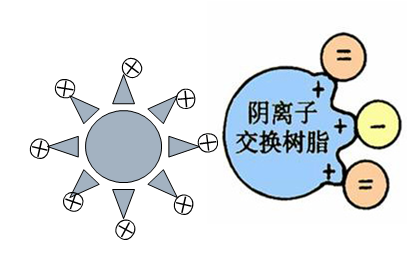 1用强酸型阳离子交换树脂分离下述每对氨基酸,当用pH=7.0的缓冲液洗脱时,下述每对中先从柱上洗脱下来的是哪种氨基酸?
1用强酸型阳离子交换树脂分离下述每对氨基酸,当用pH=7.0的缓冲液洗脱时,下述每对中先从柱上洗脱下来的是哪种氨基酸?
(1)Asp,Lys (2)Arg,Met (3)Glu,Val
(4)Gly,Leu (5)Ser,Ala
解答:氨基酸从离子交换柱上被洗脱下来的速度主要受两种因素的影响:其一是带负电荷的树脂磺酸基与氨基酸带正电荷的功能基团之间的离子吸附,吸附力大的在树脂上停滞的时间长,从柱上洗脱下来的速度慢;其二是氨基酸侧链基团与树脂强非极性骨架之间的疏水相互作用。非极性大的侧链R基氨基酸与树脂骨架间的疏水作用力强,从树脂柱上洗脱下来的速度慢。
3. 氨基酸的光学性质
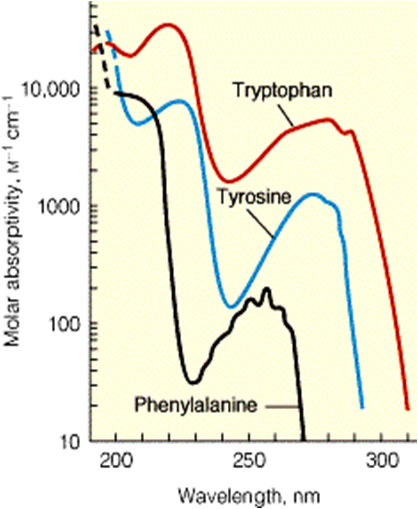 各种氨基酸在可见区都没有光吸收
各种氨基酸在可见区都没有光吸收
在紫外光区芳香族氨基酸在280nm处有最大吸收峰(色氨酸、酪氨酸、苯丙氨酸的最大吸收波长分别为279、278、259nm )
测定蛋白质溶液280nm的光吸收值是分析溶液中蛋白质含量的快速简便的方法。
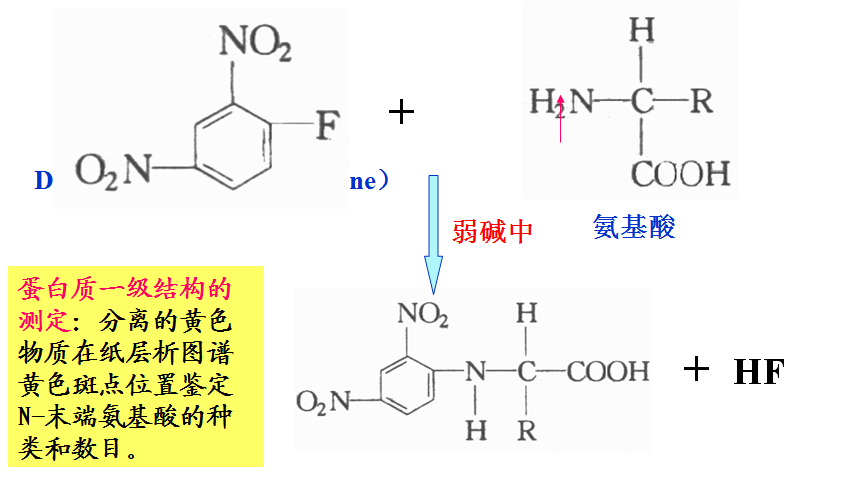
4、重要化学反应 ——氨基酸与2,4一二硝基氟苯(DNFB)的反应(sanger反应)
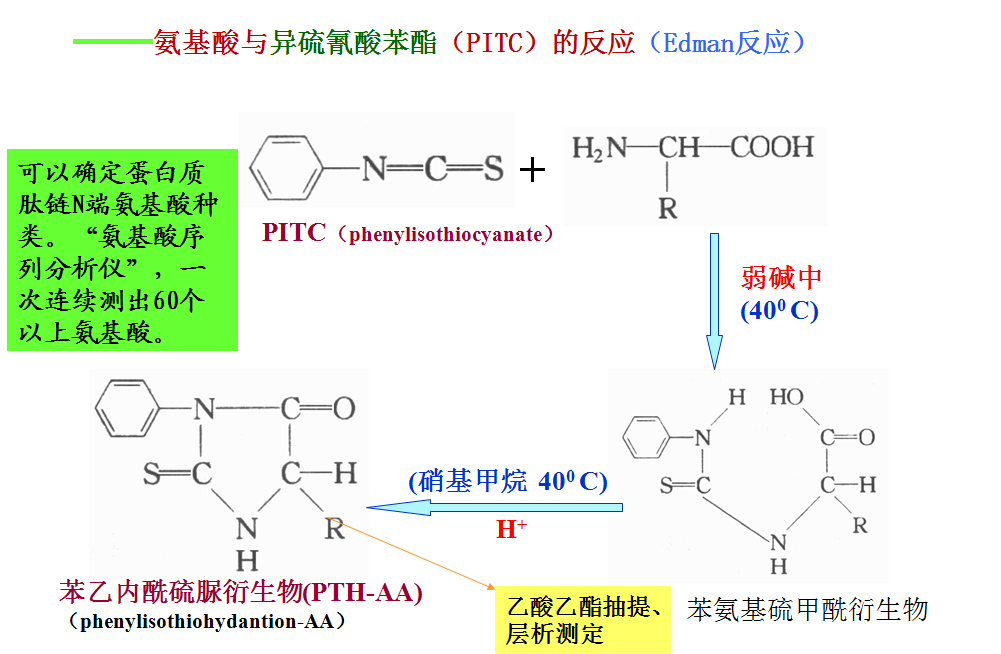
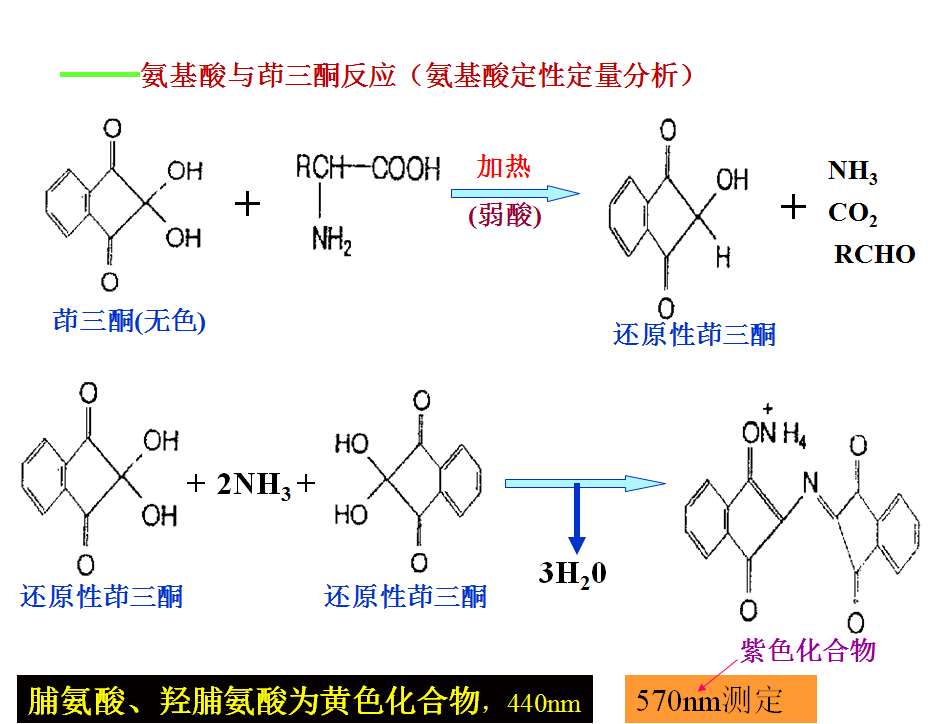
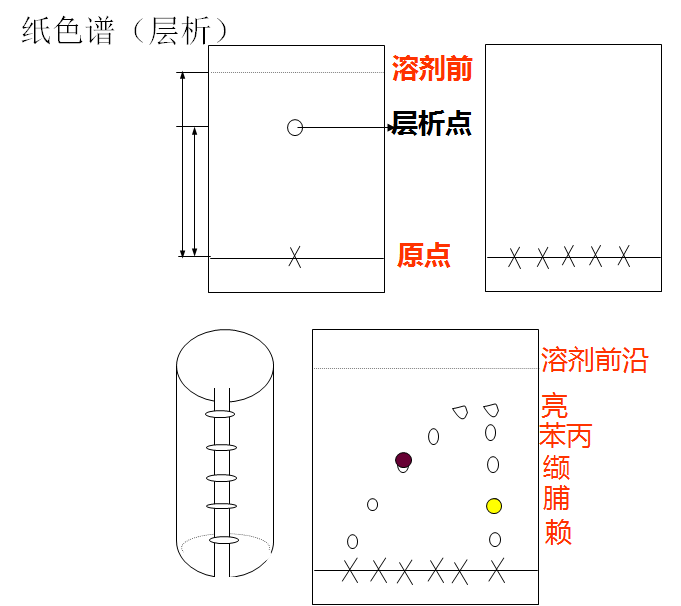
2 下述每组混合物分别用正丁醇-醋酸-水系统进行纸层析,指出每组中各组分的相对迁移率?
(1)Val,Lys (2)Phe,Ser (3)Ala,Val,Leu (4)Tyr,Ala,Ser,His
解答:纸层析分离氨基酸或小肽是根据它们的极性。层析时,流动相是非极性的有机溶剂,而固定相是滤纸吸附的水。氨基酸或小肽的侧链非极性越强,与固定相的作用力越小,迁移速度越大;反之,侧链的极性越强,与固定相的作用力越大,迁移的速度越小。