 溶胶剂
溶胶剂
一、概述
(一)定义
溶胶剂是指由多分子聚集体作为分散相的质点,分散在液体分散介质中形成的非均相胶体分散体系。溶胶剂其外观与溶液一样为透明液体,但具有乳光,即丁达尔(Tyndall)效应,是一种高度分散的热力学不稳定体系。
由于溶胶剂中质点小,分散度大,存在强烈的布朗运动,能克服重力作用而不下沉,因而具有动力学稳定性;但由于系统内粒子界面能大,促使质点聚集变大,以降低界面能。当聚集质点的大小超出了胶体分散体系的范围时,质点本身的布朗运动不足以克服重力作用,而从导致分散媒中析出沉淀,这个现象称为聚沉。溶胶聚沉后往往不能恢复原态。
溶胶剂在制剂中目前直接应用较少,通常是使用经亲水胶体保护的溶胶制剂,如氧化银溶胶就是被蛋白质保护而制成的制剂,用做眼、鼻收敛杀菌药。
(二)溶胶剂的性质
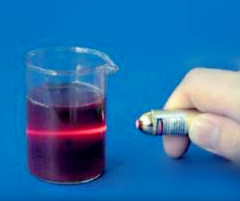
1.光学性质 强光通过溶胶剂时从侧面可见到圆锥形光束,称为丁达尔(Tyndall)效应。是由于胶粒粒度小于自然光波长引起光散射而产生。溶胶剂的颜色与光线的吸收和散射有密切关系,不同溶胶剂会产生不同的颜色,氯化金溶胶呈深红色,碘化银溶胶呈黄色,蛋白银溶胶呈棕色。
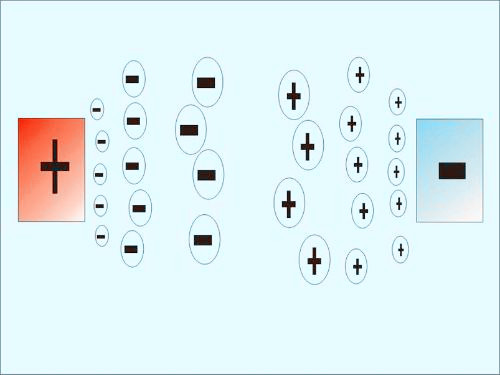
2.电学性质 溶胶剂由于双电层结构而荷电,可以荷正电,也可以荷负电。在电场的作用下胶粒或分散介质产生移动,在移动过程中产生电位差,这种现象称为界面动电现象。溶胶剂的电泳现象(即带电质点在电场中的移动)就是界面动电现象所致。动电电位越高电泳速度就越快。
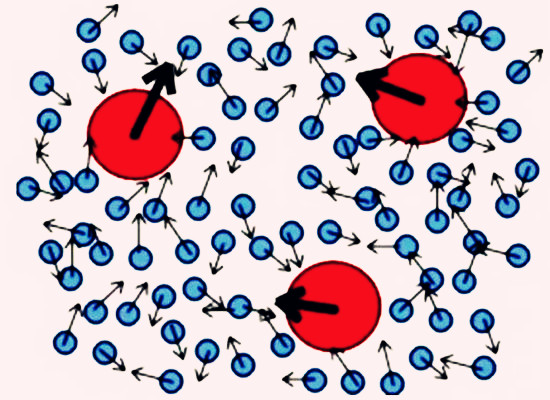
3.动力学性质 溶胶剂中的胶粒在分散介质中会自发地不规则的运动,称为布朗运动。布朗运动是由于胶粒受溶剂水分子不规则地撞击产生的。胶粒越小运动速度越大。溶胶粒子的扩散速度、沉降速度及分散介质的黏度等都与溶胶的动力学性质有关。由于胶粒存在布朗运动,可以认为溶胶是动力学稳定体系。
(三)溶胶剂的稳定性
溶胶剂属于热力学不稳定系统,主要表现为聚结不稳定性。
1.溶胶剂的稳定机理 溶胶胶粒上有使其带电的离子,也含有一部分反离子,形成的带电层称为吸附层。另一部分反离子散布在吸附层的外围,形成与吸附层电荷相反的扩散层。这种由吸附层和扩散层构成的电性相反的电层称双电层。
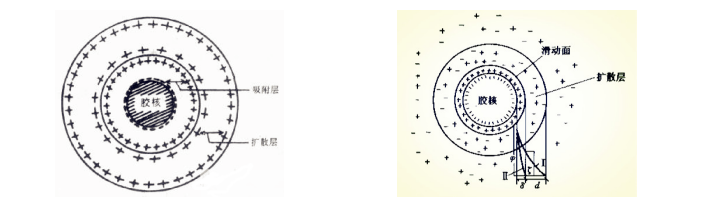
由于双电层的存在,在电场中胶粒与扩散层之间发生相对移动,表现出电位差,在滑动面上的电位称ζ电位。溶胶ζ电位的高低可以表示胶粒与胶粒之间的斥力,阻止胶粒因碰撞而发生聚集,所以大多数情况下ζ电位可作为估计溶胶稳定性的指标。溶胶质点还因具有双电层而水化,使胶粒外形成水化膜。胶粒的电荷越多,扩散层就越厚,水化膜也就越厚,溶胶越稳定。
2.影响溶胶稳定性的因素
(1)电解质的作用:电解质的加入会改变ζ电位的大小,可使扩散层变薄,较多的离子进入吸附层,使吸附层的电荷被中和,导致胶粒的电荷变少,水化膜变薄,易合并聚集。
(2)高分子化合物对溶胶的保护作用:当溶胶剂中加入高分子溶液达到一定浓度时,能显著提高溶胶剂的稳定性,不易发生聚集,这种现象称为保护作用,形成的溶液称为保护胶体。保护作用是由于较多的高分子物质吸附在溶胶粒子的表面上,形成类似高分子粒子的表面结构,使稳定性增加。但若加入溶胶的高分子化合物的量太少,则会降低溶胶的稳定性,甚至引起聚集,这种现象称为敏化作用。
(3)溶胶剂的相互作用:两种带有相反电荷的溶胶互相混合,也会发生沉淀。聚沉的程度与两胶体的比例有关,两种溶胶的用量在所带的电荷等电点时,才会完全沉淀,否则可能不完全沉淀或不沉淀。
二、溶胶剂的制备
溶胶剂可用分散法和凝聚法来制备。
(一)分散法
将药物的粗粒子分散到溶胶粒子分散范围的方法。
(1)研磨法:用机械力粉碎脆性强而易碎的药物,对于柔韧性的药物必需使其硬化后才能粉碎,常用的设备是胶体磨。
(2)超声分散法:利用超声波所产生的能量进行分散的方法。当超声波进入粗分散系统后,可产生相同频率的振动波,而使粗分散相粒子分散成胶体粒子。
(3)胶溶法:使新生的粗分散粒子重新分散的方法。如新生的AgCl粗分散粒子加稳定剂,经再分散可制得AgCl溶胶剂。
(二)凝聚法
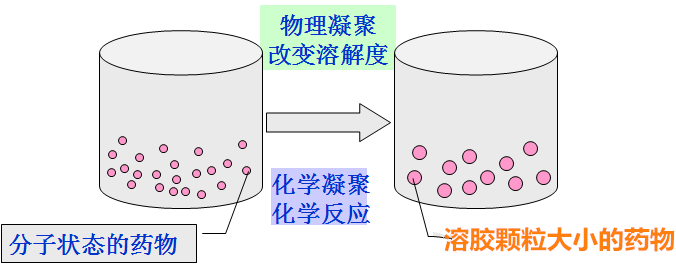
药物在真溶液中可因物理条件的改变或化学反应而形成沉淀,若条件控制适度,使溶液有一个适当的过饱和度,就可以使形成的质点大小恰好符合溶胶分散相质点的要求。
凝聚法包括:
(1)化学凝聚法:借助于氧化、还原、水解、复分解等化学反应制备溶胶。如硫代硫酸钠溶液与稀盐酸作用,产生新生态的硫分散于水中,形成溶胶。这种新生态的硫具有很强的杀菌作用。
(2)物理凝聚法:常用更换溶剂法,即将药物先制成真溶液,再向真溶液中加入其他溶剂,使溶质的溶解度骤然降低聚结成胶粒。
 练习题
练习题
溶胶剂的稳定性主要由什么因素决定?


