蛋白质分子结构包括一级结构、二级结构、三级结构、四级结构。
一、蛋白质的一级结构(基本结构)
1. 定义:
指蛋白质分子从N-端至C-端的氨基酸排列顺序。
2. 主要维系键: 肽键
举例:牛胰岛素的一级结构——由A链和B链组成,两条链间由2个-S-S-连接,A链有一个链内-S-S-
3. 一级结构是蛋白质空间构象和特异生物学功能的基础。
二、蛋白质的空间结构
1.蛋白质的二级结构
1.1 定义:
蛋白质分子中某一段肽链的局部空间结构,即该段肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。
1.2 主要维系键:
氢键
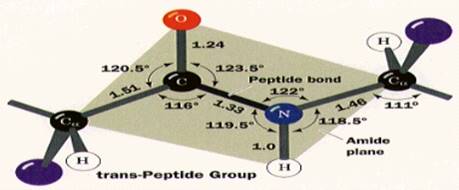
1.3 二级结构形成基础:肽单元
肽链中肽键(C-N)的键长为0.132nm,介于C-N单键长(0.149nm)和C=N双键长(0.123nm)之间,不能自由旋转,这样使肽键中的C、O、N、H四个原子和与它们相邻的Cα处在同一平面内,这个平面称为肽单元,又称肽键平面。肽键两端的Cα-N和Cα-C单键可以自由旋转,旋转的角度决定了两个相邻肽键平面的相对空间位置。
1.4 主要形式:
α-螺旋、β-折叠、β-转角、无规卷曲
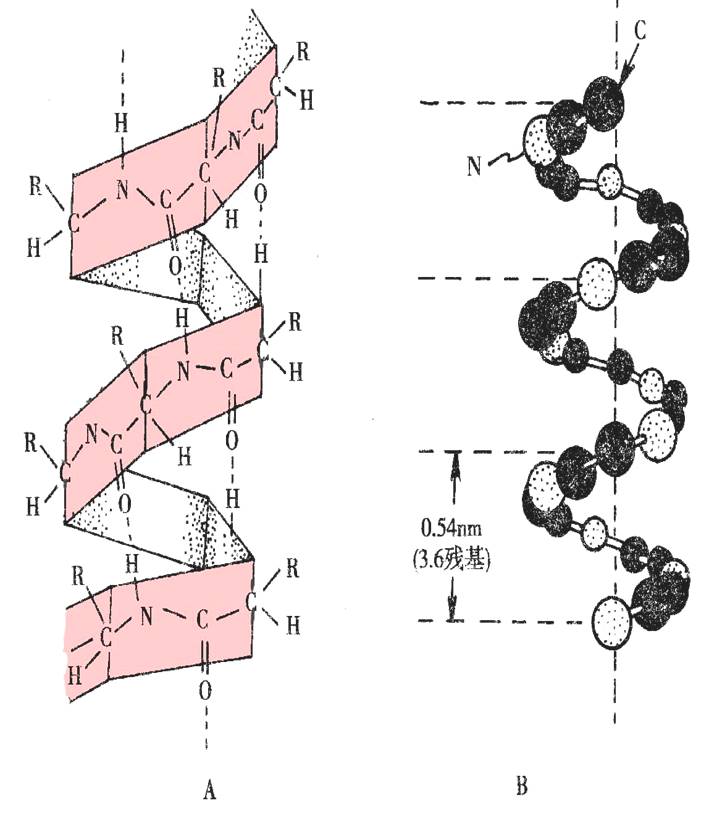
1)α-螺旋结构要点:
形成右手螺旋,侧链向外伸出;
每圈螺旋含3.6个氨基酸残基,螺距为0.54nm;
维系键为氢键,并且氢键的方向与螺旋轴基本平行。
2)β-折叠:
多肽链呈伸展状态,肽键平面沿长轴折叠呈锯齿状;肽段间通过氢键连接,氢键的方向与长轴垂直;
3)β-转角:
肽链出现180°回折,一般由四个氨基酸残基构成,第二个氨基酸常为脯氨酸。
4)无规卷曲:
用来阐述没有确定规律性的那部分肽链结构。
5)模体——具有特殊功能的超二级结构
2.蛋白质的三级结构
2.1 定义:
整条肽链中全部氨基酸残基的相对空间位置,即肽链中所有原子在三维空间的排布位置。
2.2 维系键:
次级键,包括疏水键、离子键(盐键)、氢键、范德华力等
2.3 结构域:
分子量大的蛋白质在形成三级结构时,多肽链上相互邻近的二级结构紧密联系形成1个或数个发挥生物学功能的特定区域。
3.蛋白质的四级结构
3.1 亚基:
体内有许多蛋白质分子含有两条或两条以上多肽链,每一条多肽链都有完整的三级结构,称为蛋白质的亚基。
3.2 定义:
蛋白质分子中各亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋白质的四级结构。
对于2个及以上亚基构成的蛋白质,单一的亚基没有生物学功能,完整的四级结构是其发挥生物学功能的保证。
3.3 维系键:
疏水作用、氢键、离子键等。
简单复习本知识点的内容:
1. 蛋白质一级结构的定义与维系键?
2. 蛋白质二级机构的定义与维系键?
3. 蛋白质二级结构有哪些类型?
4. α-螺旋、β-折叠的结构要点。
5. 蛋白质三级结构的定义与维系键?
6. 蛋白质四级结构的定义与维系键?


