什么是蛋白质(protein,Pr)?
蛋白质是生命的物质基础,种类繁多,人体含蛋白质种类在10万种以上。几乎所有的器官都含有蛋白质,并各自具有其特殊的结构,因而决定了蛋白质功能的多样性。
蛋白质的生物学重要性:
1)生物体重要的组成成分:含量高、分布广、种类多
2)作为生物催化剂:酶(具有催化功能的蛋白质)
3)代谢调节作用:激素(如胰岛素)
4)免疫保护作用:免疫球蛋白
5)物质的转运和储存:如载脂蛋白、血红蛋白等
6)运动与支持作用:如肌动蛋白、肌球蛋白、胶原蛋白等
7)参与细胞间信息传递
8)氧化供能:不到5%
蛋白质的元素组成
C、H、O、N、S
特点:
1)N的含量接近,平均为16%
2)1g氮相当于6.25g蛋白质
3)100克样品中Pr的含量 = 每克样品含氮克数×6.25×100
第一节蛋白质的分子组成
一、蛋白质的基本组成单位—氨基酸(aminoacid,AA)
1. 种类:
自然界存在300余种AA,但组成人体蛋白质的氨基酸仅有20种(因其有遗传密码编码)
2. 结构通式:
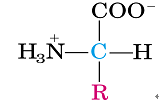
R为氨基酸侧链,20种AA的区别就在于侧链R基团不一样
3. 结构特点:
3.1均为α -氨基酸,但脯氨酸为α -亚氨基酸;
3.2除甘氨酸外,其余氨基酸有两种不同构型,即L型和D型。组成人体蛋白质的氨基酸都是均为L-构型,即L-α-氨基酸。
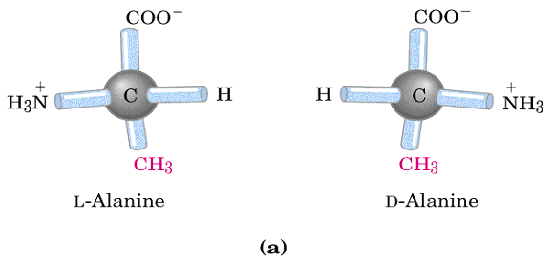
L-α-氨基酸 D-α-氨基酸
二、氨基酸的分类
根据侧链基团的结构和性质不同,将20种AA分为4类:
1. 非极性脂肪族R基氨基酸:
侧链为烃基、吲哚基、甲硫基等疏水性强的基团,包括Gly、Ala、Val、Leu、Ile、Met、Pro、
2. 极性不带电荷R基氨基酸:
侧链为亲水性基团,包括Ser、Cys、Asn、Gln、Thr
3. 芳香族R基氨基酸:
侧链含有苯环结构,包括Phe、Trp、Tyr
4. 带正电荷R基氨基酸:
侧链分别含有氨基、胍基和咪唑基,Lys、Arg、His
5. 带负电荷R基氨基酸:
含有羧基,Asp、Glu
*小结几种特殊的氨基酸:
1)支链氨基酸:Leu、Ile、Val
2)亚氨基酸:Pro
3)芳香族氨基酸:Phe、Trp、Tyr
4)含硫氨基酸:Met、Cys
5)酸性氨基酸:Asp、Glu
6)碱性氨基酸:Lys、Arg、His
7)含-OH的氨基酸:Ser、Thr
三、氨基酸的理化性质
1. 两性解离性质:
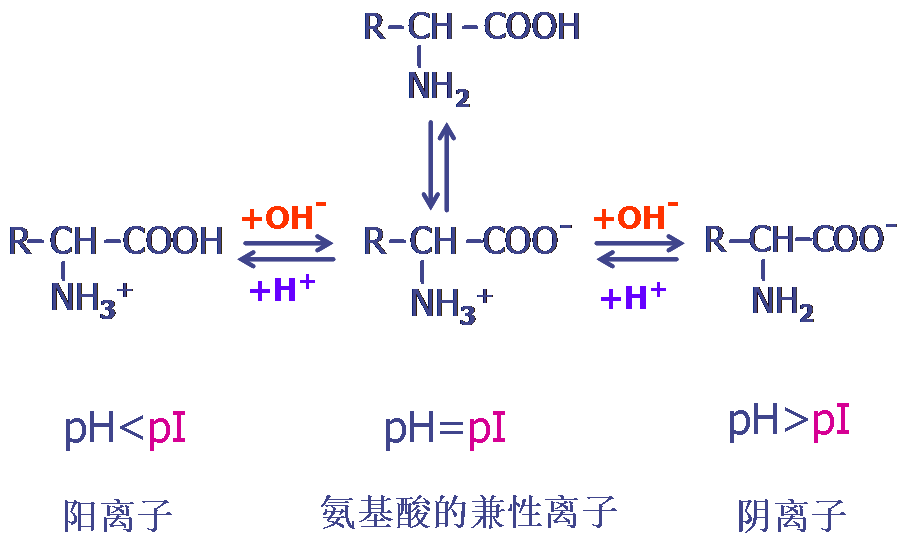
等电点(isoelectric point, pI) :在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。此时溶液的pH值称为该氨基酸的等电点。
2. 紫外吸收性质:
色氨酸、酪氨酸的最大吸收峰在 280 nm 附近。
3. 茚三酮显色反应:
氨基酸与茚三酮水合物共热,可生成蓝紫色化合物,其最大吸收峰在570nm处。由于此吸收峰值与氨基酸的含量存在正比关系,因此可作为氨基酸定量分析方法。


